Прионные инфекции что это
Прионные болезни
Прионные болезни – это медленно прогрессирующее поражение головного мозга, связанное с инфекционными белками (прионами). Патогномоничные симптомы данных заболеваний заключаются в развитии деменции, поведенческих, двигательных нарушений, экстрапирамидных расстройств, мозжечковых проявлений, миоклонии, других неврологических и психопатических признаков. Диагностика нозологий включает клинические, лабораторные, инструментальные критерии. Этиотропное лечение на современном этапе не разработано, обычно применяется патогенетическая и симптоматическая терапия.
МКБ-10
Общие сведения
Прионные инфекции относят к медленным инфекциям человека и животных. Впервые подобную патологию описали немецкие неврологи Якоб и Крейцфельдт в 1920-1923 г.г. Лишь в конце ХХ века американским молекулярным биологом Прузинером были открыты возбудители – белки прионы. Прионные болезни регистрируются во всех странах мира с частотой около 1-15 случаев на 1 млн. человек в год. Заболеванию подвержены все возрасты, при этом из-за длительного периода инкубации расстройства обычно регистрируют на 3-4 десятилетии жизни.
Причины
Причина заболеваний – инфекционные белковые соединения. Прионы представляют собой новый класс патогенов, состоящих только из измененных белковых молекул человека, никогда не содержат нуклеиновых кислот. Источником является больной человек либо животное. Прионные мутации нормального белка могут передаваться по наследству. Основные пути заражения:
Факторы риска
Группу высокого риска по заболеваемости составляют врачи (хирурги, акушеры-гинекологи, патологоанатомы), сотрудники лабораторной службы, ветеринары, работники мясоперерабатывающей промышленности, повара, потребители инъекционных наркотиков. Факторы риска:
Патогенез
Изучение патогенеза прионных болезней продолжается. Считается, что в норме прионный протеин содержится в головном мозге, участвует в межнейронной передаче импульса. Предполагают его существенную роль в регуляции возрастных изменений нейроцитов. Во время контакта с патологической формой приона возникает трансформация обычного протеина в измененный белок. Выявляется множество овальных вакуолей серого вещества мозга.
Вакуоли обнаруживаются в любом слое церебральной коры, как отдельно, так и в виде групп, разделенных на участки. Иногда вакуоли сливаются в микроцисты (более 200 микрон), что значительно искажает цитоархитектонику серого вещества. Кроме коркового слоя, спонгиозные изменения нейропиля и вакуолизация цитоплазмы нейронов наблюдается по ходу всех полей аммоновых рогов, по ходу зубчатой фасции, в области подкорковых ядер, таламусе и коре мозжечка.
Классификация
Прионные болезни представляют собой группу разнородных по способу заражения и клиническим проявлениям болезней, поэтому общепринятой классификации для них на сегодняшний день не существует. Возможно разделение нозологий по спорадическим, наследственно-сцепленным и инфекционным формам, а также в зависимости от преимущественно поражаемого органа:
Симптомы прионных болезней
Прионные болезни отличаются длительным инкубационным периодом – от момента заражения до первых симптомов проходят десятилетия. Нередко первой при данных состояниях регистрируется прогрессирующая деменция. Пациенты теряют критику к себе, навыки самообслуживания, страдают нарушениями памяти, когнитивных функций, становятся раздражительны, требовательны к окружающим. На поздних стадиях присоединяются симптомы нарушений мочеиспускания, тотальная ригидность мышц.
Болезнь Крейцфельдта-Якоба
Одним из первых проявлений служит быстро прогрессирующая деменция, период распада личности редко занимает более 2-х лет. Пациенты апатичны, страдают депрессией, головными болями, часто – нарушениями зрения, слуха, бессонницей. Возникают шаткость походки, спастический парез, миоклония. В трети случаев наблюдаются эпилептические приступы.
Синдром Альперса
Возникает в младенческом возрасте, обычно манифестирует с генерализованных судорожных припадков, задержки психомоторного и физического развития и прогрессирующего слабоумия. Дети с ранней формой патологии рождаются с микроцефалией, деформацией костно-суставной системы, нарушениями внутриутробного развития, низкой массой тела. Иногда болезнь начинает развиваться в 16-18 лет.
Фатальная семейная бессонница
Дебютирует с панических атак, фобий, тревожности, повышенного потоотделения. У пациентов нарушаются циркадные ритмы, появляются галлюцинаторные, двигательные нарушения. Позже возникает период полного отсутствия сна, резкого похудания, появления и прогрессирования симптомов слабоумия. На терминальной стадии больные не реагируют на обращенную к ним речь, не способны вставать с кровати.
В начале болезни симптомы куру включают головную и суставную боль. Затем к ним присоединяется сильная слабость, дрожание головы и конечностей, вследствие чего больные передвигаются только с опорой либо на инвалидной коляске. Возникает атетоз, миоклонические судороги. Прогрессирование куру приводит к деменции. В поздней стадии пациенты прикованы к постели, нередко значительно худеют из-за невозможности жевать и глотать пищу, не контролируют мочеиспускание и дефекацию.
Прогрессирующая болезнь мышечного истощения у пожилых
Характеризуется медленно нарастающей слабостью в мышцах, миалгиями, не купирующимися стероидными средствами. Заболевание начинается с эпизодов падений, спотыканий, невозможности застегивания одежды, затруднения проглатывания пищи. Далее возникает атрофия мышечных волокон, обездвиживание пациентов. Существует опасность асфиксии при приеме пищи и воды из-за слабости пищеводной мускулатуры.
Синдром Герстманна-Штраусслера-Шейнкера
При синдроме Герстманна-Штраусслера-Шейнкера деменция возникает реже и прогрессирует медленнее, чем при других прионных болезнях (до 5-10 лет). Характерными симптомами считаются мозжечковые нарушения ходьбы и произвольных движений, расстройства ориентации в пространстве, глотания и звукопроизношения. В терминальной стадии заболевания развивается глубокое слабоумие, дизартрия.
Осложнения
Одними из частых осложнений прионных заболеваний являются пневмонии, дыхательная недостаточность из-за гипотонии межреберных мышц. При ненадлежащем уходе за лежачими больными возникают пролежни, абсцессы, сепсис. Пожилые люди могут получать различные травмы в пределах собственного жилья и на улице.
Пренебрежение пациентами гигиеническими процедурами увеличивает вероятность гнойных кожных заболеваний, нередки восходящие инфекции мочеполовых путей. Неадекватное питание (монодиета), отказ от приема медикаментов приводит к декомпенсации хронической патологии, высокому риску гипертензионного криза, диабетической комы, острой сердечно-сосудистой недостаточности.
Диагностика
Диагностика прионных болезней преимущественно осуществляется неврологами. Врачи других специальностей привлекаются при наличии показаний. Обязательно обследование всех половых партнеров больных, особенно при имеющихся незащищенных сексуальных контактах. Основные лабораторно-инструментальные и клинические исследования:
Дифференциальная диагностика
Дифференциальная диагностика проводится с болезнями Паркинсона, при которой происходит поражение нейронов ствола головного мозга, и Альцгеймера, сопровождающейся выраженной деменцией, но практически всегда без поражения мозжечка. Для нейросифилиса характерны маниакально-депрессивные эпизоды с прогрессирующим слабоумием, для герпетического энцефалита – нарушения работы черепно-мозговых нервов, геми- и парапарезы.
Лечение прионных болезней
Лица, имеющие симптомы, подозрительные на прионные болезни, должны быть госпитализированы. Назначается постельный либо полупостельный режим. В случае тяжелых психопатических расстройств необходимо обеспечивать безопасность пациента и персонала. Диеты не предусмотрено, кроме исключения сырого мяса из рациона. Многие пациенты с прионными инфекциями отказываются от еды, поэтому может быть назначена парентеральная нутритивная поддержка.
Консервативная терапия
Протоколов ведения пациентов с прионными болезнями в настоящее время не разработано. Поиски этиотропных препаратов находятся в стадии активных исследований и экспериментов с обнадеживающими результатами. Медикаментозное сопровождение преимущественно складывается из симптоматической, патогенетической терапии; нередко пациенты нуждаются в реанимационной, паллиативной помощи.
Экспериментальная терапия
Опубликованные в 2019 году результаты опытов над лечением прион-инфицированных мышей показали, что наблюдается терапевтический эффект от липосомно-малых интерферирующих РНК-пептидных комплексов (LSPCs) в виде нарушения репликации прионов в мозге у 90% подопытных и увеличения их выживаемости (22%). Сходные результаты были получены при интрацеребральном применении лентивирусов. Исследования продолжаются.
Перспективным направлением считается изучение влияния искусственно созданных непатогенных прион-подобных белков, которые могут самораспространяться, при этом снижать репликацию инфекционных единиц, задерживая и подавляя нейродегенеративные процессы. Существует концепция моноклональных антител, распознающих прионные соединения, ингибирующих их репликацию и задерживающих развитие болезни у животных.
Предполагается положительный профилактический эффект доксициклина в доклинический период у пациентов, являющихся носителями генов фатальной семейной бессонницы. В ряде экспериментов животные, получавшие гетерологичный прионный белок, демонстрировали замедленное начало клинических симптомов, значительное увеличение среднего времени выживаемости по сравнению с контрольной группой.
Прогноз и профилактика
Прогноз для пациентов из-за отсутствия этиоропных препаратов крайне неблагоприятный. Летальность при прионных болезнях достигает 100%, продолжительность жизни после установления диагноза зависит от формы прионной инфекции и составляет от четырех месяцев при куру до 4-10 лет (синдром Герстманна-Штраусслера-Шейнкера).
Специфической профилактики не разработано. Неспецифические методики – соблюдение правил дезинфекции и стерилизации в стационарах, при эндоскопических процедурах, в патологоанатомических бюро. Важным является обеспечение безопасности пищевых продуктов, отказ от употребления сырого мяса. Учитывая половой путь инфицирования, необходимо использовать барьерные средства контрацепции. Предложены методы генодиагностики прионных болезней.
Прионы: исследования таинственных молекул продолжаются
Путь прионов
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Прионные заболевания — феномен, открытый в двадцатом веке, и в нем же начавший играть большую роль: увеличение продолжительности жизни в развитых странах привело к тому, что все больше людей стало доживать до «своего Альцгеймера» или «своего Паркинсона». Природа нейродегенеративных заболеваний продолжает оставаться туманной, и ученые пока исследуют только отдельные их аспекты — например, причину развития именно в старческом возрасте или способность передаваться от одних видов живых существ другим.
«Био/мол/текст»-2012
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2012 в номинации «Лучшее новостное сообщение».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Всё началось с того, что в 20 веке учёные заинтересовались природой необычных заболеваний человека и животных: куру, Крейтцфельда-Якоба, скрэпи. Заметное сходство патологии этих болезней дало основание для гипотезы об их инфекционности, что впоследствии было экспериментально подтверждено. Тогда возник вопрос о возбудителе данных заболеваний. Прежде чем был найден ответ, были выявлены необычайные свойства возбудителей: они не размножаются на искусственных питательных средах, устойчивы к высокой температуре, формальдегиду, различным видам излучений, действию нуклеаз. Очистка инфекционного материала и его изучение позволило провозгласить о том, что «во всём виноват» белок, который 30 лет назад получил название прион (от англ. pr[otenacious infect]ion — белковая инфекция).
Так, известные американские учёные — вирусолог и врач Д.К. Гайдушек, раскрывший инфекционную природу прионных болезней, в 1976 г. и биохимик С.Б. Прузинер, который определил прионы и разработал прионную теорию, в 1997 г., — были удостоены Нобелевских премий. Их работы стали импульсом для последующих исследований, благодаря которым были изучены новые виды прионных инфекций. Но, даже несмотря на неугасающий интерес к «прионной теме», образование прионов до сегодняшнего дня остаётся загадкой.
Биологическая сущность прионов
Рисунок 1. Метафора нейродегенеративного поражения мозга — это губка, в которую превращается нервная ткань в результате массовой гибели нейронов.
Существует упрощенное представление, что полимеризованные прионные фибриллы «протыкают» нейрон, что вызывает его гибель. На самом деле это не совсем так: предшествующие фибриллярной стадии сферические агрегаты прионов также обладают токсичностью (по крайней мере, для болезни Альцгеймера): «Альцгеймеровский нейротоксин: ядовиты не только фибриллы». — Ред.
Но как может нормальный природный белок (обозначается PrP C ) вдруг стать патологическим (PrP Sc ; Sc — от слова «scrapie»)? Что должно произойти? Как и в случае «обычной» инфекции, для такой трансформации необходима встреча с молекулой инфекционного приона. Существуют два пути передачи этой молекулы: наследственный (за счёт мутаций в гене, кодирующего белок) и инфекционный. То есть внедрение приона может произойти неожиданно — например, при употреблении в пищу недостаточно хорошо прожаренного или сваренного мяса (в котором должна присутствовать форма PrP Sc ), при переливании крови, при трансплантации органов и тканей, при введении гормонов гипофиза животного происхождения.
И тогда происходит удивительное событие: нормальные молекулы белка, контактируя с патологическими, сами превращаются в них, изменяя свою пространственную структуру (механизм трансформации остаётся загадкой и по сей день) [1]. Таким образом прион, как самый настоящий инфекционный агент, заражает нормальные молекулы, запуская цепную реакцию, разрушительную для клетки.
Некоторые сведения о прионах
Условия возникновения заболеваний
Условия возникновения прионовых болезней уникальны. Они могут формироваться по трём сценариям: как инфекционные, спорадические и наследственные поражения. В последнем варианте главную роль играет генетическая предрасположенность [2].
Знаменитый исследователь прионов Стэнли Прузинер (Stanley Prusiner) выделяет две поразительные особенности, присущие таким нейродегенеративным заболеваниям, как болезнь Крейтцфельда-Якоба, болезнь Альцгеймера и болезнь Паркинсона. Первая заключается в том, что более 80% случаев заболевания — спорадические (то есть, случайные, возникающие «сами собой»). Вторая: несмотря на то, что большое количество мутантных белков, специфичных к определённой болезни, экспрессируется в процессе зародышевого развития, формы наследования этих нейродегенеративных заболеваний проявляются позже. Это предполагает, что некоторые процессы происходят во время старения, которое «дает волю» болезнетворным белкам [5]. Более 20 лет назад автор утверждал, что данный процесс включает случайный рефолдинг (пересворачивание) белка в неправильно свёрнутый, что соответствует переходу в инфекционное состояние — прион.
Интересные факты насчет болезни Альцгеймера: ее вероятность может повышаться вследствие хронического недосыпания («Новый шаг к пониманию болезни Альцгеймера: возможно, недосыпание является одним из факторов риска»), а сам альцгеймеровский нейропептид (β-амилоид Aβ) может быть частью системы врожденного иммунитета («Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета»). — Ред.
В последнее десятилетие интерес к этой теме возобновился в связи с возможностью развития диагностики и эффективной терапии [5]. Появилось множество различных объяснений для возрастных нейродегенеративных болезней, — например, окислительная модификация ДНК, липидов и/или белков; соматические мутации; измененный врождённый иммунитет; экзогенные токсины; несоответствия ДНК—РНК; нарушение работы шаперонов; отсутствие одного из аллелей гена [5]. Альтернативным комплексным разъяснением служит то, что различные группы белков могут формировать прионы. Несмотря на то, что небольшое количество прионов может быть удалено посредством путей белковой деградации, их чрезмерное накопление с течением времени позволяет прионам самостоятельно распространяться в организме (рис. 2), что приводит к нарушению деятельности центральной нервной системы [5].
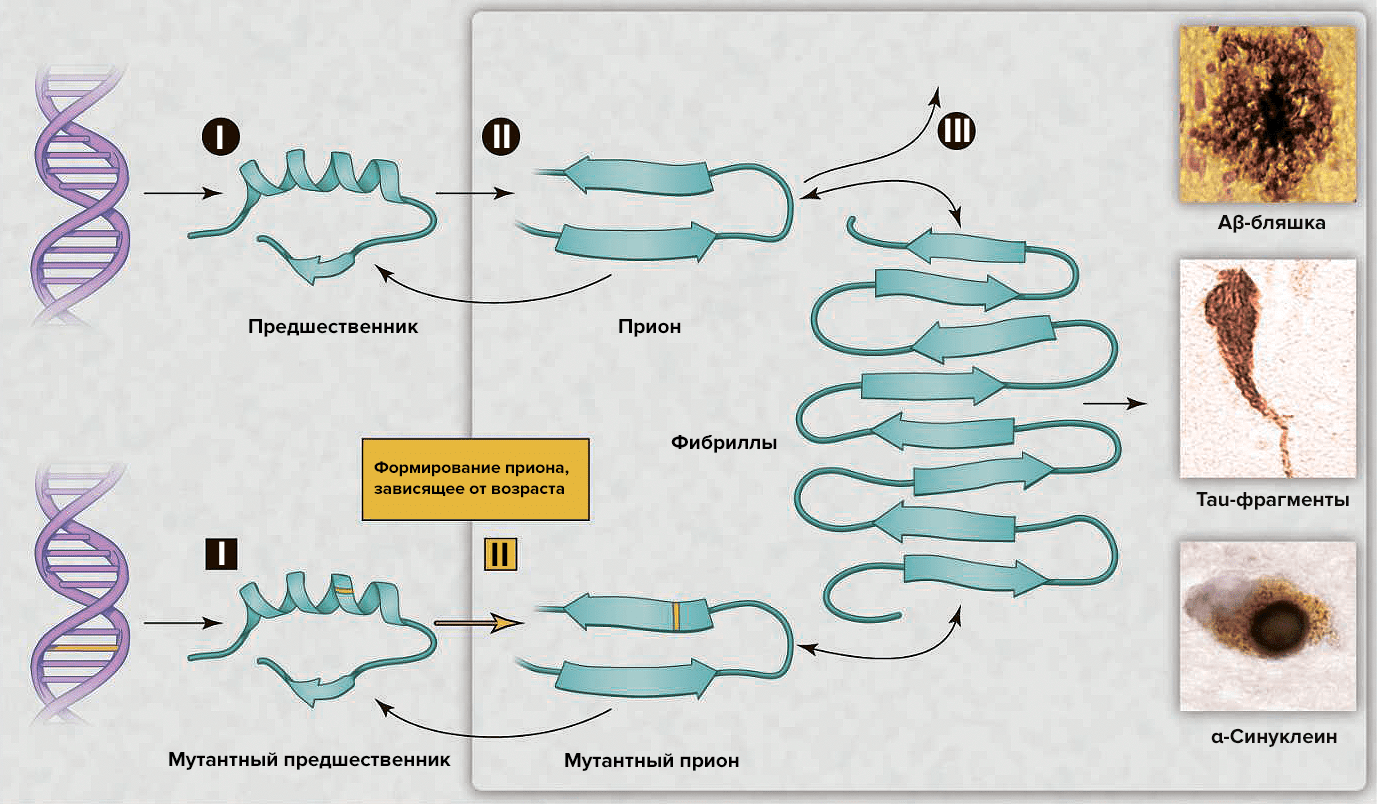
Рисунок 2. Процессы нейродегенерации, вызванной прионами. Сверху: накопление «нормального» прионного белка повышает его вероятность перехода в токсичную конформацию, которая описывается бóльшим содержанием β-структуры. Прионы наиболее патогенны в форме олигомеров; после образования фибрилл токсичность снижается. В зависимости от того, о каком конкретно прионном белке идет речь, в патологическом состоянии он может образовывать бляшки, клубки или тельца включения. Возможные пути лекарственного вмешательства: (I) снижение концентрации «нормального» белка-предшественника; (II) ингибирование образования прионной формы; (III) уничтожение токсичных агрегатов. Снизу: Наследственная старческая нейродегенерация объясняется двумя событиями: наличием мутантной формы предшественника и образованием из него приона, готового к олиго- и полимеризации с образованием токсичных форм.
Группы риска прионных заболеваний
Вот кого прионные заболевания могут настичь с наибольшей вероятностью:
Лабораторная диагностика и лечение
Диагностика базируется на внутримозговом заражении мышат или хомяков, у которых медленно (до 150 дней) развивается соответствующее заболевание, если пациент был болен [2]. Часто проводится гистологическое исследование головного мозга погибших животных [2].
К сожалению, до настоящего времени еще не разработаны эффективные методы лечения прионовых болезней, хотя попытки предотвратить конформационный переход нормального белка в аномальный производятся. Поэтому самым надёжным способом предупреждения развития инфекционных форм является профилактика [2].
Особенно актуальным становится решение «прионного вопроса» в связи с нарастающей угрозой возникновения эпидемии через инвазивные медицинские операции и даже при приёме лекарственных средств.
Перспективы
По-видимому, интерес к прионам не угаснет до тех пор, пока предположения на их счёт полностью не подтвердятся и не будут найдены эффективные способы лечения прионных заболеваний. В статье [6] говорится о необходимости современного исследования, которое требует тщательного рассмотрения чужеродных прионов в экстраневрональных тканях.
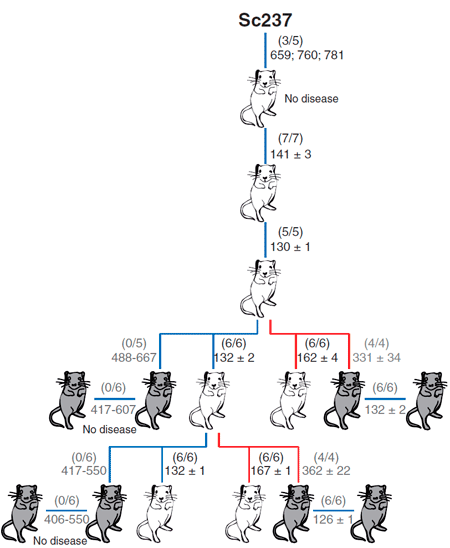
В качестве модельных объектов авторы использовали мышей: две линии, которые трансгенно экспрессировали овечий прионный белок, и одну линию, которая экспрессировала человеческий прионный белок (рис. 3). Задачей было сравнить эффективность межвидовой передачи инфекции посредством тканей мозга и селезёнки. Внутримозговое заражение чужеродным прионным белком выражалось в отсутствии или небольшом количестве инфекционного агента в мозгах этих мышей. Однако инфекционные чужеродные прионы обнаруживались в селезёнке на более ранних этапах заражения в сравнении с моментом, когда были использованы нейротропные прионы, тем самым определяя, что лимфатическая ткань может быть более пермиссивной к распространению чужеродных прионов по сравнению с мозгом.
Рисунок 3. Способность приона хомяков Sc237 заражать и передаваться при введении в мозг или селезенку трансгенным мышам, имеющим прионный белок PrP овцы (tg338; белые мыши) или человека (tg7; серые мыши). Число заболевших/инъецированных мышей показано в скобках; ниже приведено среднее время жизни (в днях).
Чем вызвана эта предпочтительная репликация прионов в лимфатических тканях, пока неизвестно. Однако полученные данные показывают, что человек может быть более чувствительным к чужеродным прионам, чем предполагалось ранее на основании присутствия прионов в мозгу, и по этой причине бессимптомный переносчик прионной болезни может быть не распознан. Это ещё раз подтверждает, что такая могущественная биомолекула как прион таит в себе немало загадок, раскрытие которых, возможно, поможет в понимании ряда неразрешимых проблем человечества.
Прионные инфекции что это
Прионовые болезни – это прогрессирующие нейродегенеративные заболевания с летальным исходом. Механизм возникновения прионовых болезней изучен не до конца, однако в настоящее время считается, что заболевание развивается при накоплении в клетках центральной нервной системы избыточного количества патологического прионного белка.
Прионовые болезни встречаются очень редко – ежегодно регистрируется один случай на миллион человек. На данный момент известны 5 разновидностей этой патологии – спорадическая болезнь Крейцфельда-Якоба, новый вариант болезни Крейцфельда-Якоба, куру, синдром Герстманна-Штройслера-Шейнкера и фатальная семейная инсомния. Наиболее широко распространена спорадическая болезнь Крейцфельда-Якоба.
Болезнь может возникать попадании в организм патологического прионного белка извне (от человека или животного), иметь наследственную природу или возникать спонтанно как следствие генетических аномалий de novo. Течение определенных вариантов зависит от типа прионного белка. Инкубационный период может достигать 15 лет. Продолжительность жизни пациентов с прионными болезнями чаще всего составляет около года, реже – чуть более двух лет. Лечениесимптоматическое.
Трансмиссивная губчатая энцефалопатия.
Human prion diseases, transmissible spongiform encephalopathies, TSE.
Симптомыпатологии могут возникнуть в период от полугода до 10-15 лет после заражения. Проявления болезни могут развиваться постепенно, с неспецифических симптомов – бессонницы, вялости, апатии, заторможенности. В ряде случаев болезнь начинается внезапно и может напоминать делирий. Наиболее частыми проявлениями прионовых болезней являются:
Все проявления прионных болезней неуклонно прогрессирую, приводя в конечных стадиях болезни к акинетическому мутизму и коме.
Общая информация о заболевании
Прионные болезни встречаются как у человека, так и среди животных. Патогенез прионных болезней связывают с накоплением в организме патологического прионного белка. Прионный белок в норме присутствует в клетках организма животных и человека – это так называемый нормальный прионный белок. Он находится в наибольших количествах в нейронах и частично в клетках лимфоидной ткани. Прионный белок устойчив к высоким температурам, радиации, действию протеаз и химических веществ – алкоголя, формалина и других. Функции прионных белков неизвестны. Информация о структуре этих полипептидов закодирована в коротком плече 20 хромосомы у человека.
При изменении конфигурации нормальный прионный белок может превращаться в патологический. Патологический прионный белок, в свою очередь, способен запускать механизм преобразования нормального прионного белка в патологическую форму. Патологический прионный белок может возникать в организме спонтанно. В некоторых случаях накопление патологического прионного белка связано с наследственными генетическими нарушениями. На данный момент известно порядка 30 вариантов генетических нарушений, в результате которых меняется структура прионного белка. В ряде случае прионные болезни носят инфекционную природу. Это означает, что патологический прионный белок может попасть в организм человека извне – при пересадке роговицы, твердой мозговой оболочки, нейрохирургических операциях. В данном случае большое значение имеет устойчивость прионов к любым видам стерилизации. Известны случаи заражения патологоанатомов. Считается, что существует вероятность заражения человека при употреблении мяса коров, зараженных коровьим бешенством.
Несмотря на то, что часть прионных заболеваний имеет инфекционную природу, прионы отличаются от других инфекционных агентов – в их составе отсутствуют нуклеиновые кислоты (ДНК или РНК). Это осложняет процесс изучения патогенеза прионовых болезней. Известно, что накопление патологического прионового белка приводит к разрушению клеток нервной системы, мультифокальным спонгиоформным (губкоподобным) повреждениям тканей нервной системы, астроглиозу при отсутствии признаков воспалительной реакции. В связи с устойчивостью к действию протеаз, патологический прионный белок не может быть выведен из организма. Около 85 % пациентов погибают в течение года после появления первых симптомов болезни.
Кто в группе риска?
К сожалению, на данный момент диагностика прионных болезней возможна лишь после возникновения клинических проявлений, то есть на этапе, когда болезнь зашла уже достаточно далеко. Раннее, пресимптоматическое выявление данной патологии невозможно. Схема диагностики прионных болезней не разработана окончательно.