При чем не показана специфическая гипосенсибилизация
Аллерген-специфическая иммунотерапия
АСИТ (СИТ) – аллерген-специфическая иммунотерапия (специфическая гипосенсибилизация, специфическая аллерговакцинация, иммунотерапия аллергенами)
заключается во введении пациенту возрастающих доз аллергена, к которому установлена повышенная чувствительность.
АСИТ является единственным примером противоаллергического лечения, воздействующего на все звенья механизма аллергического процесса и обладающего длительным профилактическим эффектом после завершения лечебных курсов.
Эффективность, безопасность иммунотерапии и ее преимущество перед медикаментозным лечением доказаны в огромном количестве рандомизированных клинических исследований. Также в исследованиях показано, что чем раньше начинается проведение иммунотерапии, тем выше вероятность положительного терапевтического действия.
Изменения в иммунной системе при проведении АСИТ
Проведение иммунотерапии в большинстве случаев позволяет:
Аллергены, при гиперчувствительности к которым возможно проведение АСИТ:
Показания к проведению АСИТ:
Эффективность гипосенсибилизаиии:
Эффективность гипосенсибилизации зависит от числа вводимых лечебных аллергенов, метода введения, переносимости и др.
Противопоказания к проведению АСИТ:
Методика проведения АСИТ:
В нашей клинике АСИТ проводится аллергенами для подкожного введения французкой компании Фосталь ( Аллерген пыльцы деревьев), для подъязычного применения чешской компании Севафарма( аллергены деревьев, злаковых и сорных трав, бытовые аллергены, а также аллергенами плесеней), таблетированными аллергенами итальянской компании «Лофарма» (Лайсграс пылца злаковых трав и клещей домашней пыли).
Запись на прием к врачу аллергологу
Обязательно пройдите консультацию квалифицированного специалиста в области аллергологических заболеваний в клинике «Семейная».
При чем не показана специфическая гипосенсибилизация
В настоящее время известно, что реакции типа I на широко распространенные внешние агенты часто являются механизмом, вызывающим астматический ответ, особенно у лиц с атонией, склонных к образованию антител IgE.
Реакции типа III могут быть ответственны за некоторые поздние ответы, наблюдаемые при экспериментальной провокации и вызывающие более затяжную астму.
Астма, какой ее видят клиницисты, представляет собой сложный полифакторный ответ, имеющий многочисленные как иммунологические, так и неиммуиологические индуцирующие факторы.
В настоящее время исследуются механизмы, посредством которых иммуннонейрофармакологические события в тканях и вокруг них могут вызвать атоническую экзогенную астму, неатопическую экзогенную астму и криптогенную астму.
Специфическую десенсибилизацию при аллергических состояниях впервые предложил Noon (1911) и позднее вновь изучил Cooke (1918). Повторное парентеральное введение очень малых доз аллергена стимулирует образование термостабильных антител IgG (блокирующих антител) [Loveless, 1940]. Эти антитела могут ослаблять кожные реакции па аллерген, и у больных с высокими титрами блокирующих антител гипосенсибилизация, видимо, дает лучший клинический эффект [Lichtenstein et al., 1971]. По мере повышения уровня блокирующих антител снижается уровень IgE и уменьшается рост его во время сезона пыльцы. Вместе с тем при десенсибилизации снижается и чувствительность клеток (согласно измерениям в системе доза — ответ по выбросу гистамииа из периферических лейкоцитов при воздействии антигена).
Клинические попытки десенсибилизации при астме трудно интерпретировать и подытожить ввиду наличия весьма многочисленных переменных факторов, таких, как клинический отбор больных, методы наблюдения за результатами и дозировкой. Необходимо уточнить также различие между улучшением течения ринита, с одной стороны, и облегчением астмы — с другой. Согласно результатам немногочисленных тщательных исследований, действительно можно полагать, что у больных астмой целесообразно проводить десенсибилизацию к пыльце [МсАllen, 1961]. Значительно менее показательны результаты опытов с существующими сейчас препаратами домашней пыли. Некоторые авторы отмечают улучшение [Aas, 1971], тогда как в других исследованиях выраженного эффекта не наблюдалось [Британская ассоциация по туберкулезу и заболеваниям органов грудной клетки, 1968]. Видимо, наилучших результатов следует ожидать у больного сезонной астмой, сопровождающейся сенной лихорадкой, у которого имеется аллергия только к пыльце. Результаты, очевидно, должны быть особенно благоприятными, если у больного появляются высокие титры блокирующих антител IgG.
Технические аспекты для неспециалистов. Экстракты пыльцы стандартизуются в единицах Нуна. Одна единица Нуна равна 0,001 мг/мл экстракта, или в пересчете на содержание белкового азота: 1 единица белкового азота равна 0,00001 мг/мл (10-5 мг/мл).
Экстракты приготавливают в виде водных стабилизированных растворов или в виде препаратов пролонгированного действия. Экстракты, преципитированные квасцами (Alvac — Bencards, Allpyral — Dome), удобно вводить в виде еженедельных инъекций на протяжении примерно 8 нед. Водные растворы приходится вводить чаще и проводится больше инъекций. Лично я считаю, что препараты пролонгированного действия не следует применять, так как в литературе описаны индуцированные ими тяжелые местные реакции. Десенсибилизацию к пыльце наиболее целесообразно проводить перед наступлением сезона. В Великобритании это означает, что начинать ее следует в феврале. Инъекции, проводимые во время сезона пыльцы, могут вызвать сильное обострение симптомов. Улучшение может быть достигнуто после второго или третьего года инъекций, и если имеется положительный результат, то, видимо, следует назначать лечебные курсы на протяжении 3 лет. Однако подробная схема курсов остается эмпирической, и многие вопросы не были подвергнуты научному сравнительному анализу.
— Вернуться в оглавление раздела «Пульмонология.»
ГИПОСЕНСИБИЛИЗАЦИЯ
В зависимости от применяемых средств различают специфическую и неспецифическую Гипосенсибилизацию. Термин «десенсибилизация (специфическая и неспецифическая)» употреблять не рекомендуется, т. к. полного исчезновения чувствительности организма к аллергену практически не наступает.
Специфическая гипосенсибилизация
Специфическая гипосенсибилизация — снижение чувствительности организма к аллергену путем введения больному экстракта того аллергена, к к-рому имеется повышенная чувствительность. Специфическую Гипосенсибилизацию проводят при бронхиальной астме, крапивнице, поллинозе, аллергической риносинусопатии и других аллергических реакциях. Этот метод был впервые предложен Нуном (L. Noon) в 1911 г. для лечения поллиноза, а 10 лет спустя впервые применен Каулфилдом (V. Caulfield) при бронхиальной астме.
Механизм специфической Г. лучше всего изучен при поллинозе (см.). Большинство исследователей считает, что при парентеральном введении аллергенов в организме больного образуются блокирующие (защитные) антитела, открытые Р. Куком в 30-х гг. Эти антитела обладают большим сродством к специфическим аллергенам, чем реагины — кожносенсибилизирующие антитела, ответственные за развитие аллергической реакции немедленного типа (см. Антитела, аллергические антитела).
При попадании специфических аллергенов в организм через дыхательные пути (напр., при поллинозе, бронхиальной астме) антитела «блокируют» их, и т. о. предотвращается развитие аллергической реакции. Снижение же титров реагинов наступает только после длительной (в течение нескольких лет) специфической Г. Ю. А. Самушия и С. А. Дахиль (1971) при специфической Г., проведенной 102 больным поллинозом, выявили блокирующие антитела при отличном клин, эффекте в 80% случаев, при хорошем — в 76%, удовлетворительном — в 33% и при отсутствии клин, эффекта — только в 25 %. Они отметили также четкую зависимость между степенью снижения титра реагинов и длительностью специфической Г. Такие же закономерности в отношении титров общих и специфических IgE отметили с помощью радиоаллергосорбентного метода (см.) Анфоссо-Капра, Вервлоэ (F. Anfosso-Capra, D. Vervloet, 1974) и др.
Т. о., специфической Гипосенсибилизации при аллергических заболеваниях можно достигнуть только полного или частичного клин, эффекта, а прямые и непрямые тесты со специфическим аллергеном остаются положительными, но в меньших титрах. Механизм специфической Г. при атопической форме бронхиальной астмы и других атопических болезнях (см. Атопия), по-видимому, тот же, что и при поллинозе; механизм специфической Г. бактериальными аллергенами еще недостаточно изучен.
Специфическую Г. можно сочетать с применением антигистаминных препаратов, динатрия хромогликата (интал), бронхолитиков, седативных средств. При этом не рекомендуется применение препаратов глюкокортикоидных гормонов, а проведение профилактических прививок против инфекционных заболеваний возможно только в исключительных случаях.
В зависимости от этиологии атопического заболевания проводят предсезонную, круглогодичную и сезонную специфическую Г. перечисленными выше аллергенами.
Предсезонную Г. часто применяют при поллинозе и всегда при аллергических реакциях на укусы насекомых. Г. можно начинать сразу после исчезновения из окружающей среды специфических аллергенов (напр., пыльцы растений), но не позже чем за 2 мес. до периода их появления. Иногда предсезонную Г. поллиноза проводят путем эндоназального введения специфического аллергена в возрастающих концентрациях. Вортманн (F. Wortmann, 1969) при поллинозе у детей получил хороший эффект при назначении per os пчелиного меда и различных ароматических сахаров, содержащих 10% сухой пыльцы.
Круглогодичную специфическую Г. применяют часто при пылевой бронхиальной астме. Дважды в неделю делают инъекцию пылевых аллергенов до достижения наиболее оптимальной для каждого больного дозы, а затем переходят на поддерживающую терапию, при к-рой эту дозу аллергена вводят 1 раз в 1—2 нед. в течение 3—5 лет. Иногда круглогодичную специфическую Г. проводят при поллинозе, причем специфический пыльцевой аллерген вводят и в период цветения растений, но в меньшей дозе.
Реже при пылевой бронхиальной астме и поллинозе проводят лечение в аллергологическом стационаре ускоренным методом, когда инъекции пылевых или пыльцевых аллергенов делают ежедневно (или дважды в день) до достижения наиболее оптимальной и хорошо переносимой для каждого больного дозы (в течение 3—4 нед.) с перерывом в 5—6 мес.
Сезонную Гипосенсибилизацию иногда проводят при поллинозе в период цветения растений и клин, проявлений болезни. Специфический пыльцевой аллерген в небольших концентрациях и дозах вводят больному, напр, методом «кожных квадратов», предложенным в 1959 г. Бламутье и Гибером (Р. Blamoutier, L. Guibert): на коже внутренней поверхности предплечья делают скарификационную сетку длиной 10 см и шириной 5 см, интервал между скарификационными линиями 5 мм; на эту сетку наносят 0,2 мл специфического аллергена. Сезонная Г. менее эффективна, чем предсезонная и круглогодичная.
Метод специфической Г. стандартными аллергенами при поллинозе, атопической бронхиальной астме и анафилактических реакциях на укусы насекомых дает высокий клин, эффект (75—90%), однако недостатком его является длительность лечения и большое число инъекций. Для сокращения числа инъекций аллергенов при специфической Г. Вольфромм (R. Wolfromm, 1959) с соавт. предложил одновременно со специфическим стандартным аллергеном вводить 0,1 мл 0,2% геля гидрата окиси алюминия с целью создания в организме депо аллергена. Инъекций делают 1 раз в неделю по укороченной схеме (0,2—0,8 мл аллергена в каждом разведении вместо 0,1—0,2—0,4—0,8 мл). Число инъекций при специфической Г. можно уменьшить также путем применения пиридиново-гидрокарбонатных аллергенов, адсорбированных гидратом окиси алюминия. Этот препарат под названием аллпирал предложен Фуксом и Страуссом (A. Fuchs, М. В. Strauss) в 1959 г. Для сокращения числа инъекций аллергенов при поллинозе за рубежом используют также аллергены, депонированные при помощи тирозина.
Специфическую Г. при инфекционно-аллергической форме бронхиальной астмы, предастме и крапивнице (бактериального происхождения) проводят в нашей стране при помощи стандартных микробных аллергенов.
При инфекционно-аллергической бронхиальной астме и предастме применяют также препараты, содержащие не только микробные клетки, но и их экзопродукты — токсины, ферменты. В Научно-исследовательской аллергологической лаборатории (НИАЛ) АМН СССР разработаны методы специфической диагностики и специфической Г. при инфекционно-аллергической форме бронхиальной астмы и предастме микробными вакцинами, приготовленными на кровяных пластинках, покрытых целлофановыми дисками (аутомоно- и гетеромоновакцины). У больного берут мазки со слизистой оболочки носа, зева, бронхов (при бронхоскопии). Из каждого высеянного от больного микробного штамма (патогенного, условно патогенного, сапрофитного) готовят аутомоновакцину, содержащую 1 млрд. микробных тел в 1 мл. Для специфической Г. используют набор аутомоно- или гетеромоновакцин, вызвавших положительную реакцию на внутрикожные и ингаляционные провокационные тесты (обычно замедленного типа). Начальную концентрацию стандартных микробных аллергенов определяют путем аллергометрического внутрикожного титрования специфического аллергена, начальную концентрацию микробных ауто- и гетеровакцин, приготовленных на целлофановых дисках, определяют путем внутрикожного титрования моновакцин, содержащих различные количества микробных тел (1000, 10 000, 100 000 и т. д.) в 1 мл препарата. Начинают лечение с введения 0,1 мл препарата той концентрации, к-рая вызвала слабоположительную (+) или сомнительную (+) реакцию замедленного типа при внутрикожном введении. Стандартные микробные аллергены и вакцины чаще вводят подкожно, реже внутрикожно. Инъекции делают дважды в неделю в возрастающих дозах и концентрациях до достижения оптимальной для каждого больного дозы, после чего переходят на поддерживающую терапию, при к-рой одну и ту же дозу препарата вводят еженедельно (или 1 раз в 10 дней) на протяжении 3—5 лет.
Осложнения
На месте введения аллергена или вакцины может возникнуть местная реакция в виде зудящего болезненного инфильтрата. В таких случаях интервал между инъекциями удлиняют и повторно несколько раз вводят ту дозу аллергена (или вакцины), к-рая не вызывала выраженной местной реакции.
При быстром повышении дозы аллергена (или вакцины), сокращении интервала между инъекциями, а также введении большей дозы аллергена возможны системные реакции (крапивница, аллергический конъюнктивит, ринит, приступ бронхиальной астмы). По данным НИАЛ АМН СССР, при специфической Г. микробными вакцинами больных инфекционно-аллергической формой бронхиальной астмы системные реакции (чаще всего приступы удушья различной степени) отмечены у 38% больных. Иногда возникают обострения в очагах хрон, инфекции. В этих случаях следует прекратить вакцинотерапию и провести соответствующее лечение (антибактериальную терапию). Системные реакции при лечении атопических заболеваний развиваются обычно в течение 40 мин. после инъекции аллергена и быстро проходят после применения антигистаминных препаратов или подкожной инъекции 0,1% р-ра адреналина. Если больному своевременно не оказана помощь, у него может развиться анафилактический шок (см.). Поэтому в течение 40 мин. после инъекции специфического аллергена больной должен находиться под наблюдением врача. Причинами анафилактического шока могут быть также введение аллергена в дозе и концентрации, превышающих предписанные врачом; попадание аллергена непосредственно в сосуд (необходимо после введения иглы под кожу потянуть поршень шприца на себя; если в шприце появится кровь, нужно вынуть иглу и сделать инъекцию в другое место); повышение дозы аллергена больному, у к-рого после введения предыдущей, меньшей, дозы отмечалась крапивница, зуд век, кашель, насморк.
При первых же симптомах анафилактического шока больному необходимо срочно ввести подкожно адреналин, кордиамин, кофеин, антигистаминные препараты, глюкокортикоидные гормоны, сердечные гликозиды, эуфиллин (внутривенно), кислород; при показаниях проводят реанимационные мероприятия (см. Реанимация). После выведения из анафилактического шока каждый больной подлежит госпитализации для наблюдения, обследования и соответствующей терапии (сердечно-сосудистыми, антигистаминными и глюкокортикоидными препаратами с целью профилактики поздних осложнений анафилактического шока — аллергического миокардита, нефрита, гепатита и др.).
При специфической Г. микробными вакцинами и бактериальными аллергенами анафилактический шок не наблюдается.
Неспецифическая гипосенсибилизация
Неспецифическая гипосенсибилизация — снижение чувствительности организма к аллергену под влиянием некоторых лекарственных препаратов, отдельных видов физиотерапевтического и курортного лечения. Применяют ее в тех случаях, когда специфическая Г. невозможна или недостаточно эффективна, а также при сенсибилизации к веществам невыясненной природы. Нередко неспецифическую Г. применяют в сочетании со специфической. Неспецифическая Г. — один из видов лечения аллергических заболеваний, направленный на предупреждение развития или торможение иммунол, механизмов сенсибилизации (поэтому применение антигистаминных препаратов, динатрия хромогликата, стимуляторов бета-адренергических рецепторов и др. не является неспецифической Гипосенсибилизацией).
Курортные факторы оказывают выраженное гипосенсибилизирующее действие. Под их влиянием снижается степень специфической чувствительности к аллергену (по результатам аллергометрического титрования после пребывания больных на Кисловодском курорте); сочетание курортных факторов со специфической Г. дает более выраженный клинический эффект.
Гипосенсибилизирующим действием обладает переменное и постоянное магнитное поле строго определенных параметров. Препараты глюкокортикоидных гормонов в небольших дозах повышают пороговую дозу аллергена, к-рая может «запустить» иммунологические механизмы сенсибилизации. В больших дозах они подавляют развитие иммунной фазы, тормозя фагоцитоз и переваривание аллергена в фагоцитах, разрушая малые лимфоциты и угнетая синтез антител. Глюкокортикоиды участвуют также в торможении патохимических и патофизиологических фаз аллергического процесса.
К группе гипосенсибилизирующих средств можно отнести иммунодепрессанты (см. Иммунодепрессивные вещества), однако применение их ограничено строго определенными рамками. Гипосенсибилизирующим эффектом обладает также ряд других лечебных средств — плазма крови, препараты кальция, гипосульфит натрия и др., но точный механизм их действия остается еще недостаточно ясным.
Библиография: Аллергические заболевания У детей, под ред. М. Я. Студеникина и Т. С. Соколовой, с. 331, М., 1971; Артомасова А. В. Клиника, диагностика и терапия аллергических реакций на ужаления пчел и ос, Клин, мед., т. 51, № 5, с. 61, 1973, библиогр.; Беклемишев Н. Д. и др. Поллинозы (сенные катары), с. 142, Алма-Ата, 1974; Гудкова Р. Г. О специфической десенсибилизирующей терапии бронхиальной астмы, Клин, мед., т. 45, № 5, с. 55, 1967, библиогр.; Самушия Ю. А. и Дахиль С. А. О роли блокирующих антител при специфической гипосенсибилизации поллинозов, в кн.: Пробл, аллергол., под ред. А. Д. Адо и А. А. Подколзина, с. 184, М., 1971; Сидоренко Б. Н. Специфическая десенсибилизация при бронхиальной астме инфекционной природы, в кн.: Бронхиальная астма, под ред. А. Д. Адо и П. К. Булатова, с. 274, М., 1969; Anfоssо-Сapra F. а. о. Evolution of reaginic antibodies in specific hyposensitization, Acta allerg. (Kbh.), v. 29r p. 79, 1974; Blamoutier P., Blamoutier J. et Guibert L. Traitement de la pollinose avec extraits de pollens par la m£thode des quadrillages cutanes, Presse m6d., t. 67, p. 2299, 1959; Fuchs A. M. a. Strauss М. B. The clinical evaluation and the preparation and standartization of suspensions of a new water-insoluble whole ragweed pollen complex, J. Allergy, v. 30, p. 66, 1959; Miller А. С. M. a. Tees E. C. A metabolizable adjuvant, clinical trial of grass pollentyrosine adsorbate, Clin. Allergy, v. 4, p. 49, 1974; Wolfromm R. e. a. Desensibilisation par association extemporan£e d’hydroxyde d’alumine aux allerg£nes (allergfcnes h action retard), Acta allerg. Kbh.), t. 24, p. 202, 1969; WortmannF, £>6sensibilisation sp6cifique des pollinoses par voie orale chez les enfants k 1’aide de pollen en poudre, Rev. franc. Allerg., JMs 3, p. 195, 1969.
Ю. А. Порошина, А. И. Остроумов; B. И. Пыцкий (гипосенсибилизация неспецифическая).
АЛЛЕРГЕН-СПЕЦИФИЧЕСКАЯ ИММУНОТЕРАПИЯ (гипосенсибилизация)
В чем преимущество СИТ перед другими методами терапии аллергических заболеваний? На чем основан метод СИТ? Каковы пути совершенствования СИТ? Аллерген-специфическая иммунотерапия ведет свою историю с 1911 года, когда она была использована для лечен
В чем преимущество СИТ перед другими методами терапии аллергических заболеваний?
На чем основан метод СИТ?
Каковы пути совершенствования СИТ?
Аллерген-специфическая иммунотерапия ведет свою историю с 1911 года, когда она была использована для лечения поллиноза (сезонного аллергического ринита). Этот метод лечения состоит во введении в организм пациента возрастающих доз водно-солевого экстракта того аллергена, к которому у больного выявлена повышенная чувствительность и который ответствен за клинические проявления заболевания. Целью лечения является снижение чувствительности пациента к естественной экспозиции данного аллергена — специфическая гипосенсибилизация. Именно под таким названием этот метод существовал долгое время. С накоплением сведений о том, что в основе лечебного действия этого метода лежат (преимущественно) иммунологические механизмы, его стали именовать специфической (аллерген-специфической) иммунотерапией. Поскольку введением аллергена достигается иммунологически (преимущественно) опосредованное повышение «устойчивости» к действию антигена (аллергена), то в этом было усмотрено сходство самой процедуры с вакцинацией, а аллергенных экстрактов — с вакцинами. Поэтому в настоящее время довольно часто вместо терминов «аллергенные экстракты» или «лечебные аллергены» стали использовать термин «аллергенные вакцины» («аллерговакцины»). Не вдаваясь в обсуждение оправданности и удачности подобных терминологических усовершенствований, эти сведения следует привести лишь для того, чтобы практический врач был осведомлен о смысле существующих терминов.
Со времени появления аллерген-специфической гипосенсибилизирующей терапии (аллерген-специфической иммунотерапии — СИТ) накоплен огромный опыт клинического применения СИТ. Она стала одним из наиболее научно оправданных и широко используемых эффективных методов лечения аллергических заболеваний, в первую очередь тех, которые связаны с IgE-опосредованным механизмом аллергии.
Лечебные аллергены
На протяжении всей истории существования клинической аллергологии для аллерген-специфической диагностики и лечения использовали преимущественно препараты, получаемые экстракцией водно-солевым раствором активных действующих начал из различного сырья (растительного и животного происхождения), при контакте с которым возникают аллергические болезни и реакции. Такие водно-солевые экстракты помимо аллергенных содержат иные компоненты, которые отражаются на качестве препарата. Поэтому аллергенные препараты подвергают специальной очистке, методы которой все время совершенствуются. Важнейшая проблема качества аллергенных препаратов, которая не решена до настоящего времени, заключается в их стандартизации [8]. На разных континентах и в разных странах существуют свои принципы и методы стандартизации аллергенов. Понятно, что при таком подходе невозможно сопоставить аллергенную активность препаратов разных производителей, а несовершенство идентификации самих аллергенных начал в препаратах затрудняет сопоставление аллергенной активности препаратов разных серий даже одного производителя. Поэтому в настоящее время формируется общая всемирная стратегия стандартизации аллергенных препаратов, предусматривающая обязательную стандартизацию аллергенов по следующим трем признакам:
В европейских странах суммарная аллергенная активность препарата стандартизуется по степени вызываемой им кожной аллергической реакции (проба уколом) на чувствительных к данному аллергену пациентах, соотнесенной с кожной реакцией на гистамин. Состав аллергенного препарата характеризуют при помощи использования таких методов, как изоэлектрофокусирование, электрофорез в додецилсульфате натрия — полиакриламидном геле, IgE-иммуноблоттинг, перекрестный радиоиммуноэлектрофорез. IgE-связывающие свойства препарата оценивают в реакции торможения РАСТ (радиоаллергосорбентная техника). В настоящее время стало принципиально возможным для разных производителей определять содержание в препарате главных аллергенов, преимущественно ответственных за повышенную чувствительность организма к сложному по составу аллергену. Для этой цели в распоряжение разных стран передают международные референс-стандарты (ВОЗ), содержащие известные количества соответствующих аллергенов.
Новые технологии клонирования белковых молекул уже сейчас позволили получить многие важные аллергены (аллергены пыльцы растений, постельного клеща, эпидермиса некоторых животных, насекомых, ядов перепончатокрылых и пр.) в виде индивидуальных рекомбинантных белков, имеющих сравнимую аллергенную активность с соответствующими природными белковыми аллергенами. Такая новая технология облегчит стандартизацию аллергенных препаратов, позволив строго количественно определять главные аллергены в производственных сериях лекарственных форм.
Выпускаемые в настоящее время отечественными производителями диагностические и лечебные аллергены стандартизуют по содержанию в препарате единиц белкового азота, а их аллергенную активность устанавливают по результатам кожного тестирования на чувствительных к этому аллергену пациентах, но количественно не оценивают ни в испытаниях in vitro, ни на пациентах. Понятно, что отечественная технология получения и стандартизации аллергенов должна быть приведена в соответствие с современным мировым уровнем, для чего необходимо обеспечение и выполнение соответствующих национальных научно-технических программ.
Механизм СИТ
Чтобы представить себе механизм действия аллерген-специфической иммунотерапии, следует напомнить основные патогенетические звенья аллергического процесса.
Классические и распространенные проявления аллергии, которые подлежат СИТ, представлены заболеваниями, связанными с образованием в организме аллергических антител, принадлежащих к иммуноглобулину Е (IgE). В случае поступления во внутреннюю среду организма аллергена последний фрагментируется в антиген-представляющих клетках до упрощенных пептидов, которые затем представляются этими клетками Т-клеткам-помощникам (Th-клеткам), имеющим профиль Th2-клеток. Этот профиль характеризуется продукцией клетками таких цитокинов, как интерлейкин (IL)-4, IL-13 и IL-5, но не IL-2 или интерферон (IFN)-γ. Th2-клеточный профиль имеет отношение к гуморальному иммунному ответу и, в частности, к IgE-ответу. Th1-клеточный профиль характеризуется продукцией клетками IFN-γ и IL-2, но не IL-4, IL-13 или IL-5. Между Th1- и Th2-клетками существуют реципрокные отношения, и IFN-γ (цитокин Th1-клеток) тормозит (сдерживает) активность Th2-клеток, необходимых для осуществления IgE-ответа.
Образовавшиеся IgE-антитела фиксируются на имеющих к ним очень высокое сродство специализированных рецепторах (высокоаффинные рецепторы для Fc-фрагмента иммуноглобулина Е — Fc(RI), расположенных на тучных клетках слизистых оболочек и соединительной ткани. Таким образом, вооруженные IgE-антителами, тучные клетки оказываются готовы к распознаванию аллергена, если он повторно сможет поступить во внутреннюю среду организма. При повторном поступлении аллерген связывается IgE-антителами, происходит активация тучных клеток, в результате чего из них секретируются медиаторы (гистамин, простагландин D2, лейкотриены C4, D4, E4), фактор активации тромбоцитов — FAT (триптаза и др.), которые вызывают повышение сосудистой проницаемости и отек ткани, сокращение гладкой мускулатуры, гиперсекрецию слизистых желез, раздражение периферических нервных окончаний. Эти изменения составляют основу быстрой (ранней) фазы аллергической реакции (см. рисунок), развивающейся в течение первых минут после действия аллергена. Помимо указанных действий, высвобожденные медиаторы привлекают в зону аллергической реакции другие клетки-участники: базофилы, эозинофилы, моноциты, лимфоциты, нейтрофилы. Пришедшие в эту зону дополнительные клетки-участники аллергической реакции активируются, в результате чего также секретируют проаллергические (провоспалительные) медиаторы. Действие этих клеток и их медиаторов формирует позднюю (или отсроченную) фазу аллергической реакции. Поздняя фаза обусловливает поддержание аллергического воспаления в ткани, хронизацию процесса, формирование и усиление аллерген-неспецифической тканевой гиперреактивности, выражающейся в повышении чувствительности уже не только к конкретному аллергену, но и к разнообразным неспецифическим раздражающим воздействиям (дымы, газы, резкие запахи и пр.; см. рисунок).
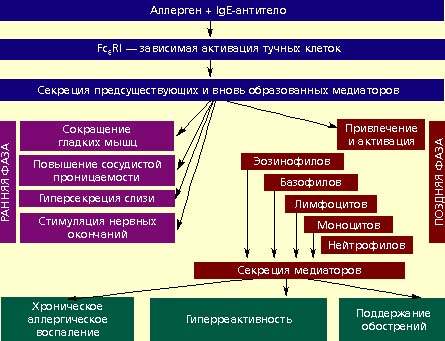 |
| Звенья ранней и поздней фаз IgE-опосредованной аллергической реакции |
Аллерген-специфическое лечение имеет принципиальные преимущества перед всеми другими методами терапии аллергии, так как не действует на симптомы заболевания, а видоизменяет характер реагирования организма на аллерген, вмешивается собственно в патогенез заболевания и потому влияет на все патогенетические звенья аллергического процесса [2].
Клиническая эффективность СИТ выражается в торможении внешних проявлений заболевания и уменьшении потребности в лекарственных препаратах, что обусловлено следующими, по крайней мере тремя особенностями действия СИТ. Во-первых, формируется снижение тканевой (органной) чувствительности к аллергенной экспозиции, что многократно подтверждено, помимо клинических наблюдений, проведением провокационных проб с аллергеном. Во-вторых, возникает снижение неспецифической тканевой гиперреактивности, что, в частности, устанавливается по снижению чувствительности к разным медиаторам аллергии. В-третьих, клинически эффективная СИТ сопровождается угнетением признаков аллергического воспаления.
Снижение неспецифической тканевой гиперреактивности и противовоспалительное действие, так же как и специфическая гипосенсибилизация, удерживаются на протяжении длительного (многолетнего) периода наблюдений после завершения СИТ. Легко заметить, что эти эффекты СИТ объединяют в себе способы действия разнообразных современных противоаллергических фармакологических препаратов, лишь избирательно воздействующих на то или иное звено аллергического процесса.
Каковы же основные точки приложения действия СИТ?
Известно, что у атопических больных в период естественной аллергенной экспозиции (например, в период цветения растений, к пыльце которых имеется повышенная чувствительность) возникает прирост содержания в крови IgE-антител. СИТ сопровождается торможением такого прироста IgE-антител, а после повторных курсов СИТ наступает и некоторое уменьшение уровня IgE-антител по сравнению с исходным. Однако прямой связи между степенью торможения продукции IgE-антител и выраженностью положительного клинического эффекта все же не существует.
Давно сформировалась точка зрения, согласно которой основной механизм СИТ заключается в перестройке характера иммунного ответа на действие аллергена, состоящей в образовании так называемых блокирующих антител, принадлежащих к IgG и лишенных способности сенсибилизировать ткани, но обладающие аллерген-связывающей активностью, за счет чего они предотвращают (вернее, уменьшают) вероятность взаимодействия аллергена с IgE-антителами. И все же далеко не всегда значительное увеличение содержания аллерген-специфических IgG-антител совпадает с выраженным клиническим улучшением состояния больных. В последнее время появились сведения о том, что и образование анти-IgE-антител может быть вкладом в лечебное действие СИТ.
Более всего вероятно, что образование IgG-антител, анти-IgE-антител и угнетение продукции IgE-антител опосредуют механизм СИТ лишь частично и в комплексе как друг с другом, так и с иными процессами. В последние годы накоплены сведения, указывающие на то, что СИТ, сопровождающаяся выраженным клиническим улучшением состояния пациентов, характеризуется угнетением вовлечения в искусственно провоцируемую или вызванную естественной экспозицией аллергена аллергическую реакцию тех клеточных единиц, которые опосредуют эффекторную стадию аллергии. Так, в тканях после СИТ уменьшается содержание тучных клеток, уменьшается накопление клеток воспаления (эозинофилов, нейтрофилов), тормозится высвобождаемость медиаторов из клеток-мишеней аллергии (тучных клеток, базофилов) при стимуляции их специфическим аллергеном или неспецифическими активаторами. Действие СИТ затрагивает также и лимфоидные клетки таким образом, что происходит смещение их профиля от Th2-клеток в сторону Th1-клеток. Все это может объяснять влияние СИТ не только на раннюю, но и на позднюю фазу аллергического процесса.
Итак, СИТ обладает таким терапевтическим действием, которое распространяется на все этапы аллергического процесса и отсутствует у известных фармакологических препаратов, в том числе у имеющих полифункциональную активность. Действие СИТ охватывает собственно иммунологическую фазу и приводит к переключению иммунного ответа с Th2-типа на Th1-тип, тормозит как раннюю, так и позднюю фазы IgE-опосредованной аллергической реакции, угнетает клеточную картину аллергического воспаления и неспецифическую тканевую гиперреактивность. Еще раз следует подчеркнуть, что СИТ принципиально отличает от фармакотерапии длительно сохраняющийся лечебный эффект после завершения курсов лечения.
Клиническая эффективность СИТ
За 90-летний период применения СИТ накоплен огромный клинический опыт, свидетельствующий о ее высокой лечебной эффективности. По данным многочисленных исследований, в том числе проведенных в нашей стране, положительный терапевтический эффект СИТ достигается в 80-90% случаев и более. Столь высокого уровня терапевтической эффективности удается добиться при следующих условиях:
Данные предыдущих лет о высокой лечебной эффективности СИТ подтверждены в последнее время в специальных работах, выполненных на основе принципов доказательной медицины.
Эти исследования представляли собой двойные слепые, плацебо-контролируемые испытания на рандомизированных группах пациентов, подобранных на основании четких клинических критериев и результатов аллергологической специфической диагностики, с использованием стандартизованных очищенных аллергенов при достижении оптимальной поддерживающей дозы (порядка 5-20 мкг главного аллергена на инъекцию для таких аллергенов, как пыльца сорняков, трав, кошачья шерсть, яды перепончатокрылых) и при условии достаточной продолжительности (завершенности) курсов лечения.
Основные выводы этих исследований, характеризующие клиническую эффективность СИТ, могут быть сведены к следующему.
По вопросу о клинической эффективности СИТ, проводимой бактериальными аллергенами, существуют разные точки зрения, но, по данным целого ряда исследователей, и в этом случае может быть получен выраженный положительный клинический эффект.
Место СИТ в системе противоаллергического лечения
Давно признанным и обоснованным положением аллергологии является то, что первым обязательным этапом противоаллергического лечения должно быть проведение комплекса мероприятий, направленных на исключение или ограничение аллергенного воздействия на пациента. Если элиминационные меры недостаточны, то проведение СИТ становится необходимым, разумеется при соблюдении упомянутых выше условий.
Фармакотерапия аллергических заболеваний проводится в настоящее время несколькими группами противоаллергических лекарственных препаратов, позволяющих эффективно контролировать симптомы заболевания (Н1-антигистаминные средства, антилейкотриеновые препараты, стабилизаторы клеток-мишеней аллергии — препараты кромоглициевой кислоты и недокромил натрия, ксантиновые производные, β2-агонисты, топические и системные кортикостероидные препараты). Однако, с одной стороны, применение фармакологических препаратов не должно заменять СИТ, а с другой — СИТ предусматривает дополнительное использование и фармакологических средств, если в том возникает потребность. Содержащееся в целом ряде международных и национальных рекомендаций предложение приступать к СИТ только в тех случаях, когда фармакотерапия неэффективна, не может быть принято. Это объясняется тем, что СИТ тем эффективнее, чем раньше она начала проводиться.
Кроме того, как указано выше, своевременно проведенная СИТ позволяет, во-первых, предотвратить переход заболевания в более тяжелые формы, а во-вторых, снижает (или даже полностью устраняет) потребность в лекарственных препаратах. Наконец, после завершения СИТ удается добиться многолетней ремиссии, чего нельзя достичь лекарственными средствами.
К сказанному следует добавить и еще один аргумент, который обоснован механизмом действия СИТ. Напомним, что СИТ распространяет свое действие на все звенья аллергического процесса: на собственно иммунологическое звено, на эффекторные клетки (на тучные клетки) ранней фазы, на клетки-участники поздней фазы аллергического ответа, снижает не только аллерген-специфическую тканевую чувствительность, но и неспецифическую тканевую гиперреактивность, предупреждает расширение спектра аллергенов, к которым формируется повышенная чувствительность. Ни одно фармакологическое лекарственное средство не обладает таким полифункциональным действием. Именно в силу этих важных обстоятельств в отечественной аллергологии давно сложилось мнение о необходимости как можно более раннего начала проведения аллерген-специфического лечения, обеспечивающего профилактику обострений заболевания.
Безопасность СИТ
В ходе проведения СИТ в ответ на введение аллергена могут возникать нежелательные побочные эффекты в виде местных или системных реакций.
К местным реакциям относят те, которые возникают в месте введения аллергена и характеризуются местной гиперемией, иногда чувством зуда в области инъекции, признаками отека ткани. Эти реакции обычно возникают в первые 30 минут, хотя следует иметь в виду, что они могут проявиться и в более отдаленные сроки. Возникновение местных реакций является поводом для коррекции дозы аллергена (ее уменьшения) в последующее введение.
Системные реакции — это реакции, возникающие вне области введения аллергена. Обычно они появляются в пределах нескольких минут после инъекции аллергена и в редких случаях — спустя 30 минут. Обоснованным является подразделение системных реакций на те, которые не угрожают жизни пациента, и угрожающие (анафилактический шок, отек жизнено важных органов — отек гортани). К системным реакциям могут быть отнесены такие, как головная боль, боли в суставах, ощущение дискомфорта. К умеренным признакам системных реакций относят легкие проявления ринита или бронхиальной астмы (пиковая скорость выдоха не ниже 60% от должной величины или от показателя пациента в период стойкой ремиссии), хорошо контролируемые соответствующими лекарственными препаратами (Н1-антагонистами или ингаляционными β2-агонистами). Более выраженной степени реакции соответствуют признаки крапивницы, отеки Квинке, нарушение бронхиальной проходимости (показатели пиковой скорости выдоха ниже 60% от должной величины или от показателя пациента в период стойкой ремиссии), контролируемые соответствующим лечением. Угрожающие жизни реакции требуют проведения интенсивной терапии. При возникновении системных реакций обязательным является пересмотр программы СИТ для данного пациента.
Хотя существуют указания на то, что время наступления системных реакций коррелирует с их тяжестью, следует иметь в виду, что эти реакции могут возникать и через 30-60 минут после инъекции аллергена. Интенсивность местной реакции не является надежным индикатором проявления системной реакции. В ряде исследований, обобщающих большое число наблюдений, показано, что, как правило, системные реакции возникали в отсутствие предшествующей сильной местной реакции.
Анализ системных реакций показывает, что в большинстве случаев они возникали вследствие отклонения от принятых правил проведения СИТ. В частности, выявлены следующие факторы:
Перед исследователями, занимающимися изучением клинической эффективности и безопасности СИТ, неоднократно вставал вопрос о возможности снижения риска возникновения системных реакций путем предварительного использования противоаллергических фармакологических средств. Как вариант предлагали проводить премедикацию комбинацией метилпреднизолона и кетотифена, препаратами теофиллина длительного действия. Такие предложения небезупречны, поскольку теофиллин может обладать нежелательным действием на сердечно-сосудистую систему, а кетотифен — седативным эффектом. Что касается стероидных препаратов, то их применение в данном случае не может быть оправданным, так как нельзя исключить угнетающего действия именно на Th1-тип иммунного ответа, с которым связывают лечебный эффект СИТ.
Имеются специальные данные, в том числе двойных слепых, плацебо-контролируемых исследований, свидетельствующие о том, что антигистаминные препараты (Н1-антагонисты) уменьшают частоту возникновения системных и тем более местных реакций при СИТ. Ранее, в период применения Н1-антагонистов первого поколения, их использование для данных целей считалось неоправданным. Такие ограничения были связаны с опасениями, что применение этих препаратов, не предотвратив самой системной реакции, может сделать незаметными ее клинические предвестники, вследствие чего будут пропущены начальные признаки системной реакции. Эти опасения вполне обоснованны, так как Н1-антагонисты первого поколения, с одной стороны, имеют относительно слабое сродство к Н1-рецепторам гистамина, а с другой — обладают седативным действием, вследствие которого пациент теряет адекватную оценку своего состояния. Кроме того, другие побочные действия антигистаминных препаратов первого поколения (прежде всего это действие на сердечно-сосудистую систему) могут усилить проявления системных реакций.
Положение существенно изменилось с появлением Н1-антагонистов второго и третьего поколений, обладающих высоким сродством к Н1-рецепторам (т. е. очень высокой избирательной антигистаминной активностью), не имеющих седативного действия (или имеющих слабо выраженный седативный эффект) и нежелательных побочных действий, присущих их предшественникам. Эти препараты эффективно предотвращают появление местных реакций при СИТ и снижают частоту возникновения системных реакций [7]. Понятно, что предпочтение в этом случае должно быть отдано препаратам, имеющим наилучший профиль безопасности, высокую антигистаминную активность и не обладающим седативным действием. Таким препаратом, как известно, является Н1-антагонист третьего поколения — фексофенадин (телфаст), представляющий собой фармакологически активный метаболит препарата второго поколения (терфенадина). Он имеет безупречный профиль безопасности, у него отсутствуют кардиотропные (кардиотоксические) свойства и он совершенно не обладает седативным действием [3 ].
По сравнению с многомиллионным числом инъекций аллергенов, осуществляемых ежегодно во всем мире, частота возникновения нежелательных системных реакций является низкой. Проблемы, связанные с возникновением осложнений СИТ в виде тяжелых системных реакций, появляются в тех странах, в которых к проведению СИТ допускают не специалистов-аллергологов, а врачей других специальностей и врачей общей практики. Так было, например, в Великобритании, где с 1957 по 1986 год зарегистрировано 26 смертельных случаев, которые могли быть связаны с проведением СИТ. При анализе этих случаев оказалось, что они были обусловлены непрофессиональным выполнением СИТ. Напротив, в странах, в которых СИТ выполняют только специалисты, имеющие опыт и узаконенное право проведения такого лечения, а само лечение осуществляется в специализированных медицинских учреждениях, имеющих необходимые средства для лечения возможных побочных эффектов, системные реакции если и возникали, то не приводили к серьезным последствиям. Так, в Дании при анализе проведенных 10 тыс. лечебных инъекций в аллергологическом отделении Национального университета в Копенгагене не установлено ни одного случая системных анафилактических реакций. Аналогичные данные получены в аллергологических кабинетах Москвы [1], которые сейчас располагают уже 40-летним опытом применения СИТ. Поэтому обязательным является соблюдение следующего правила: аллерген-специфическая иммунотерапия (аллерген-специфическая гипосенсибилизация) должна выполняться только обученными специалистами (врачами-аллергологами), имеющими опыт проведения этого лечения, в условиях аллергологического кабинета или стационара.
Именно в специализированном аллергологическом подразделении предусмотрено наличие необходимых средств не только для проведения СИТ, но и для купирования побочных реакций, если они возникают [4]. Такие правила соблюдались в нашей стране с момента создания в ней аллергологической службы в начале 60-х годов, благодаря чему отечественная аллергология смогла избежать печального опыта стран, в которых к проведению СИТ допускали иных специалистов, в частности врачей широкого профиля. Обязанностью врача широкого профиля является направление пациента с установленным диагнозом аллергического заболевания или с подозрением на такой диагноз к врачу-аллергологу для решения, в частности, вопроса о проведении СИТ.
Совершенствование СИТ
Совершенствование СИТ и лечебных форм аллергенов направлено, с одной стороны, на снижение способности лечебных препаратов вызывать аллергические реакции, а с другой — на сохранение или усиление их иммуногенных свойств. Это необходимо для повышения терапевтической эффективности СИТ и улучшения профиля безопасности лечебных форм аллергенов.
Для достижения такой цели используются как изменение способов введения и доставки лечебных аллергенов, так и разнообразные методы модификации самих аллергенных начал.
Помимо инъекционного введения аллергенов испытываются разные варианты местной (топической) СИТ в виде приема аллергенов через рот, интраназального, ингаляционного введения, введения аллергенов в составе липосом. Пока что не получены окончательные доказательства достаточной эффективности подобных приемов.
Модификация аллергенов достигается разными способами: полимеризацией аллергенов (формальдегидом, глутаровым альдегидом и пр.), получением сорбированных форм (на L-тирозине, на гидроокиси алюминия), применением разнообразных природных и синтетических носителей, аллерген-IgG-содержащих комплексов, использованием вместо самих аллергенов кодирующей их плазмидной ДНК, IgE-связывающих аллергенных гаптенов (неспособных активировать клетки-мишени аллергии, но связывающихся с IgE и предупреждающих тем самым последущее соединение антитела с аллергеном), полученных биотехнологическими приемами отдельных молекул аллергенов и их фрагментов. Приведенный перечень научных направлений, разрабатываемых в настоящее время, свидетельствует о том огромном интересе, который проявляют исследователи всего мира к проблеме аллерген-специфического лечения аллергических заболеваний.
Правда, большинство этих разработок находятся пока что на стадии экспериментальных исследований, но некоторые уже сейчас внедрены в широкую медицинскую практику, в том числе в нашей стране. Так, осуществляется выпуск коммерческих полимеризованных аллергенов (аллергоидов), которые имеют сниженную аллергенную активность, но сохраненную иммуногенную. Благодаря этому аллергоиды могут быть использованы в более высоких поддерживающих дозах, но с менее частым введением лечебных доз, чем водно-солевые экстракты. Это обеспечивает большую терапевтическую эффективность, лучший профиль безопасности и большее удобство проведения СИТ.
В Институте иммунологии МЗ РФ на протяжении ряда лет выполнялись работы по направленной модификации иммуногенных и аллергенных свойств распространенных аллергенов путем получения комплексных соединений молекул аллергенов и иммуностимуляторов. Результатом этих работ явилось создание лечебных препаратов на основе аллергоидов пыльцевых аллергенов и иммуностимулятора полиоксидония. Эти препараты в настоящее время подготовлены для проведения клинических испытаний [5, 6].
Разработка этих новых и высокоактуальных научных направлений обеспечит повышение эффективности аллерген-специфической терапии, еще более расширит ее использование в комплексе противоаллергических лечебных и профилактических мероприятий.