Препараты нормализующие работу кишечника у взрослых
Препараты нормализующие работу кишечника у взрослых
Синдром раздраженного кишечника: новые горизонты медикаментозной терапии
Изложены современные представления о патогенезе синдрома раздраженного кишечника (СРК), описаны принципиальные подходы к его лечению. Медикаментозная терапия СРК включает прокинетики, спазмолитики, слабительные средства пребиотического действия, пре- и пр
Modern views on irritated bowels syndrome pathogenesis have been reviewed, principal methods of its treatment have been described. Drug therapy of irritated bowels syndrome presupposes application of прокинетики, antispasmodic agents, depletives with пребиотического action, pre- and probiotics, sometimes antibiotics.
Существенное нарастание частоты функциональных нарушений органов пищеварения как у взрослых, так у детей в значительной степени способствовало поиску новых подходов к лечению данной группы заболеваний.
Согласно общепринятому определению (по D. A. Drossman, 1994) под функциональными нарушениями органов пищеварения подразумевают разнообразную комбинацию гастроинтестинальных симптомов без структурных или биохимических нарушений. В то же время сущностью функциональных нарушений является то, что в их основе лежит нарушение регуляции функций того или иного органа, а не первичная патология органа-мишени.
Среди многочисленных форм функциональных нарушений особое внимание на протяжении многих десятилетий привлекает синдром раздраженного кишечника (СРК), который характеризуется приступами абдоминального дискомфорта или болей в животе, проходящими после дефекации, связанными с изменением характера стула или его частоты, без признаков воспалительных, метаболических, анатомических или неопластических нарушений и процессов, которые могли бы объяснить данную симптоматику (Римские критерии III, 2006). Дополнительными симптомами могут быть затруднение акта дефекации или ощущение неполного опорожнения прямой кишки, обильное выделение слизи, урчание или вздутие живота.
Согласно Римским критериям клиническими признаками, говорящими в пользу СРК, также являются изменчивость и многообразие жалоб, отсутствие прогрессирования, нормальный вес и общий вид ребенка, усиление жалоб при стрессе, отсутствие симптомов ночью, связь с другими функциональными расстройствами. Нередко боли возникают перед дефекацией и проходят после нее. В определенной степени спорным является указанное отсутствие прогрессирования, т. к. со временем на фоне СРК может формироваться хронический колит. Важным критерием является также то, что абдоминальные боли или ощущение дискомфорта наблюдаются, по крайней мере, в течение 3 дней каждого месяца за последние 3 месяца.
В зависимости от доли времени, в течение которого наблюдаются изменения стула того или иного характера (запор или диарея), СРК подразделяются на СРК с запором (IBS-C, СРК-З), СРК с диареей (IBS-D, СРК-Д), смешанный СРК (IBS-M, СРК-См) и недифференцированный СРК (IBS-U, СРК-Н).
Лечение любого заболевания в идеальном случае должно исходить из знания его этиологии и патогенеза. К сожалению, многие стороны патогенеза функциональных нарушений, включая СРК, остаются недостаточно изученными. Тем не менее, имеющиеся данные позволяют достаточно целенаправленно подходить к вопросам его терапии.
Традиционно причину функциональных нарушений желудочно-кишечного тракта усматривают в нарушениях нейрогуморальной регуляции моторики органов пищеварения, связанных с психоэмоциональной сферой, вегетативными расстройствами и повышенной висцеральной чувствительностью. В последние годы к этим ключевым позициям прибавились новые, значение которых широко обсуждается. К таким механизмам, в частности, относится воспаление.
Выявление воспалительного процесса при СРК может вызвать некоторое недоумение, т. к. его наличие, по сути, противоречит самому понятию функционального заболевания. Однако его развитие при СРК может быть вполне закономерным. С одной стороны, воспаление может быть вторичным, т. е. последствием нарушений моторики, приводящих к изменению состава внутренней среды в просвете кишки и повреждению слизистой оболочки. С другой стороны, оно все-таки может входить в структуру самого заболевания, обнаруживая при этом черты, отличающие его от других воспалительных заболеваний кишечника. Такой особенностью является преобладание в клеточном инфильтрате тучных клеток, преимущественно в зоне нервных окончаний. Данный феномен получил в англоязычной научной литературе обозначение, которое можно перевести как «воспаление в слизистой оболочке низкой степени активности» (Low-grade mucosal inflammation). Увеличение числа тучных клеток у больных СРК в тонкой и толстой кишке было выявлено во многих исследованиях [1–6], а в одном из них было показано также повышение степени их дегрануляции [4].
Тучные клетки тесно соприкасаются с нервными окончаниями и могут взаимодействовать с ними мембранными образованиями [7], а медиаторы тучных клеток (гистамин, триптаза, простагландины и др.) могут влиять на моторику желудочно-кишечного тракта [8]. Однако особенно важно то, что это воспаление может приводить к развитию висцеральной гиперчувствительности — важного субстрата СРК [9]. И действительно, в отдельных исследованиях была установлена корреляция между степенью инфильтрации тучными клетками слизистой оболочки и характером клинических проявлений, а также с характером психоэмоциональных нарушений [1, 2, 6, 10]. Более того, в уникальном рандомизированном контролируемом исследовании был показан эффект применения препаратов 5-аминосалициловой кислоты при СРК, коррелирующий с уменьшением выраженности клеточной инфильтрации в слизистой оболочке толстой кишки [11].
Рассматриваемый воспалительный процесс может быть последствием инфекционного процесса (острой кишечной инфекции при т. н. постинфекционном СРК), но также быть обусловленным изменениями в составе микрофлоры кишечника, нейрогуморальными механизмами (в т. ч. стрессом) или пищевой аллергией. Установленными причинами развития постинфекционного СРК являются инфекции Campylobacter jejuni, Salmonella, Shigella, Escherichia coli и, возможно, некоторые вирусы [12].
Интересны, но неоднозначны взаимоотношения СРК и пищевой аллергии. Тучные клетки несут на своей поверхности высокоаффинные рецепторы к IgE [13], а их дегрануляция может обуславливать симптоматику СРК. Действительно, у пациентов с пищевой аллергией наблюдается сходная с СРК клиническая картина [14] и аналогичная клиническая картина наблюдается при системном мастоцитозе [15]. При этом препараты, стабилизирующие мембраны тучных клеток, как хромгликат натрия, положительно влияют на симптоматику при СРК [16]. В исследовании G. Mekkel и соавт. было показано, что частота IgE-опосредованных реакций при СРК составляет около 34,5%. Среди наиболее значимых аллергенов можно выделить белки молока, сои, томаты, арахис, яичный белок [17]. Вместе с тем при СРК достаточно часто обнаруживаются реакции непереносимости различных нутриентов, не опосредованные IgE. Клиницисту хорошо известна распространенная ситуация, когда сложно понять, что первично — СРК или пищевая непереносимость. У больного с пищевой аллергией, проявляющейся атопическим дерматитом или/и бронхиальной астмой, нередко наблюдается сходная с СРК картина. Является ли она проявлением гастроинтестинальной аллергии, дополняющей кожные и респираторные симптомы, или это СРК? Далеко не всегда на этот вопрос можно однозначно ответить, не прибегая к специальным методам исследования. При этом имеющиеся данные указывают на некоторую общность эффекторных механизмов при обоих заболеваниях. Результаты же исследований, касающихся взаимосвязи пищевой аллергии и СРК, достаточно противоречивы, и требуется дальнейшая проработка данной проблемы.
Взаимодействия между центральной нервной системой и кишечником сложны и до конца не изучены. Хорошо известно, что вегетативные расстройства существенным образом влияют на моторику желудочно-кишечного тракта, нередко опосредуя влияния психоэмоциональной сферы. Стрессы, психические расстройства, психологические отклонения в значительной степени определяют состояние органов пищеварения, вызывая как функциональные, так и серьезные органические поражения. Вместе с тем нейрогуморальные механизмы контролируют и воспалительные процессы.
В частности, стресс способствует продукции кортизол-рилизинг-гормона, оказывающего влияние на моторику кишечника, что было показано в исследованиях как на животных, так и у человека [18, 19], а также на процессы инфильтрации стенки кишечника тучными клетками в синергизме с другими нейромедиаторами [20]. С другой стороны, из просвета кишечника этому же процессу способствуют пищевые антигены [21], а также кишечная микрофлора, через иммунную систему оказывающая влияние на патологический процесс в кишечной стенке [22].
Таким образом, механизмы развития укладываются в общую структуру, связывающую центральную нервную систему, собственную нервную систему кишечника, воспаление, иммунные реакции и кишечную микрофлору.
Современные представления о патогенезе СРК позволили предложить несколько принципиальных подходов к его лечению, которые целесообразно сочетать в процессе лечения больного.
Первое направление — коррекция психоэмоциональных и вегетативных расстройств. Учитывая ключевое значение этих нарушений в патогенезе функциональных заболеваний органов пищеварения, этому направлению следует всегда уделять особое внимание, привлекая, по возможности, к лечению психолога, невропатолога, психиатра. Спектр как медикаментозных, так и немедикаментозных подходов к решению проблемы весьма широк, и выбор конкретного подхода определяется исходя из индивидуальных особенностей пациента. Среди препаратов, влияющих на психоэмоциональную сферу, при СРК (по данным метаанализа) достоверным положительным эффектом на клинические проявления обладают, в частности, трициклические антидепрессанты и ингибиторы обратного захвата серотонина [22].
Второе направление — воздействие на уровне кишечника.
В настоящее время в реальной практике наиболее представлены препараты, оказывающие эффект через различные рецепторы органов желудочно-кишечного тракта и регулирующие таким образом его моторику.
Широкое распространение получили агонисты рецепторов 5-гидрокситриптамина (серотонина) 4-го подтипа, обладающие значительной фармакологической эффективностью на уровне средних и дистальных отделов кишечника (tegaserod и prucalopride). Широко применявшийся на протяжении многих лет препарат цизаприд в настоящее время снят с производства в связи с выявленными побочными эффектами на проводящую систему сердца. Обобщение значительного числа клинических испытаний препарата следующего поколения тегасерода у взрослых пациентов и подростков с СРК-З показало, что его применение достоверно приводит к увеличению частоты стула и, в целом, к уменьшению выраженности клинических проявлений заболевания [23]. Однако и этот препарат, хотя и в меньшей степени, обладает потенциальными побочными кардиоваскулярными эффектами. Последующие исследования привели к появлению препарата прукалоприд, характеризующегося достаточно высокой эффективностью и значительно меньшей частотой побочных эффектов в виде болей в области сердца и диареи [24].
Интересные перспективы предполагает также разработка снижающих висцеральную чувствительность антагонистов рецепторов 5-гидрокситриптамина 3-го подтипа (alosetron), особенно для лечения СРК с диареей.
К рассматриваемой группе относятся также селективные антагонисты мускариновых рецепторов (такие как zamifenacin и darifenacin) и антагонисты бета3-адренорецепторов (находящийся в стадии разработки SR-58611 A). Новым направлением является применение блокаторов рецепторов холецистокинина (CCKA-рецепторов), обладающих одновременно стимулятором рецепторов мотилина, единственным представителем которых является дошедший на сегодня до этапа клинических испытаний loxiglumide (и его правовращающий изомер dexloxiglumide). Препарат стимулирует моторику желудка и кишечника, сокращает время транзита по толстой кишке, а также снижает висцеральную чувствительность [25].
Некоторое время назад в качестве прокинетика применялся и эритромицин, хорошо известный препарат из группы макролидов, а также другие 14-членные макролиды. Эритромицин также является агонистом рецепторов мотилина на клетках гладкой мускулатуры желудочно-кишечного тракта. Препарат ускоряет опорожнение желудка и сокращает время транзита по кишечнику. В толстой кишке его влияние в большей степени прослеживается в восходящем отделе, по сравнению с нисходящим отделом.
Еще одно направление — применение просекреторных препаратов, в частности, агониста гуанилат-циклазы С, препарата Linaclotide, находящегося сейчас в фазе 3 клинических испытаний. Препарат не всасывается в кишечнике и оказывает стимулирующее действие на хлоридные каналы второго типа клеток слизистой оболочки кишечника, что вызывает усиление секреции, увеличение объема и разжижение стула и, как следствие, усиление моторики. Испытания показали его эффективность в плане увеличения частоты дефекаций при СРК-З, уменьшения болевого синдрома, дискомфорта, вздутия живота. Побочным эффектом препарата может быть обусловленная им диарея [26]. Также указывается на возможность рвоты и болей в области сердца [24], однако частота развития этих побочных эффектов относительно невелика [27].
С сожалением, однако, следует отметить, что большинство из перечисленных выше препаратов или находятся в стадии разработки, или отсутствуют на отечественном рынке и все они не могут применяться в педиатрической практике.
Исключение составляет агонист опиатных рецепторов тримебутин.
Тримебутин (2-(диметиламино)-2-фенилбутилэфир 3,4,5-триметоксибензойной кислоты) был впервые синтезирован Laboratoires Jouveinal (Франция) в 1969 г. На протяжении многих лет он применялся и применяется в различных странах мира для лечения функциональных нарушений желудочно-кишечного тракта у детей и взрослых.
Тримебутин (Тримедат ® ) является агонистом периферических опиатных рецепторов трех основных типов (µ, δ, κ), расположенных на гладкомышечных клетках на всем протяжении желудочно-кишечного тракта. Результатом этого является модулирующий эффект тримебутина на моторику пищеварительной системы. Кроме того, он влияет на висцеральную чувствительность органов пищеварения, оказывая умеренное анальгетическое действие, в т. ч. и при СРК. В основе этого эффекта лежит влияние препарата на антиноцицептивную систему организма с повышением порога болевой чувствительности, модификацией оценки боли, снижением чувствительности рецепторов к медиаторам воспаления. Более того, тримебутин обладает местным обезболивающим действием [28, 29]. Тримебутин оказывает влияние и на гуморальную регуляцию моторики желудочно-кишечного тракта, повышая секрецию мотилина и снижая уровень гастрина, глюкагона, панкреатического полипептида, инсулина и вазоактивного кишечного пептида [30].
Другими фармакологическими эффектами тримебутина являются снижение давления нижнего пищеводного сфинктера, ускорение опорожнения желудка. Благодаря действию на различные типы опиатных рецепторов тримебутин восстанавливает нормальную физиологическую активность мускулатуры кишечника, снижая ее в случае повышения и наоборот, в связи с чем может применяться при всех формах СРК.
При исследовании прокинетических эффектов тримебутина на здоровых добровольцах было показано ускорение эвакуации жидкости из желудка на 19% при пероральном приеме в дозе 200 мг в сутки и модулирующее действие на электрическую активность желудочно-кишечного тракта [31, 32]. По данным J. C. Schang и соавт. через один месяц терапии тримебутином в дозе 300 мг/сут per os частота стула увеличилась у 86% пациентов с СРК-З [33]. Тримебутин в дозе 400 мг при внутривенном введении был эффективен при послеоперационном парезе кишечника и сокращал время восстановления моторики кишечника у пациентов, перенесших операцию на брюшной полости [34]. При СРК с диареей тримебутин устраняет повышенную моторику кишечника, ускоряет транзит по кишечнику в случае запора, снижает висцеральную гиперчувствительность, оказывает спазмолитический эффект [30, 35].
Накоплен значительный опыт применения тримебутина в педиатрической практике. Так, в открытом исследовании C. Dupont и соавт. был показан достоверный положительный эффект применения тримебутина у детей с функциональными нарушениями моторики желудочно-кишечного тракта [36].
Тримебутин выпускается в форме таблеток по 200 мг с одной риской и 100 мг с двумя рисками. Детям в возрасте до 6 мес препарат назначается по 12,5 мг 2–3 раза в сутки, в возрасте от 6 мес до одного года — по 25 мг 2 раза в сутки, в возрасте 1–5 лет — по 25 мг 3 раза в сутки, в возрасте старше 5 лет — по 50 мг 3 раза в сутки, детям в возрасте старше 14 лет и взрослым — по 100–200 мг 3 раза в сутки.
В проведенном нами исследовании мы предполагали изучить влияние препарата тримебутин (Тримедат ® ) на электрическую активность различных отделов желудочно-кишечного тракта при функциональных нарушениях в детском возрасте. Тримедат ® применялся нами в составе комплексной терапии у 23 детей (средний возраст — 10,6 года) с функциональными нарушениями органов пищеварения. На фоне приема препарата Тримедат ® наблюдалась разнонаправленная динамика электромиографических показателей в зависимости от исходного состояния моторики, приводящая к ее восстановлению, что подтверждает модулирующее (регулирующее) действие препарата. При этом Тримедат ® оказывал влияние как на собственно активность миоцитов, так и на активность водителей ритма [37].
В значительном числе случаев при СРК выявляются нарушения микробиоценоза, которые могут прямо или опосредованно оказывать влияние на моторику кишечника, во-первых, изменяя характер метаболических процессов в его просвете, а во-вторых, способствуя низкоактивному воспалительному процессу в слизистой оболочке кишки. В связи с этим применение препаратов, влияющих на кишечную микрофлору, может быть патогенетически оправданным. Среди антибиотиков в настоящее время наиболее признанным в этой области применения является рифаксимин. Метаанализ установил значительную его эффективность, по сравнению с плацебо, для купирования симптомов СРК. Побочные эффекты наблюдаются относительно редко в виде болей в области сердца, рвоты, диареи и болей в животе. Наиболее серьезные из них наблюдаются менее чем в 1% случаев, и их частота не отличается от таковой в случае применения плацебо [39].
Достоверными эффектами, показанными в метаанализах, обладают пре- и пробиотики, положительно влияющие на общую симптоматику при СРК, абдоминальные боли и вздутие живота [40, 41]. Показано также, что пищевые волокна эффективны для лечения запоров, однако мало влияют на болевую симптоматику при СРК [42]. При запорах в педиатрической практике также широко применяются препараты лактулозы (например, Дюфалак), обладающие не только слабительным, но выраженным пребиотическим действием. Перспективным может быть применение комбинированных средств, содержащих пребиотик и масляную кислоту, в качестве ключевого метаболита кишечной микрофлоры, необходимого для нормальной функции толстой кишки (например, Закофальк). Это направление требует дальнейшей разработки.
Таким образом, арсенал медикаментозной терапии СРК достаточно разнообразен. Он включает в себя прокинетики (тримебутин в педиатрической практике), спазмолитики, слабительные средства пребиотического действия, пре- и пробиотики, а в отдельных случаях и антибиотики. Дальнейшие работы в этом направлении, несомненно, расширят наши представления о патогенезе СРК и дадут новые средства для эффективного его лечения.
Литература
С. В. Бельмер, доктор медицинских наук, профессор
А. А. Коваленко, кандидат медицинских наук
Т. В. Гасилина, кандидат медицинских наук
А. Н. Акопян
Н. М. Наринская
ГБОУ ВПО РНИМУ им. Н. И. Пирогова Минздравсоцразвития РФ, Москва
Восстановление микрофлоры кишечника: выбираем лучшее средство
Проблемы с микрофлорой кишечника всегда происходят из-за потери равновесия между благотворными и патогенными бактериями. Микробный дисбаланс происходит за счет доминирования «вредных» бактерий над «хорошими». Такие нарушения называют дисбактериозом. А здоровая флора очень важна, ведь она влияет на:
Более того, бактерии в кишечнике соединяют витамины В7, B12 и К. Если же организм испытывает их недостаток, то могут развиваться такие заболевания, как ожирение, анемия, инсульт, язва, болезни Паркинсона или Альцгеймера и сахарный диабет. А также начинают выпадать волосы, может появиться седина, выступает экзема или себорея. В серьезных случаях начинаются внутренние кровотечения, дегенеративные расстройства и аутоиммунные заболевания. Именно поэтому необходимо восстанавливать микробиоту кишечника, если она нарушена.
Признаки нарушений микробиоты кишечника и дисбактериоз
При дисбактериозе, на всех представителей микрофлоры, которые способны получать свою энергию только через аэробное дыхание, воздействуют неблагоприятные факторы. Далее снижается число бактерий и изменяется микробная популяция. Если случай тяжелый, то может произойти серьезный скачок распространения патогенных микроорганизмов. Например, во время приема антибиотиков, это может проявиться тем, что на 3-4 день приема появится диарея, а в случае длительного воздействия лекарств симптоматика постепенно увеличится.
Основные признаки нарушенной микрофлоры:
Дисбактериоз считается распространенным явлением, которое наблюдается у взрослого населения все чаще. Необходимо учитывать, что дисбактериоз не является отдельной болезнью, он способен развиваться на фоне какого-то основного или хронического заболевания.
Современные способы лечения дисбактериоза
Для того чтобы быстро восстановить микрофлору кишечника, необходимо:
Стоит различать между собой средства, восстанавливающие микрофлору кишечника:
Синбиотики специально созданы, чтобы справляться с:
В его состав входят:
1. Бифидобактерии и лактобактерии (помогают восстановить микрофлору кишечника).
2. α- галактозидаза и β-галактозидаза (помогают переварить сложные углеводы и молочные продукты).
3. Экстракты ромашки, мелиссы, пассифлоры и имбиря (помогают снизить газообразование в ЖКТ, устранить абдоминальный болевой синдром, оказывают антистрессовый эффект).
Люди, страдающие дисбалансом бактерий нередко задаются вопросом, как восстановить микрофлору кишечника у взрослого? В 48% случаях для этого достаточно соблюдение специальной диеты. В рационе должно содержаться необходимое количество белков, жиров и углеводов. Рекомендовано за полчаса до приема еды выпивать 1 ст. воды комнатной температуры.
Рацион должен состоять из:
Важно! Категорически запрещено употреблять жареную, жирную, острую и копченую пищу в период обострения дисбактериоза.
Неприятные признаки дисбактериоза можно попробовать устранить с помощью народной медицины.
Средства для восстановления микрофлоры кишечника:
Профилактика дисбактериоза и других нарушений микрофлоры кишечника
К профилактике можно отнести:
Профилактические действия позволят организму оставаться здоровым и не допустят появления проблем.
Если микрофлора кишечника нуждается в помощи
Поделиться:
Часто желудочно-кишечный тракт работает в сверхурочном режиме. Особенно в праздники и во время отпусков. Переедание, отсутствие режима питания и, для особенно везучих, кишечные инфекции – всё это обратная сторона излишеств, которые мы позволяем себе за столом.
Зима и кишечник: в чём связь?
Важно после гастрономических подвигов устраивать реабилитацию своего ЖКТ. Ведь его силы сейчас нам так нужны. Сезон простудных заболеваний – период, в который активизируются все иммунные силы организма, а кишечник является одним из важнейших иммунных органов.
Совокупность кишечных микроорганизмов (микробиота) принимает непосредственное участие в активации иммунных систем организма. Микрофлора кишечника по большей части состоит из бифидо- и лактобактерий, которые осуществляют очень важные для нашего иммунитета функции:
Именно поэтому, только если микрофлора в норме, кишечник способен выполнять свои защитные функции и организму легче противостоять вирусным заболеваниям.
Есть ли у меня проблемы с микрофлорой?
Признаки дисбактериоза трудно не заметить. Каждый хотя бы раз в жизни сталкивался с этими симптомами:
Если вы обнаружили у себя перечисленные симптомы, то стоит задуматься о том, чтобы поддержать свой организм в непростой осенне-зимний период.
Для начала стоить отметить, что для нормализации работы кишечника необходимо в первую очередь исключить факторы, негативно влияющие на его работу: стресс, неправильное питание, алкоголь, курение. Как только вы вернётесь к здоровому образу жизни, организм начнёт восстанавливать нормальный функционал кишечного тракта. Также на состояние микрофлоры оказывают разрушительное действие некоторые медикаментозные препараты: антибиотики, антидепрессанты, гормональные и другие.
Конечно, для большинства из нас довольно сложно в один момент отказаться от вредных привычек и начать питаться только здоровыми продуктами. Да и отменить приём препарата, назначенного врачом, тоже плохая идея. Для таких случаев существуют препараты, нормализующие микрофлору кишечника, а именно, пробиотики и пребиотики.
Про- или пре-: в чём отличие?
Производители выпускают множество разнообразных БАДов и безрецептурных лекарственных средств с одним (однокомпонентные) или несколькими (поликомпонентные) пробиотиками в составе. Ассортимент данных препаратов представлен разными формами выпуска: порошки в саше, капсулы с лиофилизатами бактерий, жидкие формы, таблетки и прочие.
К сожалению, не существует универсального пробиотика от всех болезней, поэтому наиболее эффективным будет препарат, назначенный врачом в зависимости от причин возникновения дисбактериоза.
По происхождению их можно разделить на вещества:
Наиболее распространёнными в применении пребиотиками являются лактулоза, инулин, олигофруктоза и пищевые волокна. Все эти вещества входят в состав лекарственных препаратов и БАДов, механизм действия которых основан на поддержании баланса и постоянства микрофлоры кишечника.
Не перевариваясь в предыдущих отделах ЖКТ, они транзитом попадают в толстый кишечник и там создают комфортные условия для жизнедеятельности «родных» бактерий микрофлоры.
Вместе или порознь?
В зависимости от индивидуальных особенностей организма, причин, формы и характера дисбактериоза назначенные лекарственные формы и правила приёма пробиотиков и пребиотиков будут отличаться. Они могут применяться вместе, по очереди или в форме синбиотиков (препараты, содержащие полезные бактерии и питательную среду для них). Поэтому их выбор лучше согласовывать с лечащим врачом.
Но есть общие рекомендации, которые актуальны при любых схемах приёма препаратов для нормализации микрофлоры:
При правильно подобранном препарате и регулярном применении пробиотиков и пребиотиков вы очень скоро почувствуете лёгкость и энергичность, а ваш кишечник в благодарность поможет иммунитету противостоять всем невзгодам осенне-зимнего сезона.
Источники:
Анна Горобец, провизор, медицинский журналист
Лекарства от дисбактериоза кишечника
Дисбактериоз кишечника – это нарушение качественного и количественного баланса между различными видами микроорганизмов кишечника. У взрослого человека в норме в кишечнике содержится около 500 видов различных микроорганизмов. В основном это бактерии-симбионты, принимающие непосредственное участие в акте пищеварения.
Лидия Струкова / «Здоровье инфо»
В здоровом организме состав микрофлоры пребывает в состоянии физиологического равновесия. При изменениях в составе кишечной флоры это равновесие сдвигается, приводя к нарушению процесса пищеварения.
Основными представителями нормальной микрофлоры кишечника являются бифидо- и лактобактерии. Остальная микрофлора представлена кишечной палочкой, энтеробактериями, энтерококками, стафилококками, дрожжеподобными грибами.
Дисбактериоз характеризуется резким увеличением численности патогенных микроорганизмов, в то время как представители нормофлоры вырабатывают недостаточное количество веществ, подавляющих жизнедеятельность патогенов. При этом снижается эффективность усвоения многих питательных веществ и минералов, нарушается энергетическое обеспечение организма, в том числе и самого эпителия кишечника, ухудшается синтез и поставка организму витаминов (В12, пантотеновой кислоты), снижается уровень противовирусной защиты, ослабевает местный иммунитет.
Дисбактериоз может стать одной из причин развития тяжелых патологий, например, аутоиммунных (язвенный колит) и функциональных заболеваний (синдром раздраженной толстой кишки).
Нарушение баланса кишечной микрофлоры может быть вызвано различными причинами: неправильным питанием, некачественной пищей, действием антибиотиков, действием химио- и радиотерапии, нервными стрессами, плохой экологической обстановкой и другими факторами.
Основными симптомами дисбактериоза являются диарея, метеоризм, вздутие живота, отрыжка и неприятный привкус во рту, урчание в кишечнике. У многих людей, особенно у детей, страдающих кишечным дисбактериозом, возникают нехарактерные ранее аллергические реакций на продукты питания. Наблюдается интоксикация организма, которая проявляется в снижении аппетита, появлении головных болей и даже повышении температуры тела. При дисбактериозе резко снижается иммунитет, чаще возникают инфекционные заболевания (ОРЗ, ОРВИ, герпес, грибковые поражения).
Лечение дисбактериоза
При дисбактериозе кишечника рекомендовано комплексное лечение, которое направлено на устранение причины возникновения заболевания, коррекцию возникшего патологического состояния пищеварительной системы, снятие острых симптомов заболевания, укрепление защитных свойств и восстановление нормального биоценоза в кишечнике. При длительном и осложненном дисбактериозе кишечника необходимо проконсультироваться с врачом и подобрать необходимый план лечения.
Врач может назначить антибактериальные препараты, которые необходимы для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспоринов, хинолонов (таривид, нитроксолин) и метронидазол. Антибиотики назначают внутрь в обычных дозах в течение 7-10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост патогенов (протея, стафилококков, дрожжевых грибов). К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и другие препараты. При грибковых инфекциях показано применение нистатина или леворина.
Коррекцию состава микрофлоры можно провести с помощью селективных невсасывающихся антибактериальных препаратов (рифаксимин), кишечных антисептиков (энтерофурил), препаратов, содержащих культуры-антагонисты патогенной кишечной флоры, бактериофаги.
Для восстановления иммунитета применяют иммуномодуляторы (иммунал и другие препараты эхинацеи, декарис).
Восстановление нормальной микрофлоры проводят с помошью пробиотиков (препаратов, содержащих живые культуры необходимых микроорганизмов), пребиотиков (веществ, способствующих росту и размножению полезной флоры) или синбиотиков (комплексные препараты, содержащие как сами микроорганизмы, так и необходимые для их развития компоненты).
Наиболее физиологичным при дисбактериозе кишечника является назначение пробиотиков различных поколений: классических бактериальных препаратов, состоящих из монокультур нормальной микрофлоры кишечника (бифидумбактерин, лактобактерин, колибактерин); препаратов, представляющих продукты метаболизма микроорганизмов, в частности, молочной кислоты (хилак форте); комбинированных препаратов, содержащих более одного вида пробиотических микроорганизмов (бификол, бифилонг, ацинол, линекс, ацилакт); комплексных препаратов, содержащих кроме пробиотических микроорганизмов дополнительные компоненты для усиления лечебно-профилактического эффекта (Бифи-форм®, Бифи-форм® Детский, содержащий бифидобактерии и лактобактерин в комплексе с витаминами группы В).
Такие препараты можно назначать без предварительного проведения антибактериальной терапии или после нее с профилактической целью.
Из пребиотиков наиболее известны препараты, содержащие лактулозу (дюфалак, лактусан), пара-амино-метил-бензойную кислоту, лизоцим и пантотенат кальция. В эту группу входят препараты, относящиеся к различным фармакотерапевтическим группам, но обладающие общим свойством – стимулировать рост и развитие нормальной микрофлоры кишечника.
Синбиотики – это препараты, которые являются комбинацией пробиотиков и пребиотиков. Часто это биологически активные добавки, обогащенные одним или несколькими штаммами представителей родов Lactobacillus и Bifidobacterium. В России наиболее известны следующие препараты: Биовестин-лакто (содержит бифидогенные факторы и биомассу B.bifidum, B.adolescentis, L.plantarum), Мальтидофилюс (содержит мальтодекстрин и биомассу B.bifidum, L.acidоphilus, L.bulgaricus), Бифидо-бак (включает фруктоолигосахариды из топинамбура и комплекс из бифидо- и лактобактерий), Бифидумбактерин-мульти 1,2,3 и Бифистим 1,2,3 (содержат набор различных видов бифидобактерий, свойственный определенному возрасту ребенка, подростка или взрослого), Ламинолакт (содержит аминокислоты, пектины, морскую капусту и энтерококки).
Больным кишечным дисбактериозом показана диета №4 (модификации в зависимости от состояния), способствующая нормализации деятельности кишечника, уменьшению активности гнилостных процессов. В рацион целесообразно включать продукты, содержащие пищевые волокна, живые бактериальные культуры (кефир, йогурты, другие молочнокислые продукты). Лучше всего исключить из рациона жирную, острую пищу, копчености, маринады. Необходимо обращать внимание и на режим питания.
Для профилактики дисбактериоза необходимо соблюдать все рекомендации врача по лечению любой патологии желудочно-кишечного тракта, использовать лекарства, особенно антибиотики, только по рекомендации врача и строго в назначенной дозировке.
При неосложненных формах дисбактериоза можно использовать народные средства. Например, принимать рисовый отвар или настой из коры дуба. Помогает при дисбактериозе кишечника свежий чеснок, если употреблять его за час до приема пищи и перед сном. Еще одно народное средство – настой из травы зверобоя продырявленного, цветков ромашки аптечной, листьев мяты перечной и подорожника.
Топ-9 лучших слабительных средств
Самые эффективные препараты для лечения запора.
1 октября, 2021 год
Содержание
Такая деликатная проблема, как запор, случалась у каждого, и это – самое распространенное нарушение работы ЖКТ. Запор опасен для здоровья, особенно если он хронический. Мы расскажем о причинах такого состояния и лучших слабительных средствах.

Почему возникает запор у взрослых
Причин запора – множество (как медицинских, так и социальных). Временный запор может случаться на фоне стресса, какого-то заболевания, определенного образа жизни, при нарушении режима питания, во время путешествий, при приеме определенных препаратов. Разделяют органические и функциональные причины запора.
1. Органические причины запора. Среди таких причин – любые заболевания кишечника или желудка, препятствующие нормальному опорожнению:
2. Функциональные причины запора. Эти причины не связаны з болезнями ЖКТ. Среди них:
Перистальтика кишечника нарушается из-за недостаточного количества воды, нерационального питания, недостатка в рационе клетчатки. Именно растительная клетчатка увеличивает объем кала в кишечнике и заставляет его правильно работать. Поэтому для профилактики запоров нужно есть овощи, фрукты и злаки. Также перистальтика нарушается, если человек ведет сидячий образ жизни – отсутствие физической нагрузки снижает мышечный тонус, сокращение кишечника замедляется.
Если человек долго принимал слабительные, а потом перестал, у него тоже может развиться запор из-за снижения тонуса кишечника и развития дисбактериоза.
Хронические запоры негативно влияют на общее самочувствие и качество жизни в целом. Запор вызывает боли в животе, повышенное газообразование, потерю аппетита и тошноту. Если долго не ходить в туалет, повышается риск:
Симптомы запора
В европейских странах для постановки диагноза «запор» применяют шкалу Томпсона. Если в течение года у человека регулярно наблюдается хотя бы один из нижеперечисленных симптомов, можно говорить о запоре:
Как правильно выбрать слабительное
Часто для нормализации стула достаточно наладить правильное питание. Бывает, что даже разовый прием овощей или фруктов способен улучшить моторику кишечника. Если добавление в рацион растительной клетчатки не помогло, необходимо принимать слабительные. Рекомендуем обязательно проконсультироваться с врачом по поводу лекарства от запора, потому что многие из них имеют противопоказания и побочные эффекты. При выборе таких препаратов нужно учитывать некоторые моменты.
Почти все слабительные средства нельзя принимать длительно, потому что организм к ним привыкает. Естественная работа кишечника со временем снижается, ведь он адаптируется к тому, что препараты «делают работу» за него.
Какие бывают слабительные
В аптеках есть масса слабительных, которые применяются в тех или иных случаях. Давайте разберемся, какое слабительное выбрать.
Лечение запора предполагает обязательное соблюдение диеты. Очень важно изменить свое питание, чтобы в рационе были продукты, стимулирующие сокращение кишечника. Если вы будете бороться с запором только с помощью слабительных, организм привыкнет к ним и «разучится» работать самостоятельно. Поэтому питание должно быть параллельным лечением!
Самые эффективные слабительные
Мы составили список препаратов от запора, проанализировав данные клинических исследований, отзывы врачей и пациентов. Сюда вошли средства для лечения разных видов запора у взрослых (некоторые препараты подходят и для детей). Если по шкале Томпсона вы подозреваете, что у вас хронический запор, обязательно обратитесь к врачу, чтобы он назначил соответствующее лечение.
Мукофальк
Немецкое слабительное средство на растительной основе (оболочки семян подорожника) продается в форме порошка, из которого готовят суспензию. Это удобно для тех, у кого есть проблемы с глотанием. Семена подорожника впитывают много воды, что и дает положительный эффект при запоре. Кроме семян подорожника, «Мукофальк» содержит много растительной слизи, что обеспечивает легкое отхождение каловых масс. Это слабительное назначают детям с 12 лет, а еще используют в комплексном лечении повышенного холестерина. Среди плюсов препарата – приятный апельсиновый вкус, отличная переносимость, длительный эффект и возможность применения во время беременности. Есть некоторые побочные эффекты, с которыми обязательно нужно ознакомиться в инструкции.
Мукофальк
Др. Фальк Фарма, Германия
— запор (в т.ч. при беременности); — анальные трещины; — геморрой; — послеоперационный период при вмешательствах в аноректальной области (в целях создания более мягкой консистенции стула); — функциональная диарея; — синдром раздраженного кишечника.
Нормализация микрофлоры кишечника, препараты для восстановления
Благодаря микрофлоре кишечника, пища в организме человека усваивается, и питательные вещества поступают ко всем клеткам. Но иногда случается так, что микрофлора нарушается по тем или иным причинам. И если вдруг такое произошло, то непременно нужно приложить максимум усилий, чтобы восстановить ее. Какие существуют препараты для нормализации микрофлоры кишечника?
Немного о микрофлоре кишечника
Линекс — препарат для микрофлоры
Прежде чем перейти к препаратам, которые помогут восстановить микрофлору кишечника, нужно немного узнать больше о ее особенностях, чтобы понять, насколько важно назначение. Микрофлора кишечника начинает развиваться уже с рождения, но из-за особенностей организма, полностью она формируется только к 13 годам. В составе микрофлоры имеется около 500 различных бактерий, 99 процентов которой составляют полезные, а всего лишь 1 процент — вредные. Полезные бактерии помогают переваривать поступившую в организм пищу, усвоить витамины и минералы.
Как правило, к полезным бактериям относят бифидобактерии, лактобактерии, бактероиды, энтерококки, кишечную палочку. Что же касается вредных бактерий, которые в любой момент могут активироваться и нарушить общую флору, относят стафилококки, синегнойную палочку и др. Микрофлора кишечника имеет огромное значение для всего организма в целом:
Именно поэтому пристальное внимание следует уделять своему здоровью, микрофлоре кишечника, так как от ее состояния зависит общее благополучие организма и самого человека.
Нарушение микрофлоры
Микрофлора в кишечнике может нарушиться по разным причинам
Существует множество причин, почему микрофлора в кишечнике может нарушиться. И в зависимости от того, что стало провоцирующим факторов, будет зависеть лечение, в процессе которого уделяется внимание не только восстановлению самой флоры, но и устранению негативных факторов. К основным причинам нарушения микрофлоры можно отнести:
В зависимости от того, что стало причиной нарушения микрофлоры, будет зависеть лечение, так как недостаточно просто принимать препараты для улучшения микрофлоры. Необходимо убирать и провоцирующий фактор, потому что в противном случае, даже если вылечить кишечник, но не перестать, например, неправильно питаться, спустя короткий промежуток времени проблема вернется вновь.
Восстановление микрофлоры кишечника
После того, как был пропит курс Энтерола и Лактофильтрума, можно переходить и к процессу заселения кишечника полезными бактериями. Препаратов существует множество, главное подобрать тот, который больше всего подходит. Следует отметить, что сделать это может только врач, который основываясь на индивидуальных особенностях организма, а также ранее принимаемых лекарствах, выпишет тот препарат, который точно поможет.
Разновидности препаратов
Бактистатин в капсулах
Как уже было сказано выше, подобрать препарат для восстановления микрофлоры кишечника может только врач, потому что на сегодняшний день существует несколько видов лекарств, которые способны решить эту проблему. Делятся они на три группы:
Нормализация макрофлоры кишечника у детей
Особое внимание стоит уделить восстановлению микрофлоры кишечника у детей, потому что именно в детском возрасте происходит становление иммунитета, а также общее развитие организма, где очень важно, чтобы клетки и органы получали необходимое количество питательных веществ и витаминов для нормального роста. К самым распространенным препаратам, которые рекомендуют давать детям для восстановления микрофлоры кишечника, относят:
Только врач сможет назначить тот или иной препарат ребенку, потому что все случаи индивидуальны, и одному подойдет Линекс, а другому придется пропить длительный курс Нормобакта.
Нормализация микрофлоры у беременных женщин
Препараты также помогают беременным
Во время беременности у женщины может появиться множество проблем со здоровьем, о которых раньше она даже и не знала. Происходит это из-за изменения гормонального фона, а также из-за увеличившейся нагрузки на весь организм. Дисбактриоз часто мучает женщин «в положении», поэтому особое внимание нужно уделить устранению проблемы самым безопасным путем. В первую очередь врач назначит специальную диету, во время которой нельзя будет кушать жирную, острую пищу, а также придется исключить некоторые продукты из рациона. После этого врач назначит препараты для восстановления микрофлоры, которые считаются безопасными для будущей мамы и для ее малыша. К ним относят:
Так как организм каждый женщины индивидуален, то врач может скорректировать лечение в зависимости от сложности ситуации. Так, помимо препаратов и диеты, беременной нужно будет пить больше кефира, и кушать кисломолочные продукты, которые лучше всего восставят микрофлору кишечника. Правда, не все беременные могут пойти на это, потому что вкусовые предпочтения меняются, и нередко определенный продукт может вызвать отвращение и рвоту. Некоторые препараты, например, такие как Бифидумабактерин, Лактонорм, выпускаются в виде свечей, которые считаются наиболее безопасными. Потому что не всасываются в кровь, а оказывают прямое воздействие на слабое место.
Препараты для нормализации микрофлоры кишечника сами по себе не окажут должного действия, потому что необходимо перед заселением флоры полезными бактериями очистить ее от патогенных. Только в этом случае эффект будет положительным. Также, не рекомендуется принимать препараты во время приема антибиотиков, потому что положительного действия не будет никакого, только потрачено время. Лучше сразу после окончания курса, начать пить лактобактерии.
Процесс восстановления микрофлоры долгий. Нужно набраться терпения и ждать, потому что даже дорогие лекарственные препараты не смогут за короткий срок восстановить ее на 100 процентов.
Слабительные средства при запорах у взрослых, виды
Задержка опорожнения — довольно распространенная проблема. Запор может быть самостоятельным функциональным нарушением со стороны кишечника или симптомом определенных заболеваний. В случаях, когда не удается найти изменения в кишечнике и других органах, говорят о первичном запоре.
Восстановить нормальную работу кишечника позволят такие меры, как соблюдение комплексных рекомендаций и прием слабительных для взрослых. Препараты классифицируются на несколько групп и помогают сравнительно быстро восстановить процесс очищения кишечника, избавляют от плотных каловых масс и улучшают самочувствие.
Некоторые препараты действуют в момент приема, другие разрешены к длительному применению и помогают нормализовать работу кишечника в долгосрочной перспективе. Сегодня на рынке лекарственных средств можно встретить такие группы слабительных:
объемные — увеличивающие объем содержимого кишечника.
Каждая группа препаратов позволяет решать конкретные проблемы, вызвавшие задержку стула.
Стимулирующие слабительные
Стимулирующие перистальтику слабительные от запоров носят такое название потому, что раздражают рецепторы кишечника. Они воздействуют непосредственно на нервные окончания слизистых оболочек кишки, причем некоторые из них (касторовое масло) активизируют моторику тонкого кишечника, другие активизируют толстую кишку. К последним относят препараты на основе сенны, крушины, серы и др. Выделяют и лекарства, которые приобретают активную форму под влиянием ферментов кишечника. Они работают и в толстом, и в тонком кишечнике.
Следует помнить, что стимулирующие препараты при неумелом применении могут быть причиной развития серьезных побочных эффектов. К основным осложнениям относят собственно сам эффект: может начаться диарея, сопровождающаяся спастическими болями в животе. Из-за поноса в организме уменьшается объем жидкости, количество солей — ионов калия, натрия. Поэтому длительно поддерживать такое состояние с помощью стимуляторов кишечника ни в коем случае нельзя.
Главный гастроэнтеролог Главного медицинского управления Минушкин О. Н. в своей работе подчеркивает, что «раздражающие слабительные, которые реализуют эффект своего действия через рецепторный аппарат, в конечном итоге приводят к зависимости работы кишечника от их приема, к откладыванию меланина в эпителиоцитах и меланозу, дистрофическим изменениям слизистой и токсическому влиянию на почки и печень. Конечным эффектом является «инертная кишка»» (Минушкин О. Н., 2003, с. 52).
Инертная кишка, о которой идет речь, — это так называемый феномен ленивого кишечника. Из-за чрезмерного стимулирования толстая кишка теряет тонус, ей требуется все больше стимулирующего вещества. Без слабительного она попросту теряет способность сокращаться и продвигать каловые массы.
Такой запор будет прогрессировать, и это необратимый процесс. Врачи не назначают стимулирующие препараты сроком более чем на 2 недели в связи с быстрым привыканием. А в большинстве случаев целесообразно подобрать более безопасное слабительное.
Размягчающие слабительные
К таким препаратам относят следующие:
масла: вазелиновое, миндальное;
Размягчающие вещества способствуют пропитыванию кала водой, делают его консистенцию мягче, облегчают продвижение каловых масс. Такие слабительные буквально смазывают слизистые оболочки кишечника. Однако сегодня препараты этой группы применяются сравнительно редко, что связано с побочными эффектами на фоне их приема.
В работе доктора медицинских наук, профессора Минушкина О. Н. об этом есть следующая информация: «Издержки препаратов, размягчающих фекальные массы (или «смазывающих») снижают абсорбцию жирорастворимых витаминов» (Минушкин О. Н., 2003, с. 52).
Объемные слабительные
Многие специалисты считают объемные слабительные препаратами выбора: именно их назначают людям с запором в первую очередь, если не удается справиться с симптомом путем коррекции образа жизни и соблюдения диеты.
Такие эффективные слабительные задерживают воду в кишечнике, набухают, увеличивают объем содержимого кишки, растягивая ее стенки. Избыточное растяжение способствует усилению перистальтики и ускоряет процесс опорожнения.
Группа препаратов включает в себя следующие подвиды:
слабительные на основе растительных волокон;
осмотические препараты на основе макрогола, лактулозы, солей.
Такие препараты не оказывают системного действия, не всасываются и не попадают в кровь. Врачи отмечают их эффективность. Например, доктор медицинских наук, профессор Григорьева Г. А. указывает, что «слабительные, увеличивающие объем кишечного содержимого и понижающие его вязкость, способствуют физиологическому функционированию кишечника (Григорьева Г. А., 2003, с. 12).
Рассмотрим подробнее каждый из подвидов объемных слабительных.
Избавьтесь от проблем с кишечником
Натуральный британский препарат не вызывает привыкания и действует сразу
На основе полиэтиленгликоля (ПЭГ), или макрогола
ПЭГ считается плохо всасывающимся веществом, что делает его способным удерживать воду в просвете кишки. При этом макрогол не приводит к обезвоживанию, он только задерживает всасывание воды. В результате стул приобретает более жидкую консистенцию, увеличивается частота дефекаций.
У макрогола есть и побочные эффекты: гипотония кишечника, которая развивается медленно, а также потенцирование недержания кала. Поэтому принимать такие препараты рекомендовано не дольше 14 дней.
Солевые слабительные
В таких слабительных используются концентрированные соли:
Подобные слабительные от запоров действуют на уровне тонкого кишечника. Они повышают осмотическое давление, что позволяет привлечь и удержать жидкость в просвете кишки. Под влиянием солей кал становится жидким, а стул — частым. Такой эффект и не позволяет постоянно принимать солевые слабительные, поскольку это чревато нарушениями солевого обмена и снижением качества жизни человека.
Людям с болезнями почек и сердечно-сосудистой системы также не рекомендуется использовать солевые слабительные без согласования с врачом. Обычно именно такие препараты применяют в рамках подготовки к эндоскопическим обследованиям.
На основе лактулозы
Лактулоза оказывает слабительный эффект опосредованно, через полезную флору кишечника. Компонент выступает пищей для бифидобактерий и лактобактерий. Последние выделяют вещества с эффектом, напоминающим эффект от осмотических слабительных. При этом обильного жидкого стула не наблюдается, поскольку лактулоза действует на уровне толстого кишечника.
При однократном применении слабительный эффект наступит через 1−2 дня, но при систематическом может появляться уже через 2−4 часа. Лактулоза не всасывается в кишечнике и не оказывает системного действия, но иногда приводит к вздутию живота.
На основе пищевых волокон
Пищевые волокна (клетчатка) — это составляющая растительной пищи. В больших количествах клетчатка содержится в отрубях, свежих овощах и фруктах, ягодах, морской капусте. Также ее много в оболочке семян льна и подорожника (псиллиум), отрубях.
Именно такие компоненты и являются основой объемных слабительных. Некоторые из средств с подобным действием имеют в составе целлюлозу.
Клетчатка разбухает в просвете кишечника, увеличивает объем каловых масс. Это приводит к раздражению стенок кишечника из-за растяжения. Нерастворимые пищевые волокна мягко стимулируют стенки и улучшают перистальтику. Поскольку пищевые волокна активно впитывают воду, при приеме слабительных на их основе важно пить достаточно жидкости.
Такие препараты можно по праву считать слабительными мягкого действия — они не провоцируют так называемый драстический эффект, а их прием не сопровождается болями и спазмами. Однако они могут начать работать не сразу, обладают отсроченным действием.
К существенному преимуществу таких слабительных средств относят возможность длительного или даже постоянного применения. Кроме того, у этих препаратов минимум противопоказаний, они не вызывают привыкания и действуют максимально физиологично. Поэтому считаются самыми безопасными слабительными с полезным для работы кишечника действием.
Выбирая между препаратами на основе отрубей и слабительными на основе псиллиума, следует учесть, что прием первых может сопровождаться повышенным газообразованием. Поэтому в большинстве случаев целесообразнее использовать БАД на основе семян подорожника. Один из таких препаратов — «Фитомуцил Норм».
Преимущества препарата «Фитомуцил Норм»
Не нужно при запоре, путем экспериментов, выяснять, какое слабительное хорошее, врач даст необходимые назначения. В большинстве случаев достаточно применения объемных препаратов. Безвредное слабительное «Фитомуцил Норм» относят к этой группе средств.
Это английский препарат представляет собой объемное слабительное на основе оболочки семян подорожника блошиного и мякоти плодов сливы домашней. Он содержит растительные растворимые и нерастворимые волокна. Первые впитывают воду в кишечнике и превращаются в гель, размягчают каловые массы, увеличивают их объем, а нерастворимые стимулируют перистальтику кишечника.
За счет этого препарат восстанавливает нормальную моторику, естественный ритм работы кишечника. При этом прием биодобавки не сопровождается спазмами и болями, диареей и другими побочными эффектами.
Основные преимущества «Фитомуцила Норм»:
отсутствие привыкания: препарат не оказывает стимулирующего действия на рецепторы кишечника;
минимум противопоказаний: к таковым относятся только кишечная непроходимость, острые воспалительные заболевания кишечника, аллергические реакции;
возможность длительного применения без последствий для здоровья;
эффект — не эпизодическая помощь, а регуляция работы кишечника, нормализация процессов опорожнения;
отсутствие побочных эффектов в виде спазмов и болей, частого жидкого стула.
Слабительное выпускается в виде порошка в пакетиках или банке. Пакетики удобно брать с собой в дорогу, а банку можно использовать дома. Принимать «Фитомуцил Норм» рекомендуется утром и вечером за 10−15 минут до еды по 1 пакетику порошка, растворить который можно в стакане любого негазированного и безалкогольного напитка — воды, компота, кефира, сока и пр.
Принимать препарат можно длительно по согласованию с врачом. Специалист расскажет о том, какое слабительное поможет в конкретном случае, и разработает оптимальную схему применения.
Важно проконсультироваться с врачом по поводу слабительного для взрослых. Могут существовать определенные ограничения, и только специалист подскажет, как справиться с проблемой. Статья имеет ознакомительный характер. Авторы не несут ответственности за качество оказания услуг третьими лицами и за возможные осложнения.
Минушкин О. Н. Осложнения фармакотерапии запоров // Приложение РМЖ «Болезни Органов Пищеварения». — 2003. — № 2. — С. 52.
Григорьева Г. А. Запор (от симптома к диагнозу, от диагноза к лечению) // Приложение РМЖ «Болезни Органов Пищеварения». — 2003. — № 1. — С. 12.
Повышенная проницаемость эпителиального барьера кишечника: механизмы и роль в патогенезе аутоиммунных заболеваний

В литературе появляется все больше данных о ключевой роли микрофлоры кишечника в поддержании нормального функционирования эпителиального барьера и эффективности пробиотиков в предотвращении синдрома повышенной эпителиальной проницаемости
Авторы: Qinghui Mu, Jay Kirby, Christopher M. Reilly, Xin M. Luo
Эпителиальная выстилка кишечника выполняет барьерную функцию, предотвращая попадание люминального содержимого (из просвета кишки) в ткани и органы. Нарушение барьерной функции кишечного эпителия приводит к проникновения через стенку кишечника токсинов, пищевых антигенов и микроорганизмов, что лежит в основе патогенеза различных воспалительных и аутоиммунных заболеваний. В литературе появляется все больше данных о ключевой роли микрофлоры кишечника в поддержании нормального функционирования эпителиального барьера и эффективности пробиотиков в предотвращении синдрома повышенной эпителиальной проницаемости, в том числе посредством усиления экспрессии белков плотных контактов. С другой стороны, патогенные бактерии и их метаболиты могут нарушать структуру плотных контактов, способствуя нарушению барьерной функции и развитию аутоиммунных заболеваний. Таким образом, регуляция гомеостаза кишечной микрофлоры является эффективным механизмом защиты кишечного барьера и регуляции эпителиальной проницаемости, и может рассматриваться как потенциальное средство предотвращения и облегчения симптомов аутоиммунных заболеваний.
Ключевые слова: синдром повышенной эпителиальной проницаемости, кишечная микрофлора, бактериальная транслокация, пробиотики, аутоиммунные заболевания
Слизистая оболочка кишечника играет важную роль в пищеварении и поддержании гомеостаза (1). Помимо питательных веществ, абсорбируемых через слизистую оболочку, через эпителиальную выстилку могут проникать различные микроорганизмы и высокомолекулярные вещества, включая пищевые антигены, токсины и бактериальные метаболиты. Для предотвращения проникновения внешних антигенов через стенку желудочно-кишечного тракта (ЖКТ), необходимо постоянное поддержание нормального функционирования эпителиального барьера кишечника. В тонком кишечнике защитный барьер представлен монослоем специализированных эпителиальных клеток, связанных друг с другом белками плотных контактов, а также различными гуморальными факторами, включая муцины, иммуноглобулины и цитокины. Нарушение нормального функционирования звеньев этой системы может приводить к повышению проницаемости эпителиальной выстилки, и, как следствие, проникновению внешних агентов через межклеточные барьеры, что оказывает патологическое воздействие на работу кишечника и организма в целом. Нарушение барьерной функции кишечника лежит в основе патогенеза различных аутоиммунных и воспалительных заболеваний, включая синдром раздраженного кишечника, целиакию, аутоиммунный гепатит, сахарный диабет 1 типа, рассеянный склероз и системную красную волчанку (2–6).
На функционирование кишечного барьера оказывают влияние различные факторы, включая качественный и количественный состав кишечной микрофлоры, пищевые антигены и алкоголь. Нарушение эпителиальной проницаемости характерно не только для людей, но и для других млекопитающих, что позволяет исследовать механизмы нарушения барьерной функции кишечника на животных моделях (7, 8).
В последние годы все больший интерес вызывает изучение роли микрофлоры кишечника в патогенезе синдрома повышенной эпителиальной проницаемости и регуляции барьерной функции кишечника (9). В настоящем обзоре представлены последние данные о механизмах и патогенетических факторах, способствующих повышению проницаемости кишечной стенки и нарушению барьерной функции кишечного эпителия, и о связи между кишечной проницаемостью и наиболее распространенными аутоиммунными заболеваниями.
Кишечный барьер
В кишечник человека попадает большое количество внешних агентов, включая разнообразные микроорганизмы, токсины и антигены. Нарушение барьерной функции кишечной стенки облегчает проникновение этих агентов через эпителиальную выстилку кишечника в кровоток и лимфатическую систему. Физические, биохимические и иммунологические особенности барьерной системы тонкого кишечника позволяют предотвратить проникновение большинства патогенов из полости кишечника в ткани и органы (Рисунок 1).
Рисунок 1. Схематическое изображение кишечного барьера, в т.ч. физического (эпителий, плотные контакты, слизь, комменсальные бактерии), биохимического (АМП) и иммунологического (лимфоциты и IgA).
Физический барьер
Основу физического барьера кишечника составляет эпителиальный слой, общая площадь которого превышает 400 кв. м (1) (Рисунок 1). Кишечный эпителий состоит из семи функциональных подтипов кишечных эпителиальных клеток: энтероцитов, бокаловидных клеток, клеток Панета или ацидофильных энтероцитов, эндокриноцитов, микроскладчатых клеток (М-клеток), чашеобразных и пучковых клеток, хотя функция последних двух типов до сих пор малоизучена (10). Энтероциты – абсорбирующие клетки, составляющие основную массу клеток эпителия кишечника и до 90 % клеток ворсинок и кишечных крипт. Функция энтероцитов не ограничивается всасыванием питательных веществ. Появляется все больше сведений об их роли в регуляции количества грамположительных бактерий посредством экспрессии антимикробного белка (АМП) RegIIIγ семейства регенераторных Reg-антимикробных пептидов (11–13). Все эпителиальные клетки кишечника дифференцируются из эпителиальных стволовых клеток линии Lgr5+, расположенных в основании кишечных крипт (14). У млекопитающих клетки кишечного эпителия обновляются каждые 3–5 дней (10, 15), за исключением клеток Пенета, цикл жизни которых составляет до 2-х месяцев.
Эпителиальная выстилка кишечной стенки непрерывна. Механическое соединение клеток обеспечивается плотными контактами (16), через которые осуществляется парацеллюлярный транспорт веществ из полости кишечника в кровоток и лимфу. Известно более 40 белков, входящих в эти комплексы, среди которых наиболее хорошо изучены окклюдины, клаудины, молекулы клеточной адгезии семейства JAMs (JAM-A) и трицеллюлин (17). Увеличение парацеллюлярного транспорта вследствие патологических процессов в кишечнике может приводить к проникновению высокомолекулярных соединений из интерстиция в кровоток.
Слизистый слой эпителиальной выстилки кишечника представлен двумя слоями – внутренним и внешним, ограничивающими эпителий от кишечных бактерий и продуктов их метаболизма. Основным компонентом слизи в тонком и толстом кишечнике является гликозилированный гелеобразующий муцин второго типа (MUC2), секретируемый бокаловидными клетками. Помимо этого, слизистый слой содержит различные активные молекулы, в частности IgA, ферменты и белки, включая лактоферрин (18). Бокаловидные клетки продуцируют не только муцин MUC2, но и другие важные компоненты слизи – ZG16, AGR2, FCGBP, CLCA1 и TFF3 (19, 20). У мышей с нокаутом гена Muc2 развивается спонтанный колит, что подчеркивает защитную функцию MUC2 (21). Помимо гельобразующих муцинов, в слизистом слое кишечника присутствуют трансмембранные муцины, экспрессируемые преимущественно энтероцитами и находящиеся вблизи апикальной поверхности эпителиальных клеток (20).
Комменсальные бактерии способствуют поддержанию барьерной функции кишечного эпителия (22). Во-первых, они предотвращают колонизацию слизистой оболочки патогенными микроорганизмами, создавая конкурентную среду и занимая поверхность эпителиальной выстилки, и высвобождая антимикробные соединения (23, 24). Во-вторых, бактерии кишечной микрофлоры участвуют в регуляции переваривания и абсорбции питательных веществ, служащих источником энергии для эпителиальных клеток (25). Короткоцепочечные жирные кислоты, синтезируемые кишечными бактериями, служат основным источником энергии для клеток слизистой толстого кишечника (26). Таким образом, эпителиальные клетки кишечника, слизистый слой и кишечная микробиота составляют физический барьер, препятствующий проникновению экзогенных факторов из содержимого кишечника во внутреннюю среду организма.
Биохимический барьер
Усилению барьерных функций слизистой оболочки кишечника способствуют молекулы, обладающие антимикробным действием, в частности желчные кислоты и антимикробные пептиды (АМП) (27, 28) (Рисунок 1). Эти соединения усиливают барьерную функцию эпителия и препятствуют прямому контакту люминального содержимого с тканями и органами.
Количество микроорганизмов значительно увеличивается по мере продвижения от проксимальных отделов ЖКТ, где обнаруживается лишь небольшое количество бактерий (29), к дистальным (30). АМП, продуцируемые представителями кишечной микрофлоры, включают α- и β-дефенсины, лектин С, кателицидины, лизоцим и кишечную щелочную фосфатазу (КЩФ) (27). Антимикробные свойства этих пептидов подробно обсуждаются в работе Kopp с соавторами (31). В эпителиальной выстилке кишечника антибактериальные пептиды секретируются преимущественно клетками Панета.
Иммунологический барьер
Иммунологический барьер кишечника представлен одиночными лимфоидными фолликулами и пейеровыми бляшками – периферическими скоплениями лимфоидных клеток, расположенными в собственной пластинке слизистой оболочки тонкой кишки. Внутри фолликулов находятся различные иммунные элементы, включая В- и Т-лимфоциты, дендритные клетки (ДК) и нейтрофилы, секретирующие цитокины и антитела в ответ на проникновение антигена (Рисунок 1). М-клетки участвуют в трансцитозе антигенов из просвета кишечника к подлежащим иммунным клеткам (14).
Бокаловидные клетки участвуют в презентации люминальных антигенов комплексу CD103+ ДК собственной пластинки слизистой оболочки кишечника, образуя антигенные комплексы (goblet cell-associated antigen passages, GAPs) (32, 33). В толстом кишечнике у стерильных мышей или животных, получающих антибиотики, также может происходить спонтанная презентация антигена (34). Это указывает на роль кишечной микрофлоры в захвате антигенов и образовании GAPs (35). Кроме того, бокаловидные клетки и GAPs способны подавлять транслокацию патогенных бактерий из просвета кишечника во внутреннюю среду организма (36). Антигены также могут связываться и распознаваться субэпителиальными мононуклеарными фагоцитами (37, 38), экспрессирующими на поверхности рецептор фракталкина CX3CR1. Распознавание антигенов происходит за счет трансэпителиальных дендритов (39, 40), образование которых регулируется CX3CR1+ макрофагами и экспрессией CX3CL1 некоторыми клетками кишечного эпителия (41, 42).
Секреторные IgA (SIgA), еще один компонент иммунного барьера кишечника, продуцируются плазмоцитами (в организме взрослого человека – 50 мг/кг SIgA
ежедневно) и локализуются преимущественно в собственной пластинке слизистой оболочки кишечника. Считается, что SIgA способны взаимодействовать с комменсальными бактериями кишечника, опосредуя формирование бактериальной биопленки. Важной особенностью SIgA является их устойчивость к действию кишечных протеаз, что обеспечивает поддержание защитой функции даже в условиях агрессивной среды кишечника (43). SIgA могут проникать через эпителиальную выстилку в просвет кишечника, связывать антигены и доставлять их к иммунным клеткам лимфоидной ткани.
Важную роль в поддержании нормального функционирования барьерной функции кишечника также играют различные химические факторы и нервная регуляция.
Микрофлора кишечника и кишечный барьер
Распознавание бактерий в кишечнике опосредовано рецепторами PRR (образраспознающие рецепторы, Pattern-Recognition Receptors), распознающими патоген-ассоциированные молекулярные паттерны (РАМР), включая toll-подобные рецепторы (TLR) и нуклеотид-связывающие домен-рецепторы олигомеризации (NOD-подобные рецепторы, NLR). Взаимодействие между бактериями кишечника и клетками хозяина во многом зависит от распознавания микробно-ассоциированных молекулярных паттернов образраспознающими рецепторами PRR, экспрессируемыми на поверхности иммунных и неиммунных клеток.
Продукты жизнедеятельности бактерий также способны нарушать барьерную функцию кишечной стенки и изменять проницаемость кишечного барьера. Одним из последствий нарушения целостности кишечного барьера и повышения эпителиальной проницаемости является бактериальная транслокация, которая сопровождается проникновением бактерий и их метаболитов через эпителиальный слой, вызывая системное воспаление и повреждение тканей (Рисунок 1) (44).
Результаты экспериментальных исследований на стерильных животных указывают на критическую роль кишечной микрофлоры в развитии и поддержании барьерной функции кишечника. Отсутствие бактериальной флоры у стерилизованных мышей приводит к снижению толщины слизистого слоя кишечника (45–48). Качественный и количественный состав кишечной микрофлоры вносит значительный вклад в поддержание целостности слизисто-эпителиального барьера кишечника за счет регуляции продукции слизи бокаловидными клетками (49, 50). Снижение толщины слизистого слоя облегчает проникновение микроорганизмов в субэпителиальное пространство, вызывая воспалительную реакцию и ассоциированные заболевания, в частности колит (46, 51).
Комменсальные бактерии и бактериальные продукты, например, липополисахариды (ЛПС) и пептидогликан, способствуют восстановлению слизистого слоя кишечника (46, 47). Все вместе, комменсальные бактерии и слизистый слой играют основополагающую роль в поддержании кишечного гомеостаза (48). Разнообразные АМП, секретируемые в слизистом слое и активные в отношении патогенных микроорганизмов, позволяют угнетать их активность и регулировать колонизацию кишечника комменсальными бактериями. Секреция некоторых АМП реципрокно регулируется кишечной микробиотой и/или ее бактериальными продуктами. Например, активность антимикробного пептида RegIIIγ, способствующего отделению комменсальных бактерий от кишечного эпителия (11), снижена у пациентов на фоне частого употребления алкоголя и у мышей, получающих этанол (52, 53). Прием пребиотиков, в частности Lactobacilli и Bifidobacteria, позволяет восстановить активность RegIIIγ и стимулировать рост нормальной микрофлоры кишечника (53). Синтез и секреция фактора ангиогенеза Ang4, обладающего антибактериальной активностью, клетками Панета мышей также преимущественно регулируется представителями облигатной кишечной микрофлоры Bacteroides thetaiotaomicron (54).
Кишечная микробиота может взаимодействовать с рядом АМП, в частности кишечной щелочной фосфатазой КЩФ, продуцируемой эпителиальными клетками кишечника и связанной с клеточной мембраной. При секреции в просвет кишечника активность КЩФ сохраняется (55, 56). При недостатке щелочной фосфатазы у нокаутных мышей наблюдается нарушение естественного гомеостаза кишечной микробиоты, в частности снижение популяции Lactobacillaceae, по сравнению с особями дикого типа (57, 58). Повышение активности КЩФ избирательно повышает количество пробиотических бактерий (напр., Bifidobacterium), подавляющих патогенный рост ЛПС-продуцирующих микроорганизмов (напр., Escherichia coli) (59). Способность КЩФ инактивировать ЛПС in vivo обуславливает ключевую роль этого фермента в предотвращении проникновения бактериальных ЛПС в кишечную стенку (60, 61).
Кишечная микробиота также способна регулировать экспрессию КЩФ. У стерильных рыб Danio rerio, добавление бактериальных ЛПС или колонизация кишечника комменсальными микроорганизмами в значительной степени повышает экспрессию КЩФ (62). Влияние КЩФ на усиление барьерной функции кишечного эпителия также обусловлено способностью этого фермента регулировать продукцию белков плотных контактов и увеличивать экспрессию ZO-1, ZO-2 и окклюдина (63). Рядом исследований продемонстрирована роль различных АМП в реципрокной регуляции состава кишечной микрофлоры (64, 65).
Источником образования новых эпителиальных клеток кишечника, образующих непрерывный монослой, служат стволовые клетки, расположенные на базальной части кишечных крипт и экспрессирующие TLR4 рецепторы к ЛПС. Непрерывное и быстрое обновление клеток кишечного эпителия играет ключевую роль в поддержании барьерной функции эпителиальной выстилки (66). Около 10% транскрипции генов, связанных с иммунной функцией, клеточной пролиферацией и метаболизмом в эпителиальных клетках кишечника регулируется бактериями кишечника (67). Снижение скорости пролиферации эпителиальных клеток у стерильных мышей, лишенных бактериальной флоры, или животных, получающих антибиотики, указывает на важную роль кишечной микрофлоры в обновлении клеток эпителия (68, 69). ЛПС E. coli способны дозозависимо индуцировать отслоение клеток (70, 71). Модуляция ЛПС-индуцируемого отслоения эпителиальных клеток экзополисахаридами Bifidobacterium breve происходит через MyD88-зависимый сигнальный путь (70).
Активация TLR4, расположенных на мембране стволовых клеток кишечных крипт, бактериальными ЛПС подавляет пролиферацию и индуцирует апоптоз Lgr5+ стволовых клеток кишечника. В ответ на селективную инактивацию TLR4 стволовых клеток кишечника снижается способность ЛПС подавлять обновление клеток эпителия (72). Этот процесс опосредован действием p53-зависимого модулятора апоптоза PUMA, на что указывается сохранение активности TLR4 в отсутствие этого белка. Архитектура кишечных крипт защищает стволовые клетки от негативного влияния других бактериальных метаболитов, например, бутирата, способного, наряду с ЛПС, подавлять клеточную пролиферацию (73). Пробиотические микроорганизмы, в частности Lactobacillus rhamnosus (75–78), Streptococcus thermophilus (79), Lactobacillus reuteri (80) и Bifidobacterium infantis (81) могут влиять на экспрессию белков плотных контактов, служащих основным барьерным механизмом, препятствующим проникновению патогенов через кишечный эпителий.
Механизмы синдрома повышенной эпителиальной проницаемости
Нарушение барьерной функции эпителиальной выстилки кишечника и изменение качественного и количественного состава кишечной микрофлоры в ответ на воздействие неблагоприятных факторов (алкоголь, инфекционные заболевания, диетические факторы) может приводить к транслокации антигенов, патогенных микроорганизмов и их токсинов через эпителий, вызывая системное и местное воспаление.
Влияние диетических факторов на эпителиальную проницаемость
Состав кишечной микробиоты и барьерная функция кишечника зависят от диетических предпочтений человека (82, 83).
Положительное влияние витамина D на функцию слизисто-эпителиального барьера кишечника опосредовано его регуляторным воздействием на экспрессию белков плотных контактов ZO-1 и клаудина-1. Инактивация транскрипции рецепторов витамина D (VDR) приводит к развитию колита (84). С другой стороны, повышение экспрессии VDR повышает активность промотора порообразующего клаудина-2, обеспечивающего параклеточный транспорт, сопряженный с повышением проницаемости плотных контактов (85). Таким образом, роль витамина D и VDR в регуляции кишечной проницаемости до сих пор остается предметом дискуссий.
Диета с низким содержанием пищевых волокон провоцирует рост бактерий, нарушающих целостность слизистой оболочки кишечника, в частности Akkermansia muciniphila и Bacteroides caccae (45), что приводит к снижению толщины слизистого слоя. При этом, транскрипция гена Muc2 повышается, что указывает на активацию компенсаторных механизмов. Снижение барьерных функций и толщины слизистого слоя повышают чувствительность к патогенным бактериям, способных провоцировать колит (45).
Диета, богатая насыщенными жирами и сахарами, вызывает снижение популяции Lactobacillus и рост Oscillibacter, что приводит к повышению проницаемости межклеточного барьера в проксимальных отделах толстого кишечника (86) и снижению экспрессии белка плотных контактов ZO-1.
Влияние стрессорных факторов на эпителиальную проницаемость
Проницаемость слизисто-эпителиального барьера кишечника для патогенных микроорганизмов может нарушаться под влиянием стрессорных факторов, в частности при ожоговых поражениях и длительном употреблении алкоголя.
Повышение эпителиальной проницаемости, ассоциированной с ожоговым шоком, опосредовано увеличением активности киназы легких цепей миозина (MLC) (87, 88), приводящим к изменениям состояния актин-миозиновых комплексов и расширению плотных соединений между клетками кишечного эпителия (89–91). Открытие плотных контактов опосредовано перераспределением и перемещением ZO-1, окклюдина и клаудина-1 внутрь клетки, что при ожогах может быть предотвращено добавлением ингибитора фосфорилирования легких цепей миозина (87). Изменения микробиоценоза в результате ожогового поражения приводят к нарушению естественного гомеостаза кишечной микрофлоры, и, как следствие, увеличению количества и перемещению грамотрицательных аэробных условно-патогенных микроорганизмов, в том числе представителей семейства Enterobacteriaceae (88) через стенку толстого кишечника. Вместе с этим наблюдается снижение популяции аэробных и анаэробных бутират-продуцирующих бактерий (92), которое сопровождается снижением концентрации бутирата в фекалиях мышей с ожоговым поражением. Восстановление качественного и количественного состава микробиоты и функции слизистого барьера в ответ на фекальную трансплантацию подчеркивает непосредственное участие патогенных микроорганизмов в патогенезе повышенной проницаемости кишечника при ожоговых поражениях.
Хроническое употребление алкоголя также приводит к нарушению барьерной функции кишечной стенки, вызывая количественное и качественное нарушение естественного гомеостаза кишечной микробиоты, транслокацию ЛПС и алкогольную болезнь печени (АБП). Повреждение эпителиального барьера кишечника, вызванное систематическим употреблением алкоголя, опосредовано повышением секреции фактора некроза опухоли (ФНО) кишечными моноцитами и макрофагами кишечника, а также увеличением уровня энтероцитов, несущих ФНО-рецепторы типа I, что приводит к угнетению активности киназы легких цепей миозина (93). Воздействие антибиотиков на фоне хронического введения алкоголя мышам приводит к снижению экспрессии ФНО и восстановлению проницаемости кишечной стенки до нормальных значений (93), что подчеркивает роль кишечной микробиоты в патогенезе повышенной проницаемости кишечного эпителия, опосредованной действием ФНО. Систематическое употребление алкоголя сопровождается избыточным ростом популяции патогенных микроорганизмов и снижением количества Lactobacillus (53), хотя точный механизм, опосредующий действие алкоголя на качественный и количественный состав кишечной микробиоты до сих пор неизвестен (94). Применение антибиотиков, наоборот, способно снижать бактериальную нагрузку и уменьшать выраженность симптомов АБП (53, 93, 95–97). Увеличение популяции Lactobacillus способствует снижению роста и транслокации патогенных микроорганизмов и восстановлению целостности слизистой оболочки кишечника (53, 94, 98, 99).
Микробная транслокация, особенно транслокация ЛПС, является одним из ключевых патогенетических механизмов АБП, что подтверждается данными об отсутствии симптомов АБП при инактивации TLR4, в норме экспрессируемых всеми типами печеночных клеток (100, 101). Важно отметить, что эндогенным источником этанола также могут служить некоторые кишечные бактерии, в частности E. coli и Weissella confusa, что может лежать в основе патогенеза нарушения барьерной функции кишечного эпителия (102, 103).
Установлена роль инфекционных агентов в изменении свойств кишечного барьера. Так, например, грамотрицательные бактерии Helicobacter pylori способны напрямую взаимодействовать с белками плотных контактов ZO-1, вызывая повышение проницаемости эпителия (104–106). Помимо бактериальных агентов, продемонстрирована роль бактериофагов, в частности фагов против Salmonella enterica, в нарушении кишечного барьера и патогенезе синдрома повышенной проницаемости кишечника, что, вероятно, также опосредовано негативным влиянием на популяцию нормальной микрофлоры кишечника (107).
Таким образом, нарушение барьерной функции кишечного эпителия и транслокация патогенных микроорганизмов и их метаболитов через кишечную стенку, вызванные изменением состава нормальной микрофлоры, вносят значительный вклад в повышение проницаемости эпителиального барьера, активации иммунного ответа, формированию воспалительных изменении? и повреждению тканей.
Синдром повышенной эпителиальной проницаемости и аутоиммунные заболевания
Дисбиоз, повышение бактериальной транслокации и нарушения барьерной функции кишечника могут быть связаны с некоторыми неинфекционными заболеваниями, включая болезнь Альцгеймера, АБП, онкологические и аутоиммунные заболевания.
Аутоиммунные патологии сопровождаются формированием иммунного ответа на собственные антигены организма, что приводит к повреждению клеток, экспрессирующих аутоантигены. Появляется все больше сведений о роли бактериальной транслокации и дисфункции эпителиального барьера кишечника в патогенезе аутоиммунных заболеваний (2–6).
Сахарный диабет 1 типа
Сахарный диабет 1 типа (СД1) – хроническое заболевание эндокринной системы, связанное с аутоиммунным поражением β-клеток островков Лангерганса поджелудочной железы, обуславливающим снижение продукции и возникновение дефицита инсулина (108). Некоторые исследователи считают, что нарушение проницаемости слизисто-эпителиального барьера является скорее следствием, нежели причиной СД1 (109). Однако гораздо больше данных свидетельствует в пользу обратного.
В исследованиях с участием пациентов с СД1 и на животных моделях продемонстрировано, что нарушения барьерной функции кишечника предшествуют началу заболевания (110–112). Кроме того, установлено, что повышение проницаемости кишечного барьера при СД1 ассоциировано с увеличением уровня зонулина – белка, способного связываться с рецепторами плотных контактов и вызывать увеличение межэпителиальных промежутков. Установлено, что изменение уровня зонулина также происходит под действием факторов кишечной микробиоты (113). Применение ингибиторов зонулина приводит к восстановлению барьерной функции кишечника и облегчению течения заболевания у склонных к диабету мышей (114).
Бактериальная транслокация также может способствовать развитию СД1 (115). В модели стрептозотоцин-индуцированного СД1 введение стрептозотоцина способствовало восстановлению гомеостаза кишечной микробиоты по сравнению с плацебо. Кроме того, продемонстрирована способность кишечных бактерий проникать в региональные лимфатические узлы поджелудочной железы, вызывая активацию NOD2 и развитие симптомов СД1 (115). Введение антибиотиков, наоборот, приводило к элиминации бактерий из ткани поджелудочной железы и снижению проявлений заболевания.
Системная красная волчанка
Системная красная волчанка (СКВ) – хроническое аутоиммунное заболевание, при котором наблюдается продукция аутоиммунных антител к тканям собственного организма, что приводит к хроническому воспалению и повреждению тканей и органов (116). У женщин детородного возраста СКВ встречается в 9 раз чаще, чем у мужчин.
Проникновение ЛПС грамотрицательных бактерий через кишечную стенку и их транслокация в ткани играет важную роль в развитии и прогрессировании СКВ (117). Повышение уровня растворимого бактериального маркера транслокации CD14 у пациентов с СКВ указывает на увеличение циркуляции ЛПС и активацию моноцитов (118).
Бактериальные ЛПС – основной лиганд TLR4. Установлено, что активация этих рецепторов инициирует развитие СКВ (119–121). В ответ на стимуляцию TLR4 у мышей наблюдается спонтанное развитие СКВ, в то время как элиминация комменсальной бактериальной флоры антибиотиками позволяет добиться облегчения симптомов заболевания (121), что свидетельствует о важной роли гиперчувствительности TLR4 к бактериальным ЛПС в патогенезе СКВ.
Введение ЛПС позволяет облегчить течение СКВ у мышей дикого типа (C57BL/6 или BALB/c), иммунизированных фосфолипид-связывающим белком (122–124). Инактивация TLR4, напротив, приводит к снижению уровня аутоантител и концентрации IgG в почечных клубочках мышей, предрасположенных к развитию СКВ (125, 126). Таким образом, активация TLR4 бактериальными ЛПС является фактором, инициирующим развитие СКВ.
Помимо ЛПС вклад в развитие СКВ вносит липотейхоевая кислота (ЛТА), компонент стенки грамположительных бактериальных клеток. Показано, что у пациентов с СКВ увеличена экспрессия TLR2, рецептора ЛТА (127). Кроме того, у мышей, предрасположенных с СКВ, активация TLR2 приводит к развитию волчаночного нефрита, в то время как инактивация этого рецептора облегчает симптомы заболевания (125, 128–130). В последних исследованиях также был обнаружен еще один антиген, способный инициировать продукцию аутоантител в результате антигенной мимикрии (131).
Некоторые белки сигнального каскада TLR, в частности MyD88, IRAKs, and IFNα, участвующие в патогенезе СКВ, могут выступать в качестве потенциальных терапевтических мишеней (132). Облегчение симптомов СКВ у мышей линии MRL/lpr с нокаутом гена MyD88 указывает на важную роль взаимодействия между TLR и патогенной микрофлорой в развитии и прогрессировании СКВ (133, 134).
Рядом исследований продемонстрирована роль nod-подобных рецепторов (NLR), в частности компонентов инфламмасом NLRP3 и AIM2, участвующих в распознавании комменсальных бактерий, в патогенезе СКВ (135–137). У мышей линии NZB обнаружено снижение активности NLRP3- и AIM2-инфламмасом, а у мышей линии B6-Faslpr инактивация адаптерного апоптоз-ассоциированного speck-подобного белка, содержащего CARD (ASC), необходимого для образования инфламмасом, приводила к манифестации СКВ (138).
Таким образом, роль TLR и NLR в патогенезе СКВ опосредована способностью этих рецепторов связываться с антигенами представителей патогенной и комменсальной микрофлоры, соответственно, которые могут проникать через кишечную стенку при повышении проницаемости эпителиального барьера.
Регуляция эпителиальной проницаемости как метод терапии
Вклад нарушений барьерной функции и бактериальной транслокации в индукцию воспаления и патогенез различных заболеваний позволяет рассматривать механизмы проницаемости кишечной стенки в качестве потенциальной терапевтической мишени. Например, пребиотики и пробиотики, в частности комменсальные бактерии Bacteroides fragilis, могут быть успешно применены для снижения проницаемости кишечника и защиты эпителиального барьера (139, 140).
Считается, что терапевтическая роль B. fragilis опосредована способностью бактерии нормализовать состав кишечной микрофлоры и повышать барьерную функцию кишечника (140). Кроме того, полисахарид А, метаболит B. fragilis, индуцирует развитие Foxp3+Т-регуляторных клеток (141, 142). B. fragilis и полисахарид А также продемонстрировали высокую эффективность при некоторых воспалительных заболеваниях, включая колит и экспериментальный аутоиммунный энцефаломиелит (141, 143). Тем не менее, для широкого применения B. fragilis в предотвращении и лечении синдрома повышенной эпителиальной проницаемости требуется больше исследований. Поскольку пробиотики в большинстве случаев обладают хорошим профилем безопасности, можно ожидать, что в будущем они будут более широко применяться в терапии аутоиммунных заболеваний.
Литература
1. Peterson LW, Artis D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol (2014) 14(3):141–53. doi: 10.1038/nri3608
2. Lin R, Zhou L, Zhang J, Wang B. Abnormal intestinal permeability and microbiota in patients with autoimmune hepatitis. Int J Clin Exp Pathol (2015) 8(5):5153–60.
3. Khaleghi S, Ju JM, Lamba A, Murray JA. The potential utility of tight junction regulation in celiac disease: focus on larazotide acetate. Therap Adv Gastroenterol (2016) 9(1):37–49. doi:10.1177/1756283X15616576
4. Fasano A, Shea-Donohue T. Mechanisms of disease: the role of intestinal barrier function in the pathogenesis of gastrointestinal autoimmune diseases. Nat Clin Pract Gastroenterol Hepatol (2005) 2(9):416–22. doi:10.1038/ncpgasthep0259
5. Tlaskalova-Hogenova H, Stepankova R, Kozakova H, Hudcovic T, Vannucci L, Tuckova L, et al. The role of gut microbiota (commensal bacteria) and the mucosal barrier in the pathogenesis of inflammatory and autoimmune diseases and cancer: contribution of germ-free and gnotobiotic animal models of human diseases. Cell Mol Immunol (2011) 8(2):110–20. doi:10.1038/cmi.2010.67
6. Fasano A. Zonulin, regulation of tight junctions, and autoimmune diseases. Ann N Y Acad Sci (2012) 1258:25–33. doi:10.1111/j.1749-6632.2012.06538.x
7. Jiminez JA, Uwiera TC, Douglas Inglis G, Uwiera RR. Animal models to study acute and chronic intestinal inflammation in mammals. Gut Pathog (2015) 7:29. doi:10.1186/s13099-015-0076-y
8. Brugman S. The zebrafish as a model to study intestinal inflammation. Dev Comp Immunol (2016) 64:82–92. doi:10.1016/j.dci.2016.02.020
9. Hooper LV, Littman DR, Macpherson AJ. Interactions between the microbiota and the immune system. Science (2012) 336(6086):1268–73. doi:10.1126/science.1223490
10. Gerbe F, Legraverend C, Jay P. The intestinal epithelium tuft cells: specification and function. Cell Mol Life Sci (2012) 69(17):2907–17. doi:10.1007/s00018-012-0984-7
11. Vaishnava S, Yamamoto M, Severson KM, Ruhn KA, Yu X, Koren O, et al. The antibacterial lectin RegIIIgamma promotes the spatial segregation of microbiota and host in the intestine. Science (2011) 334(6053):255–8. doi:10.1126/science.1209791
12. Cash HL, Whitham CV, Behrendt CL, Hooper LV. Symbiotic bacteria direct expression of an intestinal bactericidal lectin. Science (2006) 313(5790):1126–30. doi:10.1126/science.1127119
13. Vaishnava S, Behrendt CL, Ismail AS, Eckmann L, Hooper LV. Paneth cells directly sense gut commensals and maintain homeostasis at the intestinal host-microbial interface. Proc Natl Acad Sci U S A (2008) 105(52):20858–63. doi:10.1073/pnas.0808723105
14. Mabbott NA, Donaldson DS, Ohno H, Williams IR, Mahajan A. Microfold (M) cells: important immunosurveillance posts in the intestinal epithelium. Mucosal Immunol (2013) 6(4):666–77. doi:10.1038/mi.2013.30
15. van der Flier LG, Clevers H. Stem cells, self-renewal, and differentiation in the intestinal epithelium. Annu Rev Physiol (2009) 71:241–60. doi:10.1146/annurev.physiol.010908.163145
16. Anderson JM, Van Itallie CM. Physiology and function of the tight junction. Cold Spring Harb Perspect Biol (2009) 1(2):a002584. doi:10.1101/cshperspect.a002584
17. Yamazaki Y, Okawa K, Yano T, Tsukita S, Tsukita S. Optimized proteomic analysis on gels of cell-cell adhering junctional membrane proteins. Biochemistry (2008) 47(19):5378–86. doi:10.1021/bi8002567
18. Singh PK, Parsek MR, Greenberg EP, Welsh MJ. A component of innate immunity prevents bacterial biofilm development. Nature (2002) 417(6888):552–5. doi:10.1038/417552a
19. Hansson GC. Role of mucus layers in gut infection and inflammation. Curr Opin Microbiol (2012) 15(1):57–62. doi:10.1016/j.mib.2011.11.002
20. Pelaseyed T, Bergstrom JH, Gustafsson JK, Ermund A, Birchenough GM, Schutte A, et al. The mucus and mucins of the goblet cells and enterocytes provide the first defense line of the gastrointestinal tract and interact with the immune system. Immunol Rev (2014) 260(1):8–20. doi:10.1111/imr.12182
21. Van der Sluis M, De Koning BA, De Bruijn AC, Velcich A, Meijerink JP, Van Goudoever JB, et al. Muc2-deficient mice spontaneously develop colitis, indicating that MUC2 is critical for colonic protection. Gastroenterology (2006) 131(1):117–29. doi:10.1053/j.gastro.2006.04.020
22. Sekirov I, Russell SL, Antunes LC, Finlay BB. Gut microbiota in health and disease. Physiol Rev (2010) 90(3):859–904. doi:10.1152/physrev.00045.2009
23. Baumler AJ, Sperandio V. Interactions between the microbiota and pathogenic bacteria in the gut. Nature (2016) 535(7610):85–93. doi:10.1038/nature18849
24. Ming L, Zhang Q, Yang L, Huang JA. Comparison of antibacterial effects between antimicrobial peptide and bacteriocins isolated from Lactobacillus plantarum on three common pathogenic bacteria. Int J Clin Exp Med (2015) 8(4):5806–11.
25. Ramakrishna BS. Role of the gut microbiota in human nutrition and metabolism. J Gastroenterol Hepatol (2013) 28(Suppl 4):9–17. doi:10.1111/jgh.12294
26. Krajmalnik-Brown R, Ilhan ZE, Kang DW, DiBaise JK. Effects of gut microbes on nutrient absorption and energy regulation. Nutr Clin Pract (2012) 27(2):201–14. doi:10.1177/0884533611436116
27. Dupont A, Heinbockel L, Brandenburg K, Hornef MW. Antimicrobial peptides and the enteric mucus layer act in concert to protect the intestinal mucosa. Gut Microbes (2014) 5(6):761–5. doi:10.4161/19490976.2014.972238
28. Mukherjee S, Hooper LV. Antimicrobial defense of the intestine. Immunity (2015) 42(1):28–39. doi:10.1016/j.immuni.2014.12.028
29. Hofmann AF, Eckmann L. How bile acids confer gut mucosal protection against bacteria. Proc Natl Acad Sci U S A (2006) 103(12):4333–4. doi:10.1073/pnas.0600780103
30. Ostaff MJ, Stange EF, Wehkamp J. Antimicrobial peptides and gut microbiota in homeostasis and pathology. EMBO Mol Med (2013) 5(10):1465–83. doi:10.1002/emmm.201201773
31. Kopp ZA, Jain U, Van Limbergen J, Stadnyk AW. Do antimicrobial peptides and complement collaborate in the intestinal mucosa? Front Immunol (2015) 6:17. doi:10.3389/fimmu.2015.00017
32. Howe SE, Lickteig DJ, Plunkett KN, Ryerse JS, Konjufca V. The uptake of soluble and particulate antigens by epithelial cells in the mouse small intestine. PLoS One (2014) 9(1):e86656. doi:10.1371/journal.pone.0086656
33. McDole JR, Wheeler LW, McDonald KG, Wang B, Konjufca V, Knoop KA, et al. Goblet cells deliver luminal antigen to CD103+ dendritic cells in the small intestine. Nature (2012) 483(7389):345–9. doi:10.1038/nature10863
34. Knoop KA, McDonald KG, McCrate S, McDole JR, Newberry RD. Microbial sensing by goblet cells controls immune surveillance of luminal antigens in the colon. Mucosal Immunol (2015) 8(1):198–210. doi:10.1038/mi.2014.58
35. Birchenough GM, Johansson ME, Gustafsson JK, Bergstrom JH, Hansson GC. New developments in goblet cell mucus secretion and function. Mucosal Immunol (2015) 8(4):712–9. doi:10.1038/mi.2015.32
36. Knoop KA, McDonald KG, Kulkarni DH, Newberry RD. Antibiotics promote inflammation through the translocation of native commensal colonic bacteria. Gut (2016) 65(7):1100–9. doi:10.1136/gutjnl-2014-309059
37. Rescigno M, Urbano M, Valzasina B, Francolini M, Rotta G, Bonasio R, et al. Dendritic cells express tight junction proteins and penetrate gut epithelial monolayers to sample bacteria. Nat Immunol (2001) 2(4):361–7. doi:10.1038/86373
38. Vallon-Eberhard A, Landsman L, Yogev N, Verrier B, Jung S. Transepithelial pathogen uptake into the small intestinal lamina propria. J Immunol (2006) 176(4):2465–9. doi:10.4049/jimmunol.176.4.2465
39. Diehl GE, Longman RS, Zhang JX, Breart B, Galan C, Cuesta A, et al. Microbiota restricts trafficking of bacteria to mesenteric lymph nodes by CX(3)CR1(hi) cells. Nature (2013) 494(7435):116–20. doi:10.1038/nature11809
40. Niess JH, Brand S, Gu X, Landsman L, Jung S, McCormick BA, et al. CX3CR1-mediated dendritic cell access to the intestinal lumen and bacterial clearance. Science (2005) 307(5707):254–8. doi:10.1126/science.1102901
41. Gross M, Salame TM, Jung S. Guardians of the gut – murine intestinal macrophages and dendritic cells. Front Immunol (2015) 6:254. doi:10.3389/fimmu.2015.00254
42. Kim KW, Vallon-Eberhard A, Zigmond E, Farache J, Shezen E, Shakhar G, et al. In vivo structure/function and expression analysis of the CX3C chemokine fractalkine. Blood (2011) 118(22):e156–67. doi:10.1182/blood-2011-04-348946
43. Woof JM, Russell MW. Structure and function relationships in IgA. Mucosal Immunol (2011) 4(6):590–7. doi:10.1038/mi.2011.39
44. Brenchley JM, Douek DC. Microbial translocation across the GI tract. Annu Rev Immunol (2012) 30:149–73. doi:10.1146/annurev-immunol-020711-075001
45. Desai MS, Seekatz AM, Koropatkin NM, Kamada N, Hickey CA, Wolter M, et al. A dietary fiber-deprived gut microbiota degrades the colonic mucus barrier and enhances pathogen susceptibility. Cell (2016) 167(5):1339–53 e21. doi:10.1016/j.cell.2016.10.043
46. Johansson ME, Jakobsson HE, Holmen-Larsson J, Schutte A, Ermund A, Rodriguez-Pineiro AM, et al. Normalization of host intestinal mucus layers requires long-term microbial colonization. Cell Host Microbe (2015) 18(5):582–92. doi:10.1016/j.chom.2015.10.007
47. Petersson J, Schreiber O, Hansson GC, Gendler SJ, Velcich A, Lundberg JO, et al. Importance and regulation of the colonic mucus barrier in a mouse model of colitis. Am J Physiol Gastrointest Liver Physiol (2011) 300(2):G327–33. doi:10.1152/ajpgi.00422.2010
48. Wrzosek L, Miquel S, Noordine ML, Bouet S, Joncquel Chevalier-Curt M, Robert V, et al. Bacteroides thetaiotaomicron and Faecalibacterium prausnitzii influence the production of mucus glycans and the development of goblet cells in the colonic epithelium of a gnotobiotic model rodent. BMC Biol (2013) 11:61. doi:10.1186/1741-7007-11-61
49. Forder RE, Howarth GS, Tivey DR, Hughes RJ. Bacterial modulation of small intestinal goblet cells and mucin composition during early posthatch development of poultry. Poult Sci (2007) 86(11):2396–403. doi:10.3382/ps.2007-00222
50. Wlodarska M, Willing B, Keeney KM, Menendez A, Bergstrom KS, Gill N, et al. Antibiotic treatment alters the colonic mucus layer and predisposes the host to exacerbated Citrobacter rodentium-induced colitis. Infect Immun (2011) 79(4):1536–45. doi:10.1128/IAI.01104-10
51. Johansson ME, Gustafsson JK, Sjoberg KE, Petersson J, Holm L, Sjovall H, et al. Bacteria penetrate the inner mucus layer before inflammation in the dextran sulfate colitis model. PLoS One (2010) 5(8):e12238. doi:10.1371/journal.pone.0012238
52. Wang L, Fouts DE, Starkel P, Hartmann P, Chen P, Llorente C, et al. Intestinal REG3 lectins protect against alcoholic steatohepatitis by reducing mucosa-associated microbiota and preventing bacterial translocation. Cell Host Microbe (2016) 19(2):227–39. doi:10.1016/j.chom.2016.01.003
53. Yan AW, Fouts DE, Brandl J, Starkel P, Torralba M, Schott E, et al. Enteric dysbiosis associated with a mouse model of alcoholic liver disease. Hepatology (2011) 53(1):96–105. doi:10.1002/hep.24018
54. Hooper LV, Stappenbeck TS, Hong CV, Gordon JI. Angiogenins: a new class of microbicidal proteins involved in innate immunity. Nat Immunol (2003) 4(3):269–73. doi:10.1038/ni888
55. Eliakim R, Mahmood A, Alpers DH. Rat intestinal alkaline phosphatase secretion into lumen and serum is coordinately regulated. Biochim Biophys Acta (1991) 1091(1):1–8. doi:10.1016/0167-4889(91)90213-H
56. Nakano T, Inoue I, Alpers DH, Akiba Y, Katayama S, Shinozaki R, et al. Role of lysophosphatidylcholine in brush-border intestinal alkaline phosphatase release and restoration. Am J Physiol Gastrointest Liver Physiol (2009) 297(1):G207–14. doi:10.1152/ajpgi.90590.2008
57. Malo MS, Alam SN, Mostafa G, Zeller SJ, Johnson PV, Mohammad N, et al. Intestinal alkaline phosphatase preserves the normal homeostasis of gut microbiota. Gut (2010) 59(11):1476–84. doi:10.1136/gut.2010.211706
58. Manichanh C, Rigottier-Gois L, Bonnaud E, Gloux K, Pelletier E, Frangeul L, et al. Reduced diversity of faecal microbiota in Crohn’s disease revealed by a metagenomic approach. Gut (2006) 55(2):205–11. doi:10.1136/gut.2005.073817
59. Kaliannan K, Wang B, Li XY, Kim KJ, Kang JX. A host-microbiome interaction mediates the opposing effects of omega-6 and omega-3 fatty acids on metabolic endotoxemia. Sci Rep (2015) 5:11276. doi:10.1038/srep11276
60. Bates JM, Akerlund J, Mittge E, Guillemin K. Intestinal alkaline phosphatase detoxifies lipopolysaccharide and prevents inflammation in zebrafish in response to the gut microbiota. Cell Host Microbe (2007) 2(6):371–82. doi:10.1016/j.chom.2007.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
61. Yang Y, Millan JL, Mecsas J, Guillemin K. Intestinal alkaline phosphatase deficiency leads to lipopolysaccharide desensitization and faster weight gain. Infect Immun (2015) 83(1):247–58. doi:10.1128/IAI.02520-14
62. Bates JM, Mittge E, Kuhlman J, Baden KN, Cheesman SE, Guillemin K. Distinct signals from the microbiota promote different aspects of zebrafish gut differentiation. Dev Biol (2006) 297(2):374–86. doi:10.1016/j.ydbio.2006.05.006
63. Liu W, Hu D, Huo H, Zhang W, Adiliaghdam F, Morrison S, et al. Intestinal alkaline phosphatase regulates tight junction protein levels. J Am Coll Surg (2016) 222(6):1009–17. doi:10.1016/j.jamcollsurg.2015.12.006
64. Bevins CL, Salzman NH. Paneth cells, antimicrobial peptides and maintenance of intestinal homeostasis. Nat Rev Microbiol (2011) 9(5):356–68. doi:10.1038/nrmicro2546
65. Gallo RL, Hooper LV. Epithelial antimicrobial defence of the skin and intestine. Nat Rev Immunol (2012) 12(7):503–16. doi:10.1038/nri3228
66. Williams JM, Duckworth CA, Burkitt MD, Watson AJ, Campbell BJ, Pritchard DM. Epithelial cell shedding and barrier function: a matter of life and death at the small intestinal villus tip. Vet Pathol (2015) 52(3):445–55. doi:10.1177/0300985814559404
67. Sommer F, Nookaew I, Sommer N, Fogelstrand P, Backhed F. Site-specific programming of the host epithelial transcriptome by the gut microbiota. Genome Biol (2015) 16:62. doi:10.1186/s13059-015-0614-4
68. Reikvam DH, Erofeev A, Sandvik A, Grcic V, Jahnsen FL, Gaustad P, et al. Depletion of murine intestinal microbiota: effects on gut mucosa and epithelial gene expression. PLoS One (2011) 6(3):e17996. doi:10.1371/journal.pone.0017996
69. Stedman A, Nigro G, Sansonetti PJ. [Microbiota-intestinal stem cells dialog: a key element for intestinal regeneration]. Med Sci (Paris) (2016) 32(11):983–90. doi:10.1051/medsci/20163211014
70. Hughes KR, Harnisch LC, Alcon-Giner C, Mitra S, Wright CJ, Ketskemety J, et al. Bifidobacterium breve reduces apoptotic epithelial cell shedding in an exopolysaccharide and MyD88-dependent manner. Open Biol (2017) 7(1):160155. doi:10.1098/rsob.160155
71. Williams JM, Duckworth CA, Watson AJ, Frey MR, Miguel JC, Burkitt MD, et al. A mouse model of pathological small intestinal epithelial cell apoptosis and shedding induced by systemic administration of lipopolysaccharide. Dis Model Mech (2013) 6(6):1388–99. doi:10.1242/dmm.013284
72. Neal MD, Sodhi CP, Jia H, Dyer M, Egan CE, Yazji I, et al. Toll-like receptor 4 is expressed on intestinal stem cells and regulates their proliferation and apoptosis via the p53 up-regulated modulator of apoptosis. J Biol Chem (2012) 287(44):37296–308. doi:10.1074/jbc.M112.375881
73. Kaiko GE, Ryu SH, Koues OI, Collins PL, Solnica-Krezel L, Pearce EJ, et al. The colonic crypt protects stem cells from microbiota-derived metabolites. Cell (2016) 167(4):1137. doi:10.1016/j.cell.2016.10.034
74. Ulluwishewa D, Anderson RC, McNabb WC, Moughan PJ, Wells JM, Roy NC. Regulation of tight junction permeability by intestinal bacteria and dietary components. J Nutr (2011) 141(5):769–76. doi:10.3945/jn.110.135657
75. Donato KA, Gareau MG, Wang YJ, Sherman PM. Lactobacillus rhamnosus GG attenuates interferon-
76. Johnson-Henry KC, Donato KA, Shen-Tu G, Gordanpour M, Sherman PM. Lactobacillus rhamnosus strain GG prevents enterohemorrhagic Escherichia coli O157: H7-induced changes in epithelial barrier function. Infect Immun (2008) 76(4):1340–8. doi:10.1128/IAI.00778-07
77. Miyauchi E, Morita H, Tanabe S. Lactobacillus rhamnosus alleviates intestinal barrier dysfunction in part by increasing expression of zonula occludens-1 and myosin light-chain kinase in vivo. J Dairy Sci (2009) 92(6):2400–8. doi:10.3168/jds.2008-1698
78. Seth A, Yan F, Polk DB, Rao RK. Probiotics ameliorate the hydrogen peroxide-induced epithelial barrier disruption by a PKC- and MAP kinase-dependent mechanism. Am J Physiol Gastrointest Liver Physiol (2008) 294(4):G1060–9. doi:10.1152/ajpgi.00202.2007
79. Resta-Lenert S, Barrett KE. Live probiotics protect intestinal epithelial cells from the effects of infection with enteroinvasive Escherichia coli (EIEC). Gut (2003) 52(7):988–97. doi:10.1136/gut.52.7.988
80. Ewaschuk JB, Diaz H, Meddings L, Diederichs B, Dmytrash A, Backer J, et al. Secreted bioactive factors from Bifidobacterium infantis enhance epithelial cell barrier function. Am J Physiol Gastrointest Liver Physiol (2008) 295(5):G1025–34. doi:10.1152/ajpgi.90227.2008
81. Ahrne S, Hagslatt ML. Effect of lactobacilli on paracellular permeability in the gut. Nutrients (2011) 3(1):104–17. doi:10.3390/nu3010104
82. Suzuki T. Regulation of intestinal epithelial permeability by tight junctions. Cell Mol Life Sci (2013) 70(4):631–59. doi:10.1007/s00018-012-1070-x
83. De Santis S, Cavalcanti E, Mastronardi M, Jirillo E, Chieppa M. Nutritional keys for intestinal barrier modulation. Front Immunol (2015) 6:612. doi:10.3389/fimmu.2015.00612
84. Kong J, Zhang Z, Musch MW, Ning G, Sun J, Hart J, et al. Novel role of the vitamin D receptor in maintaining the integrity of the intestinal mucosal barrier. Am J Physiol Gastrointest Liver Physiol (2008) 294(1):G208–16. doi:10.1152/ajpgi.00398.2007
85. Zhang YG, Wu S, Lu R, Zhou D, Zhou J, Carmeliet G, et al. Tight junction CLDN2 gene is a direct target of the vitamin D receptor. Sci Rep (2015) 5:10642. doi:10.1038/srep10642
86. Lam YY, Ha CW, Campbell CR, Mitchell AJ, Dinudom A, Oscarsson J, et al. Increased gut permeability and microbiota change associate with mesenteric fat inflammation and metabolic dysfunction in diet-induced obese mice. PLoS One (2012) 7(3):e34233. doi:10.1371/journal.pone.0034233
87. Chen C, Wang P, Su Q, Wang S, Wang F. Myosin light chain kinase mediates intestinal barrier disruption following burn injury. PLoS One (2012) 7(4):e34946. doi:10.1371/journal.pone.0034946
88. Earley ZM, Akhtar S, Green SJ, Naqib A, Khan O, Cannon AR, et al. Burn injury alters the intestinal microbiome and increases gut permeability and bacterial translocation. PLoS One (2015) 10(7):e0129996. doi:10.1371/journal.pone.0129996
89. Turner JR. Molecular basis of epithelial barrier regulation: from basic mechanisms to clinical application. Am J Pathol (2006) 169(6):1901–9. doi:10.2353/ajpath.2006.060681
90. Turner JR. Intestinal mucosal barrier function in health and disease. Nat Rev Immunol (2009) 9(11):799–809. doi:10.1038/nri2653
91. Cunningham KE, Turner JR. Myosin light chain kinase: pulling the strings of epithelial tight junction function. Ann N Y Acad Sci (2012) 1258:34–42. doi:10.1111/j.1749-6632.2012.06526.x
92. Kuethe JW, Armocida SM, Midura EF, Rice TC, Hildeman DA, Healy DP, et al. Fecal microbiota transplant restores mucosal integrity in a murine model of burn injury. Shock (2016) 45(6):647–52. doi:10.1097/SHK.0000000000000551
93. Chen P, Starkel P, Turner JR, Ho SB, Schnabl B. Dysbiosis-induced intestinal inflammation activates tumor necrosis factor receptor I and mediates alcoholic liver disease in mice. Hepatology (2015) 61(3):883–94. doi:10.1002/hep.27489
94. Chen P, Torralba M, Tan J, Embree M, Zengler K, Starkel P, et al. Supplementation of saturated long-chain fatty acids maintains intestinal eubiosis and reduces ethanol-induced liver injury in mice. Gastroenterology (2015) 148(1):203–14 e16. doi:10.1053/j.gastro.2014.09.014
95. Adachi Y, Moore LE, Bradford BU, Gao W, Thurman RG. Antibiotics prevent liver injury in rats following long-term exposure to ethanol. Gastroenterology (1995) 108(1):218–24. doi:10.1016/0016-5085(95)90027-6
96. Casafont Morencos F, de las Heras Castano G, Martin Ramos L, Lopez Arias MJ, Ledesma F, Pons Romero F. Small bowel bacterial overgrowth in patients with alcoholic cirrhosis. Dig Dis Sci (1996) 41(3):552–6. doi:10.1007/BF02282340
97. Mutlu EA, Gillevet PM, Rangwala H, Sikaroodi M, Naqvi A, Engen PA, et al. Colonic microbiome is altered in alcoholism. Am J Physiol Gastrointest Liver Physiol (2012) 302(9):G966–78. doi:10.1152/ajpgi.00380.2011
98. Forsyth CB, Farhadi A, Jakate SM, Tang Y, Shaikh M, Keshavarzian A. Lactobacillus GG treatment ameliorates alcohol-induced intestinal oxidative stress, gut leakiness, and liver injury in a rat model of alcoholic steatohepatitis. Alcohol (2009) 43(2):163–72. doi:10.1016/j.alcohol.2008.12.009
99. Wang Y, Kirpich I, Liu Y, Ma Z, Barve S, McClain CJ, et al. Lactobacillus rhamnosus GG treatment potentiates intestinal hypoxia-inducible factor, promotes intestinal integrity and ameliorates alcohol-induced liver injury. Am J Pathol (2011) 179(6):2866–75. doi:10.1016/j.ajpath.2011.08.039
100. Parlesak A, Schafer C, Schutz T, Bode JC, Bode C. Increased intestinal permeability to macromolecules and endotoxemia in patients with chronic alcohol abuse in different stages of alcohol-induced liver disease. J Hepatol (2000) 32(5):742–7. doi:10.1016/S0168-8278(00)80242-1
101. Uesugi T, Froh M, Arteel GE, Bradford BU, Thurman RG. Toll-like receptor 4 is involved in the mechanism of early alcohol-induced liver injury in mice. Hepatology (2001) 34(1):101–8. doi:10.1053/jhep.2001.25350
102. Elshaghabee FM, Bockelmann W, Meske D, de Vrese M, Walte HG, Schrezenmeir J, et al. Ethanol production by selected intestinal microorganisms and lactic acid bacteria growing under different nutritional conditions. Front Microbiol (2016) 7:47. doi:10.3389/fmicb.2016.00047
103. Tyler AD, Knox N, Kabakchiev B, Milgrom R, Kirsch R, Cohen Z, et al. Characterization of the gut-associated microbiome in inflammatory pouch complications following ileal pouch-anal anastomosis. PLoS One (2013) 8(9):e66934. doi:10.1371/journal.pone.0066934
104. Yu QH, Yang Q. Diversity of tight junctions (TJs) between gastrointestinal epithelial cells and their function in maintaining the mucosal barrier. Cell Biol Int (2009) 33(1):78–82. doi:10.1016/j.cellbi.2008.09.007
105. Amieva MR, Vogelmann R, Covacci A, Tompkins LS, Nelson WJ, Falkow S. Disruption of the epithelial apical-junctional complex by Helicobacter pylori CagA. Science (2003) 300(5624):1430–4. doi:10.1126/science.1081919
106. Fedwick JP, Lapointe TK, Meddings JB, Sherman PM, Buret AG. Helicobacter pylori activates myosin light-chain kinase to disrupt claudin-4 and claudin-5 and increase epithelial permeability. Infect Immun (2005) 73(12):7844–52. doi:10.1128/IAI.73.12.7844-7852.2005
107. Tetz G, Tetz V. Bacteriophage infections of microbiota can lead to leaky gut in an experimental rodent model. Gut Pathog (2016) 8:33. doi:10.1186/s13099-016-0109-1
108. Kawasaki E. Type 1 diabetes and autoimmunity. Clin Pediatr Endocrinol (2014) 23(4):99–105. doi:10.1297/cpe.23.99
109. Odenwald MA, Turner JR. Intestinal permeability defects: is it time to treat? Clin Gastroenterol Hepatol (2013) 11(9):1075–83. doi:10.1016/j.cgh.2013.07.001
110. Damci T, Nuhoglu I, Devranoglu G, Osar Z, Demir M, Ilkova H. Increased intestinal permeability as a cause of fluctuating postprandial blood glucose levels in type 1 diabetic patients. Eur J Clin Invest (2003) 33(5):397–401. doi:10.1046/j.1365-2362.2003.01161.x
111. Meddings JB, Jarand J, Urbanski SJ, Hardin J, Gall DG. Increased gastrointestinal permeability is an early lesion in the spontaneously diabetic BB rat. Am J Physiol (1999) 276(4 Pt 1):G951–7.
112. Secondulfo M, Iafusco D, Carratu R, deMagistris L, Sapone A, Generoso M, et al. Ultrastructural mucosal alterations and increased intestinal permeability in non-celiac, type I diabetic patients. Dig Liver Dis (2004) 36(1):35–45. doi:10.1016/j.dld.2003.09.016
113. El Asmar R, Panigrahi P, Bamford P, Berti I, Not T, Coppa GV, et al. Host-dependent zonulin secretion causes the impairment of the small intestine barrier function after bacterial exposure. Gastroenterology (2002) 123(5):1607–15. doi:10.1053/gast.2002.36578
114. Watts T, Berti I, Sapone A, Gerarduzzi T, Not T, Zielke R, et al. Role of the intestinal tight junction modulator zonulin in the pathogenesis of type I diabetes in BB diabetic-prone rats. Proc Natl Acad Sci U S A (2005) 102(8):2916–21. doi:10.1073/pnas.0500178102
115. Costa FR, Francozo MC, de Oliveira GG, Ignacio A, Castoldi A, Zamboni DS, et al. Gut microbiota translocation to the pancreatic lymph nodes triggers NOD2 activation and contributes to T1D onset. J Exp Med (2016) 213(7):1223–39. doi:10.1084/jem.20150744
116. Tsokos GC. Systemic lupus erythematosus. N Engl J Med (2011) 365(22):2110–21. doi:10.1056/NEJMra1100359
117. Mu Q, Zhang H, Luo XM. SLE: another autoimmune disorder influenced by microbes and diet? Front Immunol (2015) 6:608. doi:10.3389/fimmu.2015.00608
118. Nockher WA, Wigand R, Schoeppe W, Scherberich JE. Elevated levels of soluble CD14 in serum of patients with systemic lupus erythematosus. Clin Exp Immunol (1994) 96(1):15–9. doi:10.1111/j.1365-2249.1994.tb06222.x
119. Lee TP, Huang JC, Liu CJ, Chen HJ, Chen YH, Tsai YT, et al. Interactions of surface-expressed TLR-4 and endosomal TLR-9 accelerate lupus progression in anti-dsDNA antibody transgenic mice. Exp Biol Med (Maywood) (2014) 239(6):715–23. doi:10.1177/1535370214525299
120. Lee TP, Tang SJ, Wu MF, Song YC, Yu CL, Sun KH. Transgenic overexpression of anti-double-stranded DNA autoantibody and activation of Toll-like receptor 4 in mice induce severe systemic lupus erythematosus syndromes. J Autoimmun (2010) 35(4):358–67. doi:10.1016/j.jaut.2010.07.007
121. Liu B, Yang Y, Dai J, Medzhitov R, Freudenberg MA, Zhang PL, et al. TLR4 up-regulation at protein or gene level is pathogenic for lupus-like autoimmune disease. J Immunol (2006) 177(10):6880–8. doi:10.4049/jimmunol.177.10.6880
122. Levine JS, Subang R, Nasr SH, Fournier S, Lajoie G, Wither J, et al. Immunization with an apoptotic cell-binding protein recapitulates the nephritis and sequential autoantibody emergence of systemic lupus erythematosus. J Immunol (2006) 177(9):6504–16. doi:10.4049/jimmunol.177.9.6504
123. Levine JS, Subang R, Setty S, Cabrera J, Laplante P, Fritzler MJ, et al. Phospholipid-binding proteins differ in their capacity to induce autoantibodies and murine systemic lupus erythematosus. Lupus (2014) 23(8):752–68. doi:10.1177/0961203314525676
124. Tolomeo T, Rico De Souza A, Roter E, Dieude M, Amireault P, Subang R, et al. T cells demonstrate a Th1-biased response to native beta2-glycoprotein I in a murine model of anti-phospholipid antibody induction. Autoimmunity (2009) 42(4):292–5. doi:10.1080/08916930902828254
125. Lartigue A, Colliou N, Calbo S, Francois A, Jacquot S, Arnoult C, et al. Critical role of TLR2 and TLR4 in autoantibody production and glomerulonephritis in lpr mutation-induced mouse lupus. J Immunol (2009) 183(10):6207–16. doi:10.4049/jimmunol.0803219
126. Summers SA, Hoi A, Steinmetz OM, O’Sullivan KM, Ooi JD, Odobasic D, et al. TLR9 and TLR4 are required for the development of autoimmunity and lupus nephritis in pristane nephropathy. J Autoimmun (2010) 35(4):291–8. doi:10.1016/j.jaut.2010.05.004
127. Liu Y, Liao J, Zhao M, Wu H, Yung S, Chan TM, et al. Increased expression of TLR2 in CD4(+) T cells from SLE patients enhances immune reactivity and promotes IL-17 expression through histone modifications. Eur J Immunol (2015) 45(9):2683–93. doi:10.1002/eji.201445219
128. Leiss H, Niederreiter B, Bandur T, Schwarzecker B, Bluml S, Steiner G, et al. Pristane-induced lupus as a model of human lupus arthritis: evolvement of autoantibodies, internal organ and joint inflammation. Lupus (2013) 22(8):778–92. doi:10.1177/0961203313492869
129. Pawar RD, Castrezana-Lopez L, Allam R, Kulkarni OP, Segerer S, Radomska E, et al. Bacterial lipopeptide triggers massive albuminuria in murine lupus nephritis by activating toll-like receptor 2 at the glomerular filtration barrier. Immunology (2009) 128(1 Suppl):e206–21. doi:10.1111/j.1365-2567.2008.02948.x
130. Urbonaviciute V, Starke C, Pirschel W, Pohle S, Frey S, Daniel C, et al. Toll-like receptor 2 is required for autoantibody production and development of renal disease in pristane-induced lupus. Arthritis Rheum (2013) 65(6):1612–23. doi:10.1002/art.37914
131. Gallo PM, Rapsinski GJ, Wilson RP, Oppong GO, Sriram U, Goulian M, et al. Amyloid-DNA composites of bacterial biofilms stimulate autoimmunity. Immunity (2015) 42(6):1171–84. doi:10.1016/j.immuni.2015.06.002
132. Wu YW, Tang W, Zuo JP. Toll-like receptors: potential targets for lupus treatment. Acta Pharmacol Sin (2015) 36(12):1395–407. doi:10.1038/aps.2015.91
133. Teichmann LL, Schenten D, Medzhitov R, Kashgarian M, Shlomchik MJ. Signals via the adaptor MyD88 in B cells and DCs make distinct and synergistic contributions to immune activation and tissue damage in lupus. Immunity (2013) 38(3):528–40. doi:10.1016/j.immuni.2012.11.017
134. Nickerson KM, Christensen SR, Shupe J, Kashgarian M, Kim D, Elkon K, et al. TLR9 regulates TLR7- and MyD88-dependent autoantibody production and disease in a murine model of lupus. J Immunol (2010) 184(4):1840–8. doi:10.4049/jimmunol.0902592
135. Karki R, Man SM, Kanneganti TD. Inflammasomes and cancer. Cancer Immunol Res (2017) 5(2):94–9. doi:10.1158/2326-6066.CIR-16-0269
136. Karki R, Man SM, Malireddi RK, Kesavardhana S, Zhu Q, Burton AR, et al. NLRC3 is an inhibitory sensor of PI3K-mTOR pathways in cancer. Nature (2016) 540:583–87. doi:10.1038/nature20597
137. Sester DP, Sagulenko V, Thygesen SJ, Cridland JA, Loi YS, Cridland SO, et al. Deficient NLRP3 and AIM2 inflammasome function in autoimmune NZB mice. J Immunol (2015) 195(3):1233–41. doi:10.4049/jimmunol.1402859
138. Lech M, Lorenz G, Kulkarni OP, Grosser MO, Stigrot N, Darisipudi MN, et al. NLRP3 and ASC suppress lupus-like autoimmunity by driving the immunosuppressive effects of TGF-beta receptor signalling. Ann Rheum Dis (2015) 74(12):2224–35. doi:10.1136/annrheumdis-2014-205496
139. Lamprecht M, Bogner S, Schippinger G, Steinbauer K, Fankhauser F, Hallstroem S, et al. Probiotic supplementation affects markers of intestinal barrier, oxidation, and inflammation in trained men; a randomized, double-blinded, placebo-controlled trial. J Int Soc Sports Nutr (2012) 9(1):45. doi:10.1186/1550-2783-9-45
140. Hsiao EY, McBride SW, Hsien S, Sharon G, Hyde ER, McCue T, et al. Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders. Cell (2013) 155(7):1451–63. doi:10.1016/j.cell.2013.11.024
141. Round JL, Mazmanian SK. Inducible Foxp3+ regulatory T-cell development by a commensal bacterium of the intestinal microbiota. Proc Natl Acad Sci U S A (2010) 107(27):12204–9. doi:10.1073/pnas.0909122107
142. Telesford KM, Yan W, Ochoa-Reparaz J, Pant A, Kircher C, Christy MA, et al. A commensal symbiotic factor derived from Bacteroides fragilis promotes human CD39(+)Foxp3(+) T cells and Treg function. Gut Microbes (2015) 6(4):234–42. doi:10.1080/19490976.2015.1056973
143. Ochoa-Reparaz J, Mielcarz DW, Wang Y, Begum-Haque S, Dasgupta S, Kasper DL, et al. A polysaccharide from the human commensal Bacteroides fragilis protects against CNS demyelinating disease. Mucosal Immunol (2010) 3(5):487–95. doi:10.1038/mi.2010.29
Слабительные средства при запорах
Запор – не просто неприятное физиологическое проявление.
Количество просмотров: 450 799
Дата последнего обновления: 20.07.2022 г.
Среднее время прочтения: 9 минут
Сегодня на фармацевтическом рынке представлены слабительные препараты с разным механизмом действия. Но для удобства их делят на 3 большие группы 1, 3 :
Слабительные средства стимулирующего действия
Лекарства с раздражающим эффектом могут действовать на разные отделы пищеварительного тракта 3,4,5 :
Важно помнить, что при злоупотреблении стимулирующими слабительными возможны побочные эффекты:
Средства, увеличивающие объем кишечного содержимого
Эта группа препаратов включает 3,16 :
Пищевые волокна
Макрогол
Солевые слабительные
Лактулоза
Слабительный эффект лактулозы развивается постепенно:
Размягчающие препараты
Микроклизмы
Микроклизма МИКРОЛАКС ® действует местно и оказывает мягкое слабительное действие благодаря наличию в ее составе 11 :
Благодаря комплексному воздействию трех компонентов слабительное действие наступает быстро — в среднем от 5 до 15 минут, согласно инструкции по применению.
Все слабительные следует принимать только после консультации с врачом. Чтобы избавиться от запора комфортно и эффективно, обязательно пройдите обследование у терапевта или гастроэнтеролога. Только специалист сможет учесть все противопоказания, риск побочных эффектов и назначить медикаменты так, чтобы они не вызывали привыкание.
Информация в данной статье носит справочный характер и не заменяет профессиональной консультации врача. Для постановки диагноза и назначения лечения обратитесь к квалифицированному специалисту
Смотрите в нашем видео, какое слабительное при запорах выбрать: таблетки, сироп или микроклизму
Как улучшить пищеварение
Проблемы с пищеварением знакомы многим. Одних людей они сопровождают постоянно, других — от случая к случаю. Сложности с переработкой еды проявляются выраженными симптомами — изжогой, интенсивным газообразованием, отрыжкой, расстройством стула, тяжестью и болезненностью в животе. Человек становится уязвимым перед кожными болезнями, депрессиями, вирусными респираторными инфекциями. В статье мы расскажем о работе пищеварительной системы, а также о том, как поддержать ее здоровье с помощью простых способов и препаратов для улучшения пищеварения.
Что такое пищеварение?
Это процесс, запускающий обмен веществ в организме. Пищеварение с технической стороны — это расщепление всех поступающих нутриентов, извлечение из них питательных веществ, формирование и выведение экскрементов. На каждом этапе съеденные продукты подвергаются механическому и химическому воздействию, за счет чего в организме образуются полезные соединения, появляется чувство сытости, формируются отходы. Пищеварительная система — комплекс абдоминальных органов, каждый из которых выполняет свою часть работы, но находится в тесной корреляции с остальными. Сбой системы на любом уровне вызывает проблемы с пищеварением, становится причиной снижения иммунитета, триггером развития болезней желудочно-кишечного тракта (ЖКТ) и смежных органов.
Как работают органы пищеварения?
Система переработки пищи представляет собой интеграцию отделов ЖКТ и вспомогательных желез, синтезирующих пищеварительный секрет — ферменты, желчь, другие биоактивные вещества. Органы ЖКТ — полые, а их стенки состоят из трехслойной оболочки. Изнутри — слизистый эпителий, отвечающий за ферментацию, пристеночное пищеварение, всасывание жидкостей в кровь. В середине — подслизистый слой, где сосредоточены нервные узлы, венозные и лимфоидные сосуды. Сверху — мышечная ткань, наделенная функцией «проталкивания» пищи, и серозная оболочка брюшины, защищающая органы от механических повреждений.
Начальный отдел ЖКТ
Желудочно-кишечный тракт начинается не где-то внутри организма, а уже в ротовой полости. Здесь еда измельчается зубами, дифференцируется рецепторами на вкус, температуру. Получив от рецепторов сигнал, мозг «дает команду» к производству пищеварительного сока железами разных уровней. Во рту химическая обработка продуктов и формирование пищевого комка поручена ферментам слюнных желез. Пищевой комок проталкивается в глотку — воронкообразную часть ЖКТ. Наряду с языком и мягким небом, она обеспечивает рефлекторное сокращение и расслабление мышц, продвигающих комок в приплюснутый мышечный канал — пищевод. Соединяя глотку с желудком, он растягивается приблизительно на 30 см и заканчивается кардиальным сфинктером (жомом, клапаном). В пищеводе комок увлажняется за счет работы желез и перемещается вниз за счет перистальтики. Сфинктер нужен, чтобы своевременно перекрыть наполненный желудок, не позволяя пережеванной еде и соляной кислоте двинуться в обратном направлении. При слабости кардиального жома развивается рефлюксная болезнь с изжогой и отрыжкой, снять которые могут специальные препараты: Гастал, Ренни.
Основное пищеварение
Пройдя кардиальный клапан, пищевой ком попадает в полый резервуар — желудок. Его средний объем у взрослых — 0,5 л, но способность растягиваться увеличивает вместимость до 4 л. Анатомически желудок включает кардиальный, верхний, центральный отделы и привратник, оканчивающийся еще одним клапаном (пилорическим сфинктером) на стыке желудка и двенадцатиперстной кишки.
Механическую сторону пищеварения обеспечивают мышечные сокращения желудка, химическую — желудочный сок. В его состав входят пепсин, химозин, лизоцим и другие биокатализаторы (ферменты), соляная кислота, бикарбонаты, нерастворимая слизь (муцин). При недостатке желудочных ферментов затормаживаются процессы расщепления нутриентов, особенно белков. В этом случае назначают таблетки для стимуляции ферментативных процессов (например, Ацидин-пепсин).
В желудке частично переработанный пищевой комок превращается в химус — полумягкую субстанцию, которая с помощью блуждающего нерва (вагуса) проталкивается через пилорический клапан в тонкую кишку. Именно здесь происходит основная переработка съеденных продуктов — полостное и пристеночное пищеварение, поглощение питательных веществ. Начальный отдел тонкой кишки — двенадцатиперстная кишка — снабжается желчью, соком желудка, кишечника и панкреатическим соком поджелудочной железы — основным источником пищеварительных ферментов. Для каждого вида нутриентов предусмотрен свой биокатализатор. Жиры расщепляет липаза, углеводы — амилаза, белки — протеаза. Ферментная дисфункция поджелудочной приводит к застойным и диспепсическим явлениям, нарушению всасывания питательных веществ в кишечнике, расстройству стула. В качестве заместительной терапии применяют искусственные ферменты — Панкреатин, Мезим, Фестал. Из двенадцатиперстной кишки процесс пищеварения перемещается в тощую, а затем — в подвздошную кишку, которая заканчивается илеоцекальным клапаном, отделяющим тонкую кишку от конечного отдела ЖКТ — толстой кишки.
Функции толстой кишки
Орган не вырабатывает кишечный сок, а поглощает жидкость и производит слизистую субстанцию для образования экскрементов. В толстой кишке сосредоточена основная масса бактероидов и полезных бактерий, составляющих основу крепкого иммунитета. Нарушение микрофлоры кишечника повышает риск заражения ОРВИ, приводит к проблемам с обменом веществ. Для нормализации баланса используют пребиотики и пробиотики (Бифиформ, Хилак Форте, Линекс). Верхняя часть толстой кишки — слепая кишка — анатомически дополнена придатком — аппендиксом. Вопреки сложившемуся мнению, это не рудимент, а достаточно важный отросток кишечника, принимающий участие в синтезе перистальтического гормона, хранении бифидобактерий. Среднюю зону толстой кишки занимает ободочная система, в которую входят восходящая, поперечная, нисходящая, сигмовидная кишки. Они не участвуют в переработке пищи, но активно всасывают полезные вещества, продвигают отработанные продукты, помогают в формировании и созревании экскрементов. Конечная часть ЖКТ — прямая кишка с мощным анальным клапаном и функцией освобождения организма от скопившихся отходов. При нарушениях работы толстой кишки развиваются воспаления (колиты), запоры, требующие применения слабительных таблеток.
Как улучшить пищеварение?
При здоровой пищеварительной системе питательные вещества, необходимые для стабильной работы организма, поддержания иммунитета, полноценно всасываются и усваиваются. Улучшить процесс расщепления и переработки нутриентов помогает соблюдение рекомендаций гастроэнтерологов.
Организуем безопасный рацион
Проблемы с пищеварением неизбежны, если невнимательно относиться к рациону. Существует много вкусных, но тяжелых для переваривания блюд, продуктов, провоцирующих недостаточность кардиального клапана, нарушение моторно-эвакуаторной функции, повышение внутрижелудочного давления.
Например, комбинация сложных углеводов с животными жирами (гамбургеры, картофель, макароны с жирным мясом). На переработку такой еды организму нужно около 4 часов, а если съесть большую порцию, то придется прибегнуть к дополнительным пищеварительным ферментам. В противном случае гарантированы диспепсия, вздутие живота и другие малоприятные ощущения.
При одновременном употреблении основного блюда с фруктами взрослых людей начинает мучить отрыжка. Олигосахариды и фитиновые кислоты в сочетании с белками трудно поддаются ферментации, поэтому застаиваются в желудке.
Острые соусы, цитрусовые фрукты, черный кофе, свежие томаты повышают уровень кислотности в желудке, расслабляют сфинктер. Появляется навязчивая изжога, а вместе с ней — необходимость приема лекарства.
Совет: не увлекайтесь потенциально вредными блюдами, следите за сочетанием продуктов в тарелке, увеличьте количество свежих овощей в рационе.
Полезный сахар
Простые углеводы, из которых состоят кондитерские изделия и другие сладости, провоцируют брожение, метеоризм, дисбаланс микрофлоры кишечника. Часто симптомы проявляются настолько сильно, что после десертов приходится пить таблетки от вздутия живота, проходить лечение препаратами для восстановления микрофлоры.
Совет: замените сладости фруктами, сухофруктами, ягодами.
Соблюдаем правильный режим
Когда у человека нет четкого времени для завтрака, обеда, ужина, а перекусы случаются на бегу, пищеварительная система не может вырабатывать нужное количество ферментов. Например, если изо дня в день питаться кое-как, но наедаться по вечерам, неизбежно появится тяжесть в животе.
Из-за длительных интервалов между едой нарушается гормональный фон:
В результате возрастает риск переедания, накопления жировой ткани, появления проблем с лишним весом.
Получая еду нерегулярно, организм не усваивает в полном объеме витамины, минералы, аминокислоты. Без дополнительного приема поливитаминных комплексов это приводит к снижению иммунитета, работоспособности.
Совет: соблюдайте интервалы между едой. Если кушать в одно и то же время, пищеварительные железы будут полностью готовы к работе, а слизистая кишечника — к поглощению полезных веществ.
Объявляем бойкот никотину и алкоголю!
Табачные смолы, никотин, разные сигаретные примеси сужают сосуды, замедляют всасывание питательных веществ, в результате чего организм не получает достаточного количества энергии и витаминов. Этанол раздражает слизистую органов пищеварения, тормозит процессы ферментации, убивает клетки поджелудочной железы, печени. В результате возникают нарушения разной тяжести — от банального несварения до серьезных заболеваний:
Лечение патологий печени, поджелудочной всегда длительное, а язва может спровоцировать желудочное кровотечение.
Совет: откажитесь от курения, минимизируйте употребление алкоголя. Если сложно побороть зависимость самостоятельно, лучше обратиться к наркологу, который назначит специальные препараты, психотерапию.
Повышаем физическую активность
Энергозатраты должны соответствовать количеству потребляемых калорий. Гиподинамия замедляет кровообращение и лимфоток. В результате замедляются моторные функции пищеварения, снижается тонус кишечника, застаиваются отходы жизнедеятельности. Симптоматически эти нарушения проявляются в виде эпигастральной тяжести, диспепсии, запора, отрыжки.
Совет: регулярно занимайтесь посильными видами спорта, делайте утреннюю зарядку, ежедневно совершайте пешие прогулки на свежем воздухе.
Если симптомы нарушения пищеварения стали хроническими, нужно записаться к гастроэнтерологу и пройти комплексное медицинское обследование.
Корвалол: инструкция по применению
Цены на товар в разных аптеках отличаются.» buttonclose=»true» position=»top» _nghost-sc96=»»>
«Корвалол» от чего
«Корвалол» состав
«Корвалол» противопоказания
«Корвалол» при беременности
«Корвалол» аналоги
Хотите разбираться в аналогах лекарств, чтобы умело подбирать препараты на свой бюджет? Наша методичка от экспертов-провизоров «Аналоги популярных лекарств» поможет вам в этом! Получить методичку просто: подпишитесь на наши соцсети и напишите в сообщения «аналоги».
При отсутствии «Корвалол» в аптеке, стоит ознакомиться с его заменителями. В их составе содержатся те же действующие вещества, которые обладают аналогичным действием.
«Барбовал» — препарат с содержанием тех же действующих веществ, что и «Корвалол». Показания, противопоказания и другие характеристики препаратов идентичны друг другу. Назначают по 10-15 капель 2-3 раза в сутки. Производится в Украине.
«Корвалдин» — содержание действующих компонентов одинаковое с добавлением масла шишек хмеля. Обладает теми же действиями, и показаниями применения. Принимают по 15-20 капель 3 раза в день. Производится в Украине.
Валериана, мелисса и мята в терапии тревожных расстройств и нарушений сна: обзор клинических исследований
Представлен обзор клинических исследований эффективности и безопасности применения растительных препаратов, содержащих валериану, мелиссу, мяту, при лечении нарушений сна и тревожных расстройств. Установлено, что растительные седативные средства могут быт
There is a short review of clinical studies on the efficacy and safety of herbal preparations containing valerian, lemon balm and peppermint extracts in the treatment of sleep disorders and anxiety disorders. The results showed that the herbal sedatives may be effective in the treatment of insomnia and stress-induced anxiety disorders.
Большинство социально активных людей проживают в условиях повышенного психоэмоционального напряжения и хронических стрессорных воздействий. По данным Всемирной организации здравоохранения, около 160 млн человек страдают депрессией и 30% населения испытывают тревожные расстройства, причем отмечается постоянный ежегодный рост распространенности этой патологии [1]. Глобальные эпидемиологические исследования, проводимые Всемирной организацией здравоохранения, и исследования в отдельных странах показывают, что нервно-психические расстройства в течение жизни переносит значительная часть населения, причем подавляющее большинство этих случаев остаются недиагностированными и нелечеными [2].
Частым следствием эмоционального стресса является эпизодическая инсомния. К эпизодическим нарушениям сна могут приводить экстремальные ситуации, чрезвычайные происшествия, утраты и болезни близких людей, а также обычные бытовые, конфликтные и психотравмирующие ситуации в семье и на работе. Причиной нарушенного сна может стать и значимое для человека радостное событие, вызывающее перевозбуждение.
Значительная роль в терапии инсомний отводится нелекарственным методам (соблюдение гигиены сна, психотерапия, фототерапия, ароматерапия, музыкотерапия, энцефалофония («музыка мозга»), рефлексотерапия, массаж, бальнеотерапия, физиотерапия и т. п.) и лекарственные методы. Однако далеко не всегда этих методов бывает достаточно. Если говорить о лекарственной терапии, то эффективное снотворное средство должно отвечать следующим критериям:
В последнее время вызывает дискуссию целесообразность и рентабельность широкого применения антидепрессантов, особенно при легкой и средней степени выраженности депрессии и тревоги [3, 4]. Значительное количество побочных эффектов при применении антидепрессантов и бензодиазепинов (дневная сонливость, нарушение концентрации внимания, заторможенность, гепато- и кардиотоксичность), высокая стоимость и низкая приверженность пациентов лечению диктуют необходимость поиска других вариантов терапии тревожно-депрессивных состояний. В настоящее время фитотерапию успешно применяют при нарушениях сна, повышенной тревожности и раздражительности, она хорошо переносится, и пациенты привержены данному виду терапии. Так, по данным Всемирной организации здравоохранения, около 80% населения предпочитают принимать лекарственные средства, содержащие природные растительные компоненты [5].
Принципы фитотерапии (метод лечения, основанный на применении лекарственных растений и комплексных препаратов из них) давно применяются в неврологии. К лекарственным растениям, обладающим седативным эффектом, относятся пустырник пятилопастный (Leonurus quinquelobatus), хмель обыкновенный (Humulus lupulus L.), пион уклоняющийся (Paeonia anomala L.), страстоцвет мясо-красный (Passiflora incarnata L.), арника горная (Arnica montana L.), льнянка обыкновенная (Linaria vulgaris Mill.) и многие другие. Многие из растительных препаратов были изучены в рандомизированных контролируемых исследованиях. Некоторые из них продемонстрировали выраженную клиническую эффективность и хорошую переносимость. Среди множества лечебных растений выделяют валериану лекарственную, мяту перечную и мелиссу лекарственную.
Валериана лекарственная (Valeriana officinalis L.) Корни и корневища этого многолетнего травянистого растения рода валериана (Valeriana) семейства валериановых (Valerianoideae) на протяжении многих столетий используют в медицине в качестве седативного и спазмолитического средства. Валериана лекарственная снижает рефлекторную возбудимость в центральных отделах нервной системы, усиливая тормозные процессы в нейронах корковых и подкорковых структур головного мозга. Валериана не только не вызывает супрессии центральной нервной системы, но и обладает антиневротическим, противоастеническим и общеукрепляющим эффектами.
Мята перечная (Mentha piperita L.). Представляет собой многолетнее травянистое растение рода мята (Mentha) семейства яснотковых (Lamiaceae) или губоцветных (Labiatae), полученное путем гибридизации мяты водной (Mentha aquatica) и мяты садовой (Mentha spicata). Относится к эфиромасличным растениям. Мята перечная обладает успокаивающим и спазмолитическим действием, а также болеутоляющим и рефлекторным коронародилатирующим эффектами.
Мелисса лекарственная (Melissa officinalis). Это многолетнее эфиромасличное травянистое растение рода мелисса (Melissa) семейства яснотковых (Lamiaceae) известнo также под названием мяты лимонной. Мелисса лекарственная обладает анксиолитическим, антистрессорным, антидепрессивным, спазмолитическим, седативным, антиоксидантным и другими эффектами. Мелиссу лекарственную называют «стресс-протектором» и «модулятором настроения»; ее применение считается показанным при негативизме, агрессивности, конфликтности, сниженном настроении и т. д.
В настоящее время не существует единого мнения об эффективности и безопасности применения фитопрепаратов. Остается открытым вопрос о правильном использовании как отдельных лекарственных растений, так и травяных сборов. Особенно важным является изучение спектра побочных эффектов, которые могут встречаться при применении растительных препаратов [6].
В ходе данного обзора проведена оценка эффективности и безопасности применения растительных препаратов, содержащих валериану, мелиссу, мяту, а также препаратов Персен® и Персен® Ночь при лечении нарушений сна и тревожных расстройств по данным отдельных рандомизированных клинических исследований, обзоров и метаанализов.
F. Donath и соавт. в 2000 г. представили результаты двойного слепого плацебо-контролируемого рандомизированного клинического исследования по оценке влияния экстракта валерианы (однократный прием либо в течение 14 дней) на структуру и качество сна в сравнении с плацебо [7]. В исследование были включены 16 пациентов в возрасте от 22 до 5 лет (средний возраст — 49 лет), страдающих инсомнией; результаты подтверждались данными полисомнографии. Было отмечено, что однократный прием валерианы перед засыпанием не оказывает влияния на структуру и субъективные характеристики сна, но в то же время при применении экстракта валерианы в течение двух недель наблюдалось статистически достоверное по сравнению с плацебо (р
ФГБУ РНЦ МРиК МЗ РФ, Москва
Современные слабительные препараты: альтернатива выбора
Н. А. Цубанова, Национальный фармацевтический университет
Одной из актуальных проблем современной медицины и фармации остается лечение запоров. По некоторым данным запоры или функциональные заболевания кишечника в последнее десятилетие считаются наиболее распространенными среди больных гастроэнтерологического профиля. Это подтверждают и данные эпидемиологических исследований, приведенные проф. Н. Б. Губергриц, где отмечено, что запоры диагностируются у 12% взрослого населения Земли, у 50% населения Великобритании, России, у 30% населения Германии, у 20% населения Франции. По данным Т. В. Бородиной, Н. Д. Бунятян, данное заболевание достигает 10% только среди детей школьного возраста. И это только верхушка айсберга, если учесть, что лица, страдающие запорами, зачастую не обращаются к врачу, а занимаются самолечением. По данным зарубежных авторов, около 75% пожилых людей занимаются самолечением запоров. Учитывая вышеизложенное, нетрудно понять, что истинная распространенность запоров, очевидно, значительно выше, чем это следует из эпидемиологических исследований.
Под запором понимают увеличение интервалов между дефекациями более чем на 48 часов, и при этом натуживание занимает более 25% времени дефекации. При хроническом запоре подобное состояние отмечается на протяжении более трех месяцев. При запорах часто имеет место нерегулярное опорожнение кишечника, слишком твердая консистенция кала, чувство неполного опорожнения или малое количество каловых масс (менее 35 г; в норме 100–150). Запор вызывается нарушением процессов формирования и продвижения кала по кишечнику. Причин может быть несколько: расстройства двигательной деятельности (моторики) мышц кишечника, ослабление позывов к дефекации, изменение строения кишечника или ближайших к нему органов, препятствующее нормальному продвижению содержимого, несоответствие между вместимостью толстой кишки и объемом кишечного содержимого. Проблемой в фармакотерапии запоров является также полиэтиологичность заболевания (табл. 1). Прежде всего, это эндокринные и метаболические болезни, различные неврогенные факторы (вегетативная дисфункция, представляющая собой расстройство деятельности вегетативного отдела нервной системы, регулирующего функции внутренних органов). К факторам, вызывающим запор с участием нервных механизмов, относятся также рефлекторные воздействия на кишечник со стороны различных органов, прежде всего желудка и желчных путей. Значительное место в этиологии запоров занимают болезни ректоанальной зоны.
Самые эффективные пробиотики для кишечника: топ-5
Какие пробиотики лучше выбрать.
18 августа, 2021 год
Содержание
Если недавно вы прошли курс антибиотиков, у вас вздутие, бурлит в животе или плохой аппетит, возможно, врач скажет вам пропить пробиотики. Рассказываем, что это за препараты для кишечника и какой лучше выбрать?
В организме человека примерно 2 килограмма бактерий, которые живут в кишечнике, на слизистых и на коже. Впечатляет, правда? Но не переживайте: это полезные микроорганизмы, которые приносят нам пользу. Ученые назвали все эти микроорганизмы микробиомом, в их числе – и нормальная микрофлора кишечника.
Микробы участвуют в развитии и укреплении нашего иммунитета, синтезе витаминов, а еще защищают организм от некоторых инфекционных заболеваний. Поэтому микрофлору кишечника нужно поддерживать. Важно не допускать дисбактериоза, то есть уменьшения количества полезных бактерий в кишечнике. Среди факторов, негативно влияющих на микрофлору, – неправильное питание, частые стрессы и инфекции, прием антибиотиков, пищевые отравления.
Что такое пробиотики?
Пробиотики – это специальные препараты или продукты питания, содержащие полезную для организма микрофлору (это могут быть разные штаммы: лактобациллы, полезные виды кишечной палочки, бифидобактерии). Пробиотики можно купить в жидком виде (живые микроорганизмы) или в порошке (они активизируются, попадая в кишечник).
Когда нужны пробиотики?
Главная задача пробиотиков – заселение кишечника полезными микробами, восстановление микрофлоры, которая погибла по тем или иным причинам. Пробиотики помогают бороться с кишечными инфекциями, уменьшая такую симптоматику, как рвота, понос и температура. Пробиотики полезны при запорах, вздутии живота, диарее, отрыжке, метеоризме и спазмах кишечника. Кроме того, пробиотики улучшают иммунитет и работу нервной системы.
Как выбрать пробиотики?
Пробиотики иногда принимают для профилактики, но чаще всего если для этого есть конкретные показания, поэтому помочь с подбором пробиотика для кишечника должен врач. Препарат назначается, учитывая конкретные проблемы с ЖКТ и возраст пациента.
При микробных диареях и пищевых отравлениях необходимы комплексы лакто- или бифидобактерий. При вирусных заболеваниях назначаются лактобациллы. В составе выбранного препарата желательно наличие пребиотика – то есть специальной среды, чтобы полезные микроорганизмы лучше приживались в кишечнике. Если нет, то нужно параллельно придерживаться специальной диеты, основа которой – пребиотические волокна (бананы, яблоки, топинамбур, чеснок, лук, спаржа).
При выборе пробиотика обратите внимание на его форму, чтобы он был удобен для приема. Проверьте срок годности и условия хранения, потому что многие пробиотики должны храниться в холодильнике при определенной температуре, иначе пользы от них не будет.
Немаловажный показатель – КОЕ (колониеобразующие единицы). Препарат будет неэффективным, если этот показатель будет менее 5 млрд.
Лучшие пробиотики для кишечника
В нашем списке – самые современные препараты для микрофлоры кишечника, эффективность которых доказана. Также мы учли рекомендации врачей и положительные отзывы пациентов. Итак, если вам назначили пропить бифидобактерии, обратите внимание на список этих препаратов.
Лактобактерин
«Лактобактерин» врачи назначают давно, поэтому он доказал свою эффективность. В составе препарата – высушенные лактобациллы (Lactobacillus). Купить «Лактобактерин» можно в виде порошка, из которого делают суспензию, добавляя воду. Полезные лактобактерии быстро попадают в кишечник и заселяют его, синтезируя молочную кислоту. Молочная кислота при этом не дает размножаться патогенным микроорганизмам. Да и сами лактобактерии подавляют рост и размножение «вражеских» микробов. «Лактобактерин» назначают для улучшения работы пищеварительного тракта (кстати, препарат безопасен для беременных и кормящих), для укрепления иммунитета, для стимуляции обменных процессов у пациентов с хроническими заболеваниями (диабет, гастриты, колиты, лишний вес, метаболический синдром и т. д.). «Лактобактерин» помогает при дисбактериозе влагалища и молочнице. Этот препарат отлично повышает сопротивляемость организма инфекционным заболеваниям.
Лактобактерин
Биофарма С.п.А. / Хр.Хансен, Дания; ЧАО «Биофарма», Украина; Панацея Биотек (Panacea Biotec), Индия; Микроген НПО, Россия
Симбиолакт Плюс
Это современный пробиотик производства Германии, который назначают для поддержания полезной микрофлоры кишечника, укрепления иммунитета и улучшения состояния кожи. «Симбиолакт Плюс» – это пробиотики и биотин. В составе этого препарата – четыре штамма бактерий (Lactobacillus acidophilus, Lactobacillus paracasei, Lactococcus lactis, Bifidobacterium animalis). Комплекс идеально сбалансирован таким образом, чтобы действовать и в тонком, и в толстом кишечнике. В упаковке – 30 саше, рассчитанных на месячный курс лечения (за этот период микрофлора кишечника полностью восстанавливается). «Симбиолакт Плюс» не имеет запаха и вкуса, его можно разводить в воде, соке или добавлять в йогурт либо в творог.
Симбиолакт Плюс
R-Pharm Germany GmbH, Германия
Биологически активная добавка к пище, источник пробиотических и молочнокислых микроорганизмов, дополнительный источник биотина.
ПРЕПАРАТЫ ДЛЯ КОРРЕКЦИИ МИКРОБИОЦЕНОЗА ОРГАНИЗМА ЧЕЛОВЕКА
В норме микрофлора составляет с организмом человека единую экологическую систему, называемую эндоэкологией, с колонизацией примерно 500 различных видов микроорганизмов. В организме человека нормальная (симбиотическая, индигенная, резидентная, или автохтонная) микрофлора присутствует постоянно и расселяется неравномерно: 77,5% ее присутствует в желудочно-кишечном тракте (ЖКТ); 12% находится на поверхности кожи и в более глубоких слоях; 5% в верхних дыхательных путях (трахея, бронхи и альвеолы обычно стерильны); 5% в мочеполовой системе: на наружных гениталиях, слизистой уретры, во влагалище (почки, матка, мочеточники, мочевой пузырь обычно стерильны) и 0,5% на конъюнктиве глаз.
Преферанская Нина Германовна
Ст. преподаватель кафедры фармакологии фармфакультета ММА им. И.М. Сеченова, к.фарм.н.
Транзиторная (непостоянная, или аллохтонная) микрофлора не способна к длительному существованию, ее задержка в организме человека может вызвать различные воспалительные процессы и привести к тяжелым заболеваниям.
Нормальная микрофлора человека является своеобразным «экстракорпоральным органом» (внесистемным) и играет важную роль в жизнедеятельности организма, выполняя следующие важнейшие функции:
В ЖКТ обитает примерно 400 различных видов и подвидов микроорганизмов, вес которых составляет от 2,5 до 3,0 кг, что значительно превышает вес отдельных органов (средний вес печени – 1,5 кг; почек – 400 г). 40% энергии, получаемой организмом от потребляемой пищи, затрачивается на питание микрофлоры. Общее число клеток нашего организма в 10 раз меньше числа клеток микроорганизмов, поселившихся в нем.
Дисбактериоз кишечника – не является самостоятельным заболеванием, это клинико-лабораторный синдром, возникающий при целом ряде заболеваний или индивидуальных клинических ситуаций. Он чаще развивается при острых кишечных инфекциях (дизентерия, сальмонеллез, вирусная диарея и т.п.), при воспалительных заболеваниях тонкого и толстого кишечника (колиты и энтероколиты), а также на фоне длительной антибактериальной терапии. Дисбактериоз характеризуется изменением видового, качественного и/или количественного состава микробных популяций в определенном биотопе, транслокацией ее различных видов в несвойственные биотопы, с избыточным их ростом, расстройством обменных процессов, метаболическими и иммунологическими нарушениями, в тяжелых случаях приводящих к поражениям ЖКТ.
К сожалению, при несбалансированном питании, употреблении антибиотиков, алкоголя, сигарет, гормональных препаратов и других неблагоприятных условиях, микроорганизмы, населяющие организм человека, гибнут миллионами, изменяя его микробиоценоз и нарушая физиологическое равновесие микрофлоры. В целях нормализации кишечной микрофлоры созданы препараты, представляющие собой высушенные взвеси живых или убитых бактерий: бифидо-, энтеро-, лактобактерии и другие. Для коррекции микрофлоры существуют более 100 препаратов. Пищевой промышленностью выпускаются многочисленные кисломолочные продукты и йогурты с добавлением микроорганизмов. Чтобы не ошибиться и выбрать наиболее приемлемый препарат для коррекции микробиоценоза, необходимо познакомиться с номенклатурой и характеристикой основных его препаратов. Лечебно-профилактические препараты для коррекции нарушений микробиоценоза ЖКТ и мочеполового микробиоценоза принято классифицировать на пробиотики (эубиотики), пребиотики, симбиотики (комбинированные препараты).
Пробиотики (эубиотики) это лекарственные препараты, содержащие живые или убитые микроорганизмы определенных видов бактерий, естественно населяющие биотопы человека и применяемые с лечебной целью.
Пробиотики по составу представляют собой монопрепараты живых микроорганизмов, содержащие микробную массу бифидо-, лакто- или энтерокультру. В состав препаратов могут входить убитые бактерии или споры бактерий. Выделяют детские и взрослые препараты, выпускаемые с разными концентрациями бактерий или содержащие одну концентрацию, но дозируемые в зависимости от возраста. Существуют различные лекарственные формы пробиотиков – в виде пастилок, лиофилизированных таблеток, капсул, суппозиторий, в форме пакетиков, содержащих лиофилизированный порошок для приготовления суспензий, жидкие лекформы в ампулах или флаконах. Пробиотики обеспечивают более длительную физиологическую эффективность, чем пребиотики, но более эффективными являются комбинированные препараты сложного состава.
Пребиотики – это вещества, способствующие избирательной стимуляции роста бактерий нормальной микрофлоры человека и активирующие их метаболические функции. Представляют собой пищевые ингредиенты, чаще всего это низкомолекулярные углеводы, которые адсорбируются в верхних отделах пищеварительного тракта и не расщепляются пищеварительными ферментами человека. Свойствами пребиотиков обладают фрукто-олигосахариды, инулин, галакто-олигосахариды, лактулоза. Для повышения физиологической роли их наиболее часто комбинируют с пробиотиками.
Компоненты, входящие в состав пробиотических и пребиотических препаратов, не всасываются из просвета кишечника и не поступают в системный кровоток, не разрушаются соляной кислотой желудка, ферментами ЖКТ и желчью. Не содержат красителей, адаптеров вкуса, молочного сахара, белка и других аллергенов. При применении этих препаратов побочных эффектов не выявлено. Противопоказаниями к их применению служит повышенная чувствительность к входящим компонентам.
Лекарственные препараты, используемые для коррекции естественного микробиоценоза организма человека, нашли широкое применение для лечения и профилактики дисбактериоза, кишечных инфекций, токсикоинфекций, острой диареи, воспалительных заболеваний полости рта, носоглотки, при синдроме раздраженного кишечника, вагинитах, кольпитах, псевдомембранозных колитах, для восстановления микрофлоры после операций и после курса химиотерапии.
Бифидумбактерин 1000 (1 флакон No 30 соответствует 60 флаконам порошка) содержит бифидобактерии (КОЕ/г, не менее 1х108 МКЦ), выпускается в виде таблеток массой 0,2 г и 0,3 г в упаковке по 30 штук. Взрослым по 2 таблетки 2–3 раза в день во время еды с пищей, длительность приема – 1–3 месяца, детям старше 3 лет – по 1–2 таблетки 3 раза в день во время еды с пищей. Длительность приема – до 1 месяца.
Эти таблетки нормализуют работу желудка и кишечника, помогают при отравлениях, быстро ликвидируют клинические проявления дисбактериоза. Препарат начинает действовать в течение 2–3 часов после первого приема. Бифидумбактерин 1000 восстанавливает баланс желудочно- кишечной микрофлоры после курса антибиотиков, способствует нормализации обмена белков, жиров и углеводов, правильному всасыванию витаминов, микро- и макроэлементов. Таблетки удобны в применении: их не нужно растворять в воде, как порошок. При употреблении Бифидумбактерина 1000 снижается уровень холестерина в крови, повышаются работоспособность и иммунитет. Бифидобактерии выполняют витаминообразующие функции, участвуют во всасывании фолиевой и никотиновой кислот, солей кальция, витаминов группы В. Уникальность Бифидумбактерина 1000 в том, что его передозировка невозможна. Это абсолютно безвредное средство. 1 таблетка Бифидумбактерина 1000 содержит столько же полезных бактерий, сколько 100 литров кефира.
Бифидумбактерин форте представляет собой лиофильно высушенную микробную массу живых бактерий антагонистически активного штамма Bifidobacterium bifidum No 1, иммобилизованных на частицах активированного измельченного угля – не менее 5х107 КОЕ (колониеобразующих единиц) бифидобактерий, обладает антагонистической активностью против широкого спектра патогенных и условнопатогенных микроорганизмов. Прием препарата нормализует микрофлору кишечника и активирует процесс пищеварения. Препарат улучшает обменные процессы, обладает иммуномодулирующим действием, повышает неспецифическую резистентность организма и препятствует формированию затяжных кишечных заболеваний.
Бифидумбактерин форте применяют перорально. Детям дают во время кормления, смешав с материнским молоком или продуктом детского питания. Детям старшего возраста и взрослым препарат перед употреблением смешивают с жидкой частью пищи, желательно кисломолочным продуктом или с 30–50 мл кипяченой воды комнатной температуры. При растворении препарата водой образуется мутная суспензия с частичками сорбента черного цвета. Полученную водную взвесь следует выпить, не добиваясь полного растворения. При необходимости препарат принимают независимо от приема пищи. Детям до года по 1 пакету 2–3 раза в сутки, с года и старше – по 1 пакету 3–4 раза в сутки, взрослым по 2 пакета 2–3 раза в сутки. Курс лечения при острых кишечных инфекциях и пищевых токсикоинфекциях составляет 5–7 дней, при других заболеваниях – 15–21 день (определяется характером и тяжестью заболевания).
Пробифор – лиофильно высушенная микробная масса живых бактерий антагонистически активного штамма Bifidobacterium bifidum No 1, иммобилизованных на частицах активированного измельченного угля – не менее 5х108 КОЕ бифидобактерий, Пробифор выпускается в пакетах из многослойного металлополимерного материала. Пакеты по 6, 10, 30, 100 упакованы в пачки. Дозируется детям с 1 года до 3 лет – по 1 пакету 2 раза в день, с 3 до 7 лет – по 1 пакету 3 раза в день; детям старше 7 лет и взрослым – по 2–3 пакета 2 раза в день.
Лактобактерин сухой выпускается в ампулах по 3–5 доз, в свечах и в таблетках, представляет собой лиофильно высушенную микробную массу живых молочнокислых бактерий (Lactobacillus plantarum или Lactobacillus fermentum) – естественных симбионтов кишечника человека. Препарат физиологичен для организма человека и полностью безвреден. Лечебный эффект Лактобактерина обусловлен антагонистическим действием лактобактерий к патогенным и условнопатогенным микроорганизмам. Иммунотропное действие проявляется стимуляцией макрофагального фагоцитоза, нормализацией соотношения Т-хелперов и Т-супрессоров, активизацией Т-киллеров, индукций интерферона, восстановлением баланса интерлейкина-2. Препарат обладает антимутагенным и антиканцерогенным действием. Лактобактерин проявляет противовирусное действие, предупреждает заболеваемость гриппом и ОРВИ, устраняет интоксикацию и морфо-функциональные нарушения красной крови. Устойчив к широкому кругу антибиотиков. Является основой для приготовления кисломолочного лактобактерина. Предназначен для лечения детей и взрослых. Детям препарат во флаконах можно применять с первых месяцев жизни, а в таблетках – только с 3 лет. Детям до 6 мес. – по 1–2 дозы, от 6 мес. до 1 года – 2–3 дозы, от 1 года до 3 лет – по 3–4 дозы, старше 3 лет – 4–10 доз. Содержимое ампулы растворяют кипяченой холодной водой из расчета чайная ложка на 1 дозу препарата. Суточные дозы можно делить на 2–3 приема. Препарат следует принимать за 40–60 минут до еды и желательно запить молоком. Лактобактерин сухой в таблетках следует применять за 40–60 мин. до еды и желательно запивать молоком. Лечение рекомендуется сопровождать применением витаминов. Лактобактерин в свечах применяют интравагинально. Выпускают сухую пористую или кристаллическую массу в ампулах (флаконах) по 3 и 5 доз, в упаковке 10 ампул (флаконов); таблетки во флаконах по 20 штук, 1 таблетка – 1 доза; в контурной ячейковой упаковке по 5 свечей, в упаковке 10 свечей.
Ацилакт суппозитории представляет собой микробную массу живых ацидофильных лактобактерий, высушенную в среде культивирования с добавлением сахарозо-желатино-молочной среды и сформованную в медицинские суппозитории. Суппозиторий содержит не менее 107 живых бактерий (1 доза). Применяют для лечения клинически выраженных дисбактериозов и воспалительных процессов женских гениталий. Лактобактерии метаболизируют гликоген вагинального эпителия до молочной кислоты, которая поддерживает рН влагалища на уровне 3,8–4,2. Высокая концентрация молочной кислоты создает неблагоприятные условия для жизнедеятельности кислочувствительных патогенных и условнопатогенных бактерий. Заселяя слизистую гениталий, лактобациллы участвуют в формировании экологического барьера и обеспечивают колонизационную резистентность организма. Назначают по 1 суппозиторию 2 раза в день в течение 5–10 дней.
Гастрофарм выпускается в таблетках. В 1 таблетке содержатся жизнеспособные клетки лактобацилл обыкновенного штамма (Lb-51) и биологически активные продукты их жизнедеятельности в количестве 1,575 г. Оказывает защитное действие на слизистую оболочку желудка и кишечника, гастропротекторное действие обеспечивается биологически активными продуктами и высоким содержанием белков (до 30%). Препарат регулирует равновесие кишечной микрофлоры, стимулирует регенерацию в слизистой оболочке и нормализует функции ЖКТ. Назначают по 1–2 таблетке 3 раза в сутки за 30 минут до приема пищи. Таблетки следует разжевать и запить небольшим количеством воды.
Колибактерин представляет собой микробную массу живых клеток кишечной палочки М-17, выпускается в ампулах по 3 дозы. Колибактерин применяют через рот за 40–60 мин. до еды. Количество доз и длительность лечения определяет врач в зависимости от показаний.
Энтерол содержит 250 мг Saccharomyces boulardii, в пакетиках для приготовления раствора для приема внутрь. Оказывает быстрый антидиарейный эффект и антимикробное действие в отношении широкого спектра патогенных и условнопатогенных возбудителей, антитоксическое действие в отношении бактериальных цито- и энтеротоксинов, повышает иммунную защиту и оказывает трофическое действие на кишечную стенку. Выпускается в капсулах, применяют детям от 1 до 3 лет по 1 капсуле 2 раза в сутки в течение 5 дней, с 3 лет и взрослым по 1 капсуле 2 раза в сутки в течение 7–10 дней. Энтерол в пакетиках применяют с 3-летнего возраста, содержимое 1 пакета разводят в 1/2 стакана теплой воды. После прекращения приема препарата он полностью выводится из организма в течение 2–5 суток.
КОМБИНИРОВАННЫЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ,
используемые для коррекции естественного микробиоценоза организма человека
Флорин форте – поликомпонентный сорбированный пробиотик, содержащий бифидо- и лактобактерии. Выпускается в дозируемых пакетиках по 10, 20 и 30 штук. Препарат устраняет дефицит как бифидо-, так и лактобактерий, регулируя восстановление нормофлоры после ее нарушений, воздействует на всем протяжении ЖКТ. Препарат показан детям с первых дней жизни (в т.ч. недоношенным), беременным и в период лактации, взрослым и людям пожилого возраста.
Бификол представляет собой лиофильно высушенную в среде культивирования микробную массу совместно выращенных живых антагонистически активных штаммов бифидобактерий и кишечной палочки.
По механизму действия является многофакторным лечебным средством, обладающим антагонистической активностью в отношении широкого спектра патогенных и условнопатогенных микроорганизмов; оказывает корригирующее воздействие на микробиоценоз, стимулирует местные репаративные процессы в кишечнике, обеспечивает организм витаминами групп В и К, способствует полноценному перевариванию и усвоению пищи. Бификол применяют внутрь через рот за 20–30 минут до еды. Для растворения препарата используют кипяченую воду комнатной температуры из расчета одна чайная ложка на одну дозу препарата. Разведенный препарат хранению не подлежит. Детям Бификол назначают с шестимесячного возраста до года – по 3 дозы в день, от года до 3 лет – по 5–10 доз. Суточную дозу и продолжительность лечения определяет врач в зависимости от тяжести, длительности заболевания и выраженности дисбактериоза.
Бифилиз – лиофилизированый биопрепарат, содержащий живые бифидобактерии (Bifidobactenum bifidum штамм 1) и лизоцим. Выпускается в виде сухой лиофилизированной пористой или кристаллической массы разных оттенков бежевого или беловато-серого цвета, во флаконах по 5 доз. При растворении водой образует непрозрачную гомогенную взвесь со специфическим запахом и вкусом. Содержит в одной дозе не менее 10 млн живых бифидобактерий и 10 мг лизоцима. С лечебной целью Бифилиз применяют у взрослых и детей по 5 доз (1 фл.) на прием 2–3 раза в сутки.
Лизоцим обладает бифидогенным, иммуномодулирующим противовоспалительным действием, стимулирует метаболические репаративные процессы и эритропоэз, улучшает пищеварение, повышает противоинфекционную и антитоксическую резистенстность организма, оказывает антибактериальное действие и проявляет синергизм со многими антибиотиками. Оптимальное сочетание бифидобактерий и лизоцима в составе бифилиза позволяет усилить лечебное действие каждого компонента и ограничить применение антибиотиков для лечения кишечных инфекций и селективной деконтаминации. Бифилиз предназначен для применения у взрослых и детей всех возрастных групп, начиная с первых дней жизни, для лечения и профилактики дисбактериоза различного генеза и дисфункций кишечника, у новорожденных и грудных детей при раннем искусственном и смешанном вскармливании, у больных с вторичными иммунодефицитными состояниями, в том числе на фоне и после цитостатической терапии при тяжелых инфекционно-воспалительных и гнойно-септических заболеваниях, на фоне и после применения антибиотиков широкого спектра, для лечения острых кишечных инфекций бактериальной этиологии, в т.ч. дизентерии, сальмонеллеза, пищевых токсикоинфекций, особенно при выраженных явлениях интоксикации и при непереносимости антибиотиков, для лечения острых и хронических неспецифических воспалительных заболеваний пищеварительного тракта, сопровождающихся угнетением репаративных процессов слизистой оболочки кишечника. Препарат нельзя растворять в горячей воде. Препарат следует растворять только непосредственно перед применением, т.к. при хранении в растворенном виде теряются его терапевтические свойства.
Флайс – жевательные таблетки fly’s 1, fly’s 2, fly’s 3, fly’s 4 – содержат одинаковый комплекс молочнокислых бактерий и бифидобактерий, общее количество микроорганизмов в суточной дозе 3,6×109 КОЕ, различаются только добавками биологически активных компонентов, способствующих нормализации основных физиологических функций организма. Продукты метаболизма молочнокислых бактерий стимулируют рост колоний бифидобактерий, создается неблагоприятная среда для условнопатогенных и патогенных микроорганизмов и восстанавливается нормальный микробный баланс в кишечнике. Бактерии, входящие в состав препарата, синтезируют витамины В1, В2, РР, К, фолиевую кислоту и улучшается всасывание железа и кальция.
Лактоспора – натуральный препарат для лечения дисбактериоза, выпускается по 60 тб. Препарат содержит 100 млн живых лактобактерий, 50 мг инулина, 100 мг фруктоолигосахаридов и 350 РСС натуральных лактоэнзимов. Препятствует росту патогенных микроорганизмов. Благодаря наличию фруктоолигосахаридов обеспечивается питательная среда для жизнедеятельности лакто- и ацидофильных бактерий. Препарат усиливает расщепление и усвоение лактозы и других дисахаридов, снижая потребность в гормоне инсулине. Кроме того, полисахаридинулин, являясь хорошим источником углеводов, не требует дополнительной выработки инсулина, что особенно важно для больных диабетом. Повышается общий и местный иммунитет за счет усиления фагоцитоза, активности лимфоцитов-киллеров и увеличения продукции лейкоцитарного интерферона. Назначают ежедневно по 2–4 таблетки за 30 минут до еды, сосать как конфету; детям – 1–2 таблетки в день.
Лактофайбер – растительные диетические волокна в комплексе с лактобактериями, улучшающими микрофлору кишечника. Файбер 12 г, растворимые и нерастворимые растительные волокна из сои, яблок и цитрусовых, Lactobacillus coagulans – 52 мг (320 млн бактерий). Препарат препятствует всасыванию насыщенных жиров, холестерина и токсинов желудочно-кишечным трактом. Попадая в желудок и кишечник, растительные волокна разбухают под действием воды и желудочного сока, что создает ощущение сытости. Файбер очищает кишечник, усиливает перистальтику, нормализует стул, предотвращает развитие гнилостных процессов в кишечнике, препятствует развитию онкологических заболеваний толстой кишки. Благодаря наличию лецитина благоприятно влияет на функцию печени, восстановлению функций нервной системы. 1–2 столовые ложки в день. Разводить в цитрусовом соке 1 ложка на стакан. Употреблять за 30 минут до еды.
Хилак форте выпускается в каплях для приема внутрь, флаконы по 30 и 100 мл. Капли содержат стерильный концентрат беззародышевых водных субстратов продуктов обмена веществ для образования молочной кислоты, с продуктами обмена веществ грамположительных и грамотрицательных симбионтов кишечной флоры тонкой и толстой кишок. В 1 мл биосинтетических активных веществ не менее 100 млрд микроорганизмов. Препарат способствует регенерации физиологической флоры кишечника биологическим путем, вызывая сдвиг и поддержание значений рН в ЖКТ в границах физиологической нормы, что создает неблагоприятные условия для жизнедеятельности патогенных микроорганизмов, обеспечивает санацию кишечника. На фоне ускорения развития нормальных симбионтов кишечника под действием препарата нормализуется естественный синтез витаминов группы В и К, улучшаются физиологические функции слизистой ЖКТ. Содержащиеся в препарате короткоцепочечные летучие жирные кислоты обеспечивают регенерацию поврежденной микрофлоры кишечника при инфекционных заболеваниях ЖКТ, стимулируют синтез эпителиальных клеток кишечной стенки, восстанавливают нарушенный водно-электролитный баланс в просвете кишки.
В первые дни лечения взрослым препарат назначают по 40–60 капель 3 раза в сутки; детям – по 20–40 капель 3 раза в сутки; детям грудного возраста – по 15–30 капель 3 раза в сутки. После улучшения состояния первоначальная суточная доза Хилак форте может быть уменьшена наполовину. Принимают внутрь до или во время приема пищи в небольшом количестве жидкости, исключая молоко.
Для коррекции микробиоценоза часто используются биологически активные добавки (БАД) к пище. БАД очень мягко и естественно восстанавливают нормальную микрофлору кишечника, поддерживают естественную защиту организма от бактерий и вирусов. Интересны последние исследования, связанные с язвой желудка и двенадцатиперстной кишки. Ученые доказали: одним из главных факторов, провоцирующих эти заболевания, являются хеликобактерии (Helicobacter pylori). Справиться с ними – значит улучшить самочувствие больного, улучшить качество его жизни, ускорить ремиссию. На помощь приходит облигатная микрофлора (Bifidobacterium longum, Lactobacillus acidophilus и др.), которая задерживает размножение хеликобактерий.
Бифидофилус Флора Форс содержит лактобактерии (Lactobacillus acidophilus) – 25х108 и бифидобактерии (Bifidobacterium longum) – 10х108. Восстанавливает нормальную микрофлору кишечника, регулирует работу желудочно-кишечного тракта, улучшает синтез витамина К и поддерживает естественную защиту организма от бактерий и вирусов. Бифидофилус Флора Форс в составе содержит Bifidobacterium longum и Lactobacillus acidophilus. Попав в желудочно-кишечный тракт, они легко размножаются, заполняя все свободные уголки, вытесняя и безжалостно расправляясь с патогенной микрофлорой – причиной многих заболеваний, в том числе с возбудителями дизентерии, сальмонеллеза. Противостоят эти бактерии и образованию в кишечнике канцерогенного Н-нитрозосоединения. Принимать по 1 капсуле 3 раза в день во время еды в качестве добавки к пище.
Бифидофилус чуэбл Бифидозаврики – жевательные таблетки с бифидо- и лактобактериями для детей. Бифидофилус чуэбл Бифидозаврики содержит фруктоолигосахариды (питательная среда для роста полезной флоры) и не менее 1 миллиарда (109) молочнокислых бактерий (бифидо- и лактобактерии). Эти бактерии создают в кишечнике условия, неблагоприятные для патогенных (болезнетворных) микроорганизмов. Добавка содержит те виды бифидо- и лактобактерий, которые необходимы именно детскому организму. В связи с тем, что дети часто плохо глотают капсулы, этот препарат представлен в виде жевательных таблеток с натуральным апельсиновым ароматом. В качестве добавки к пище принимать по 1 таблетке в день после еды.
Ацидофилис-бифидум Плюс табл. No 60 (60 жевательных таблеток со вкусом малины) и Ацидофилис-бифидум с витамином С содержат витамин С, пробиотический комплекс (фруктоолигосахариды, Lactobacillius acidophilus, Bifidobacterium bifidum, Bifidobacterium infantis). Способствуют устранению дисбактериоза после приема антибиотиков; повышают умственную и физическую работоспособность; помогают быстрее справиться с последствиями отравлений, нормализуя микрофлору кишечника; улучшают работу всего желудочно-кишечного тракта; ускоряют восстановление организма после болезни; укрепляют иммунитет; не содержат искусственных красителей и консервантов. Детям от 2 до 4 лет – одну таблетку в день, для детей старше 4 лет и подросткам – по одной таблетке 2 раза в день, разжевать перед едой и запивать водой.
Нормофлорины. Выпускают Нормофлорин-Л (в 1 мл – 109-10 микробных клеток лактобактерий) и Нормофлорин-Б (в 1 мл – 1010 бифидобактерий). Помимо бактерий, содержат незаменимые аминокислоты, органические кислоты и комплекс витаминов и микроэлементов. Препараты не содержат консервантов и красителей. Препараты улучшают перистальтику кишечника, снижают уровень холестерина и оксалатов, расщепляют лактозу, стимулируют синтез иммуноглобулинов. На всем протяжении слизистой кишечника образуют защитную биопленку. При применении этих препаратов в короткие сроки подавляется акт
Прокинетики: настоящее и будущее
Поиск средств, нормализующих моторно-эвакуаторную деятельность пищеварительного тракта, привлекает внимание врачей-исследователей на протяжении нескольких столетий. Вероятно, одним из первых представителей этой группы является имбирь, издревле применяемый
Поиск средств, нормализующих моторно-эвакуаторную деятельность пищеварительного тракта, привлекает внимание врачей-исследователей на протяжении нескольких столетий. Вероятно, одним из первых представителей этой группы является имбирь, издревле применяемый в традиционной китайской медицине [1] как средство, устраняющее тяжесть в животе и тошноту, обладающий слабой антагонистической активностью в отношении 5-HT3-рецепторов [2]. К настоящему времени средства, воздействующие на моторную активность пищеварительного тракта и препятствующие антиперистальтическим сокращениям гладкой мускулатуры, объединены в группу прокинетиков [3].
Прежде всего, необходимо очертить круг показаний, по поводу которых получены доказательства в эффективности применения прокинетиков.
Во-первых, заболевания пищеварительного тракта, в развитии которых существенную роль играют нарушения моторной активности пищеварительного тракта (гастроэзофагеальная рефлюксная болезнь, постпрандиальный дистресс-синдром как вариант функциональной диспепсии, язвенная болезнь с нарушением антродуоденальной координации, идиопатический гастропарез, функциональная тошнота, функциональный запор, а также синдром раздраженного кишечника — вариант с запором).
Во-вторых, применение прокинетиков в качестве противорвотных средств (например, при тошноте и рвоте, ассоциированных с приемом цитостатиков) [4].
В-третьих, диабетический гастропарез, при котором замедленное опорожнение желудка влияет на вариабельность всасывания глюкозы, что обусловливает трудности контроля гликемии и может привести к хронизации симптомов гастропареза и низкому гликемическому контролю. Сюда же следует отнести и назначение прокинетиков при гастропарезе другой этиологии [5].
Какие же препараты обладают прокинетической активностью?
Домперидон по своей химической структуре также относится к производным бензимидазола, является высокоселективным блокатором периферических допаминовых рецепторов (D) 2-го типа и в отличие от метоклопрамида лишен многих побочных эффектов ввиду отсутствия проникновения препарата через гематоэнцефалический барьер [6]. Подавляя влияние дофамина, домперидон увеличивает спонтанную активность желудка, увеличивает давление нижнего пищеводного сфинктера и активирует перистальтику пищевода и антрального отдела желудка. Препарат также усиливает частоту, амплитуду и продолжительность сокращений двенадцатиперстной кишки и уменьшает время пассажа пищевых масс по тонкой кишке.
Метоклопрамид. Метоклопрамид по своей химической структуре относится к подтипу бензамидов с несколькими прокинетическими механизмами (рис.): агонизм 5-гидрокситриптамин (НТ) 4-рецепторам, антагонизм по отношению к центральным и периферическим допамин (D) рецепторам 2-го типа, а также прямая стимуляция сокращений гладкой мускулатуры пищеварительной трубки [7].
Прокинетический эффект метоклопрамида ограничен верхними отделами пищеварительного тракта, он повышает тонус нижнего пищеводного сфинктера, усиливает моторику желудка и тонкой кишки, ускоряет опорожнение желудка, улучшает антродуоденальную координацию. Однако, наряду с доказанной эффективностью, назначение метоклопрамида ограничено развитием побочных эффектов [8] (около 30%), а именно экстрапирамидными расстройствами, головной болью, головокружением, сонливостью, депрессией и гормональными нарушениями: гиперпролактинемией с галактореей, гинекомастией, нарушениями менструального цикла.
Метоклопрамид и домперидон оказывают противорвотный эффект, который обусловлен подавлением активности хеморецепторных триггерных зон, расположенных на дне четвертого желудочка вне пределов гематоэнцефалического барьера. Однако способность действовать на аденогипофиз, также лишенный гематоэнцефалического барьера, способствует при длительном применении домперидона у части пациентов повышению уровня пролактина в сыворотке крови, приводящему к развитию гинекомастии, галактореи и аменореи. Следует подчеркнуть, что это нежелательное явление становится клинически значимым лишь при длительном применении препарата (например, если домперидон назначается у больных болезнью Паркинсона). Так, при применении домперидона в суточной дозе 80 мг (в течение 12 лет) частота нежелательных явлений не отличается от плацебо, при этом препарат переносится лучше, чем метоклопрамид в дозе 40 мг/сут [9]. Домперидон широко применяется в клинической практике как эффективный и безопасный прокинетик. Даже в странах с жесткими требованиями к отпуску безрецептурных средств этот препарат обычно продается без рецепта, например, в Германии он доступен при условии, что общая доза домперидона в упаковке не превышает 200 мг.
Итоприда гидрохлорид является одновременно антагонистом допаминовых рецепторов и блокатором ацетилхолинэстеразы. Препарат активирует освобождение ацетилхолина и препятствует его деградации, обладает минимальной способностью проникать через гематоэнцефалический барьер в центральную нервную систему, включая головной и спинной мозг. Метаболизм препарата позволяет избежать нежелательного лекарственного взаимодействия при приеме лекарственных препаратов, метаболизирующихся ферментами системы цитохрома Р450. Как показали экспериментальные и клинические исследования [10, 11], итоприда гидрохлорид усиливает пропульсивную моторику желудка и ускоряет его опорожнение. Кроме того, препарат оказывает противорвотный эффект, которой реализуется благодаря взаимодействию с D2-дофаминовыми хеморецепторами триггерной зоны.
Цизаприд — агонист 5-HT4-рецепторов с незначительной антагонистической активностью в отношении рецепторов 5-HT3, был отозван с рынка США в 2000 году в связи с многочисленными сообщениями о внезапной смерти (удлинение интервала Q-T, опасные желудочковые аритмии) [12]. В последующем были созданы препараты с аналогичным прокинетическим механизмом. Так, еще один агонист 5-HT4-рецепторов мозаприд продемонстрировал влияние на ускорение опорожнения желудка в исследованиях с участием здоровых добровольцев, а также в случаях диабетического гастропареза. В отличие от цизаприда, мозаприд оказывает незначительное влияние на активность каналов калия [13], в связи с чем имеет существенно меньший риск в отношении нарушений сердечного ритма. Прокинетическая активность другого препарата этой подгруппы — рензаприда обусловлена двумя механизмами: агонизмом с рецепторами 5-HT4 и антагонизмом по отношению к 5-HT3-рецепторам. К настоящему моменту уровень доказанности данных по эффективности и безопасности мозаприда и рензаприда не определен за недостаточностью данных. Тегасерод — агонист 5-HT4 пресинаптических рецепторов [14] с преимущественной стимуляцией перистальтической активности толстой кишки. Teгасерод улучшает консистенцию кала и способствует появлению позывов к дефекации у пациентов с хроническим запором. Однако согласно проведенным в 2007 году по инициативе FDA 29 рандомизированным, контролируемым исследованиям с коротким периодом наблюдения (1–3 месяца) тегасерод повышает риск кардиоваскулярных событий (в т. ч. стенокардии), в результате чего этот препарат был полностью изъят с американского фармацевтического рынка в апреле 2008 года. В настоящее время из препаратов этой подгруппы применяются также алосетрон и рамосетрон (антагонисты 5-HT3-рецепторов) с более хорошим профилем безопасности. Тем не менее окончательно говорить о высоком профиле безопасности средств этой подгруппы пока еще рано.
Бетанехол — агонист мускариновых рецепторов повышает давление нижнего пищеводного сфинктера, координирует сокращения дна и антрума, ускоряя опорожнение желудка [15]. Однако применение бетанехола ограничено только случаями рефрактерного к стандартной терапии гастропареза ввиду высокой частоты побочных эффектов: абдоминальная боль, бронхоспазм, дизурия, повышение артериального давления и пр.
Агонисты рецепторов мотилина. Полипептидный гормон мотилин вырабатывается в дистальном отделе желудка и двенадцатиперстной кишке, способствует повышению давления нижнего пищеводного сфинктера и повышает амплитуду перистальтических сокращений антрума, стимулируя опорожнение желудка. Антибиотик из группы макролидов эритромицин обладает прокинетической активностью как агонист рецепторов мотилина. Интересно, что эритромицин способствует опорожнению желудка и после ваготомии, а также после антрэктомии [16]. Однако в качестве прокинетика эритромицин вряд ли найдет свою терапевтическую нишу, и дело здесь не только в антибактериальном действии препарата. Эритромицин при длительном приеме (месяц и долее) в 2 раза повышает риск смертности, ассоциированной с нарушением сердечной проводимости [17]. Подобный эритромицину, хотя и менее выраженный эффект в отношении рецепторов мотилина был позднее описан и для других макролидов — азитромицина и кларитромицина. Однако, как и эритромицин, эти антибактериальные средства вряд ли когда-либо найдут применение в практике врача в качестве самостоятельных прокинетиков. Вместе с тем эти препараты дали толчок для синтеза новых молекул с агонистической активностью по отношению к рецепторам мотилина. Один из наиболее перспективных препаратов этой подгруппы — атилмотин [18] продемонстрировал влияние на ускорение опорожнения как жидкой, так и твердой пищи в исследованиях с участием здоровых добровольцев, а также у лиц с диабетическим гастропарезом. Изучение эффективности и безопасности длительного применения атилмотина, как и исследования по созданию новых средств-агонистов мотилина, продолжается. Так, в качестве одного из перспективных средств этой подгруппы прокинетиков изучаются эффекты грелина [19] — нейрогуморального нейротрансмиттера, секретируемого слизистой оболочкой желудка. Грелин относится к физиологическим стимуляторам моторики пищеварительного тракта и структурно связан с мотилином, оказывает прокинетическое действие с нормализацией эвакуации содержимого желудка у пациентов как с диабетическим, так и идиопатическим гастропарезом.
Исследователи продолжают активное изучение новых средств с направленной селективной прокинетической активностью [20], среди которых физостигмин и неостигмин — агонисты мускариновых рецепторов, стимулирующие деятельную активность кишечника и лишь незначительно улучшающие опорожнение желудка; ускоряющие желудочный транзит антагонисты рецепторов холецистокинина локсиглумид и декслоксиглумид, а также ингибитор фосфодиэстеразы-5 силденафил; альфа-2 агонист (адреномодулятор) клонидин, нормализующий эвакуацию содержимого желудка при функциональной диспепсии (постпрандиальный дистресс-синдром), замедляющий кишечный транзит со снижением висцеральной гиперчувствительности толстой кишки.
Широкий спектр показаний, при которых эффективно назначение прокинеков, а также особенности каждой из подгрупп прокинетиков (различные механизмы прокинетического влияния, профиль безопасности, преимущественная активность в отношении верхнего или нижнего этажа пищеварительного тракта) позволяют врачу в каждом клиническом случае выбрать наиболее эффективный и безопасный прокинетик.
По вопросам литературы обращайтесь в редакцию.
М. А. Ливзан, доктор медицинских наук, профессор
ГОУ ВПО «Омская государственная медицинская академия Росздрава», Омск
Артериальная гипертония – пожизненный прием препаратов?
Диагноз АГ обычно не ставится после однократного измерения давления, за исключением тех случаев, когда показатели слишком высоки, например, свыше 170-180/105-110 мм рт. ст. Обычно проводят серию измерений в течение определенного периода времени, чтобы полностью исключить случайные колебания и неточности. Необходимо также принимать во внимание и те обстоятельства, во время которых проводятся измерения артериального давления. Как правило, показатели давления увеличиваются под воздействием стресса, после крепкого кофе или выкуренной сигареты.
Интересен факт, что в кабинете врача при измерении давления показатели могут быть выше, чем в состоянии покоя, дома. Этот эффект называется «гипертонией белого халата» и вызван страхом пациента перед заболеванием или перед доктором. Кроме измерения артериального давления врач обычно проверяет изменения со стороны других органов, особенно если показатели давления находятся на уровне высоких цифр.
Если показатели давления у взрослого не превышают 140/90 мм. рт. ст., то повторное измерение обычно проводят не раньше, чем через год. У пациентов, чье давление находится в пределах от 140/90 до 160/100, проводят повторное измерение через небольшой промежуток времени для подтверждения диагноза.
Высокое диастолическое (нижнее) давление, например 110 или 115 мм.рт.ст., свидетельствует о необходимости немедленной терапии.
Артериальная гипертония чаще всего носит первичный характер и является симптомом гипертонической болезни. Реже повышенное артериальное давление вторично и является признаком заболеваний различных органов (почек, сосудов и др.). Каждое из этих заболеваний нуждается в специальном лечении, вот почему любое повышение артериального давления требует консультации врача-кардиолога.
Если же значения артериального давления превышают указанный уровень, то следует обсудить с врачом возможные причины недостаточной эффективности проводимого лечения. Среди них:
Как показывает практика, при доверии пациента к своему лечащему врачу, при грамотном взаимодействии врача и пациента, в большинстве случаев удается контролировать это грозное заболевание.
А что, если Вы уже принимаете 3 или больше препаратов, а давление так и не стабилизировалось на целевом уровне? Подобная форма гипертонии относится к резистентной.
Каков же выход?
Обычно в случае резистентной (рефрактерной) гипертонии врачи продолжают увеличивать дозы принимаемых пациентом препаратов до максимально переносимых или добавляют последовательно четвертый, пятый, иногда и шестой препарат из других групп. Пациенты реагируют на это по-разному. Многие перестают доверять врачу, некоторые отказываются от приема препаратов совсем, потому что не отмечают никакой разницы между давлением на фоне приема горстей препаратов, и без них.
Конечно же, это решение ошибочно в корне. Для того чтобы избежать прогрессирующего поражения органов-мишеней и грозных осложнений в будущем, продолжать прием препаратов необходимо даже в случае, если достичь целевого уровня АД не удается. Но, никто не будет отрицать, использование многокомпонентной комбинации препаратов значительно увеличивает риск развития побочных эффектов и непредсказуемых реакций взаимодействия препаратов между собой.
Что современная медицина может предложить в этом случае? Оказывается, есть выход.
В скором времени в нашей клинике мы будем иметь возможность предложить нехирургический метод коррекции АД путем денервации почечных артерий. Новая процедура, катетерная почечная денервация почечных артерий, помогает контролировать высокое кровяное давление путем деструкции части нервных волокон, расположенных в стенке почечных артерий.
Как нередко бывает, идея денервации не нова, это хорошо забытое старое. Хирургам давно было известно, что иссечение симпатических нервных волокон, ответственных за поддержание артериального давления, приводило к снижению артериального давления. Но процедуру нельзя было применять для лечения АГ, так как она сопровождалась высокой операционной смертностью и такими долгосрочными осложнениями как тяжелая гипотония при переходе в вертикальное положение, вплоть до потерь сознания, нарушений функции кишечника и тазовых органов. Но так бывает потому, что полностью выключается симпатическая стимуляция почек и других органов, что приводит к дисбалансу нервной регуляции. Поскольку симпатические нервные волокна, иннервирующие почку, проходят непосредственно в стенке главной почечной артерии и прилежат к ней, то с помощью катетерной радиочастотной абляции (РЧА) прицельное разрушение волокон в почечных артериях не приведет к нарушению иннервации органов брюшной полости и нижних конечностей. Кроме того, разрушая лишь небольшую часть нервных окончаний в почечных артериях, почки не лишаются нервной регуляции. ПРИЧИНА РЕЗИСТЕНТНОЙ ГИПЕРТОНИИ В ИЗБЫТОЧНОЙ СИМПАТИЧЕСКОЙ АКТИВНОСТИ ПОЧЕК. А катетерная РЧА позволяет устранить эту избыточную активность. ГИПЕРТОНИЯ СТАНОВИТЬСЯ УПРАВЛЯЕМОЙ.
Введение этой процедуры в нашу практику базируется на исследовании, опубликованном в знаменитом журнале Lancet, которое показало безопасность и эффективность методики, позволяющей достигнуть стойкого снижения артериального давления до 30 мм. рт. ст. от исходного уровня.
Для подобного лечения используется радиочастотный катетер фирмы Ардиан, который вводится через прокол в бедренной артерии. Далее катетер проводится под рентгеновским контролем в почечную артерию. Через кончик катетера радиочастотная энергия дозировано подается по окружности в 4-5 точках почечных артерий. Процедура занимает около 40 мин, после чего катетер удаляется. Длительность пребывания пациента в стационаре составляет 24 ч. Условием для проведения процедуры является нормальная функция почек. Но самое поразительное в процедуре то, что со временем лечебный эффект не только не уменьшается, а наоборот, артериальное давление у большинства плавно и стойко нормализуется.
В настоящее время почечную денервацию применяют только у пациентов с резистентной гипертензией. Это должно привести, примерно, к 50-процентному снижению числа осложнений и смертности, связанных с АГ. Это не означает, что препараты больше не нужны. Пациентам все равно, скорее всего, придется принимать лекарства от высокого давления, но количество препаратов для поддержания артериального давления на целевом уровне, значительно снизится.
Каковы побочные эффекты метода РЧА почечных артерий?
На сегодняшний день во всем мире не отмечено никаких серьезных осложнений катетерной почечной денервации. Процедура сопровождалась умеренной болью в животе, которая была купирована внутривенным введением анальгетиков и седативных средств. Только у одного больного отмечено повреждение почечной артерии катетером до РЧА, устраненная имплантацией стента. Наиболее распространенным осложнением у незначительного числа пациентов была болезненность и припухлость в области паха. Ухудшения функции почек не отмечено.
Кому необходимо проводить почечную денервацию?
Даннное вмешательство показано пациентам с резистентной АГ, т.е. при стойком повышении систолическоого (верхнего) артериального давления выше, чем 160 мм рт. ст., несмотря на применение 3 и более антигипертензивных препаратов, включая диуретик. Это особенно показано при плохой переносимости комбинации препаратов или при наличии побочных эффектов. При этом пациенты должны быть предварительно обследованы, у них должны быть надежно исключены возможные вторичные причины артериальной гипертензии (например, заболевания надпочечников). На предварительном этапе обязательно проведение компьютерной томографии почечных артерий для уточнения анатомических особенностей сосудов.
Лечение рака кишечника
Рак толстого кишечника представляет собой опухоль, возникающую в оболочках толстой и прямой кишки. Это заболевание также называют колоректальным раком (от лат. colon – толстая кишка и rectum – прямая кишка). Ежегодно в России регистрируют около 50 000 случаев рака этого типа¹. В группе риска находятся люди, склонные к воспалительным заболеваниям кишечника, хотя это и не единственный фактор, увеличивающий вероятность развития болезни.
Прогноз
Симптомы у мужчин и женщин
Симптомы рака кишечника у мужчин и женщин практически не отличаются, но существует несколько нюансов, о которых следует знать, чтобы вовремя заподозрить наличие новообразования.
Общие начальные признаки колоректального рака включают:
Появление этих симптомов нельзя игнорировать: своевременное обращение к врачу может сохранить здоровье и жизнь пациенту. Однако перечисленные выше жалобы – не стопроцентное основание для установки диагноза колоректального рака, хотя они и свидетельствуют о развитии патологического процесса, который важно вовремя диагностировать. Фактором риска развития рака кишечника могут стать хронические заболевания ЖКТ.
По мере развития заболевания клиническая картина усугубляется. На фоне сужения просвета кишечника новообразованием каловые массы уменьшаются в диаметре (чаще всего становятся лентообразными), в них может появляться кровь. Помимо этого, возникают и другие симптомы:
Особенности у мужчин
У мужчин новообразования чаще всего возникают в прямой кишке, что может затруднить своевременную диагностику. Это связано с тем, что признаки рака прямой кишки во многом напоминают клиническую картину геморроя. Наиболее характерные симптомы – боль в заднем проходе и появление примесей крови в кале.
Сам по себе геморрой уже является предпосылкой к развитию рака прямой кишки. Поэтому если у пациента, страдающего геморроем, к привычной клинической картине присоединяются такие симптомы, как нестабильный стул, слабость, продолжительное повышение температуры, дискомфорт в брюшной полости, изменение консистенции и формы кала, следует без промедления обратиться к специалисту.
При метастазировании у мужчин часто поражается предстательная железа, что проявляется болезненным мочеиспусканием, снижением либидо, изменением цвета мочи.
Особенности у женщин
У женщин чаще всего поражается ободочная кишка. Риск возникновения новообразования существенно возрастает после менопаузы (то есть после 50 лет). Если у мужчин одной из главных предпосылок к развитию рака кишечника считается геморрой, то у женщин опухоли чаще возникают как результат перерождения кишечных полипов.
Помимо уже описанных симптомов, характерных для колоректального рака, у женщин при раке может отмечаться нарушение менструального цикла.
При метастазировании у женщин часто поражается мочевой пузырь, что может привести к формированию ректовагинального свища (проход между влагалищем и прямой кишкой). Это, в свою очередь, приводит к появлению кала в моче. Отмечаются сильные боли в кишечнике, которые нередко отдают в область прямой кишки.
Стадии заболевания
При определении стадии колоректального рака специалисты руководствуются такими критериями, как величина новообразования и распространенность метастазов – они бывают регионарными (располагаются в пределах той же анатомической области) и отдаленными (рис. 1).

Всего различают 5 стадий болезни, включая нулевую. Некоторые из стадий имеют несколько этапов развития:
Чаще всего рак кишечника дает метастазы в брюшину, печень и легкие. При метастазировании 5-летняя выживаемость составляет не более 14%, но в том случае, если больной проходит химиотерапию. При отсутствии лечения он сможет прожить не более полугода.
Лечение
Основные методы лечения при раке кишечника:
Отдельно стоит выделить химиотерапию, так как это одно из наиболее активно развивающихся направлений.
Помимо обычной химиотерапии сегодня успешно используют биологические методы борьбы с раком, использующие искусственно синтезированные антитела: бевацизумаб, цетуксимаб и панитумумаб. Эти антитела созданы для того, чтобы, попав в организм, специфически связаться с рецепторами на поверхности раковых клеток. В результате собственный иммунитет человека начинает «видеть» эти клетки и эффективно справляется с опухолью.
Терапию с использованием антител чаще всего сочетают с другими препаратами таргетной иммунохимиотерапии.
Рак кишечника у беременных
У беременных женщин колоректальный рак встречается крайне редко: примерно в 0,05% случаев³. Клинические проявления различаются в зависимости от анатомического расположения опухоли. Как правило, симптомы могут быть связаны либо с непроходимостью толстой кишки, либо с анемией, вызванной желудочно-кишечным кровотечением.
Сложность ситуации в том, что подобные симптомы могут возникать и при здоровой беременности из-за происходящих физиологических изменений. Колоректальный рак у беременных может сопровождаться потерей веса, анорексией, тошнотой/рвотой и симптомами, связанными с нарушением функции печени (желтуха и асцит).
Пациентки с правосторонними поражениями кишечника редко жалуются на обструктивные изменения (непроходимость). Намного чаще отмечается слабость, одышка при физической нагрузке, учащенное сердцебиение и быстрая утомляемость.
Поражения левой части толстой кишки часто чреваты сужением просвета кишечника, поэтому у беременных могут отмечаться изменения в работе кишечника (чаще всего — запоры или изменение объема и диаметра каловых масс). По мере прогрессирования сужения могут возникать диарея и учащенные позывы к дефекации.
Также отмечаются такие признаки, как кровотечение из прямой кишки, тенезмы (болезненные ложные позывы к опорожнению кишечника) и схваткообразная боль в животе. При развитии метастазов могут наблюдаться потеря веса, анорексия, одышка (метастазы в легких), желтуха (метастазы в печени) и боль в эпигастральной области из-за распространения опухоли на соседние органы.
Одной из главных предпосылок к развитию колоректального рака у беременных считаются кишечные полипы, которые медленно увеличиваются в размерах, становятся диспластическими и перерастают в опухоль (рис. 2). Кишечные полипы могут стать злокачественными в течение нескольких лет.
У будущей матери риск рака повышается в результате повышенной выработки эстрогена и прогестерона – их избыток может привести к нарушению синтеза белка р53, который является супрессором злокачественных новообразований (проще говоря, этот белок подавляет мутацию генов, чреватую развитием рака)³.
Можно ли сохранить беременность при раке кишечника?
При выявлении опухоли кишечника в первом триместре рекомендуется прерывание беременности и хирургическое лечение. Во второй половине беременности при операбельности новообразования назначается хирургическое лечение и родоразрешение посредством кесарева сечения.
Несмотря на то, что риск развития кишечных новообразований у беременных очень низок, женщинам с отягощенной наследственностью при появлении описанных выше симптомов лучше перестраховаться и проконсультироваться со специалистом.
Диагностика рака кишечника
В первую очередь врач собирает анамнез (историю болезни). Особое внимание следует уделить вопросам наследственности, поскольку примерно у 5% больных раком кишечника есть близкие родственники, страдавшие от онкологических заболеваний и полипоза толстой кишки2.
Диагностические мероприятия при раке кишечника включают:
1. Физикальный осмотр и ректальное пальцевое исследование.
2. Общий анализ крови на предмет анемии, ускоренной СОЭ и лейкоцитоза (последние 2 признака неспецифичны, так как отмечаются при любых воспалительных явлениях в организме).
3. Коагулограмма. Проводится для определения повышенной свертываемости крови.
4. Биохимический анализ крови выявляет онкомаркеры РЭА, СА 19.9.
5. Ректороманоскопия. Эта диагностическая процедура помогает исследовать прямую кишку и провести биопсию (забор образца тканей для гистологического исследования). Исследование умеренно болезненное и обычно занимает не более 10 минут.
6. Колоноскопия. Этот метод диагностики является приоритетным, поскольку позволяет не только определить локализацию и размер опухоли, но и сделать биопсию. Один из самых надежных и информативных методов.
7. МРТ органов малого таза. Это безболезненный метод трехмерной визуализации.
8. УЗИ брюшной полости и забрюшинного пространства.
9. Биопсия. Забор тканей для гистологического исследования, может проводиться отдельно при подозрении на метастазы 2.
Скрининг рака толстой кишки способствует выявлению заболевания на ранних стадиях, что помогает существенно улучшить прогноз. Для этого проводятся анализы кала на скрытую кровь, и если их результаты укрепят врача в подозрениях относительно развития опухоли в кишечнике, назначается инструментальный метод исследования – фиброколоноскопия.
Причины колоректального рака
Патогенез (механизм развития болезни) колоректального рака сейчас окончательно не выяснен и является предметом споров в научных кругах. Однако в вопросах, касающихся факторов риска, специалисты уже пришли к общему мнению. Среди них сегодня называют:
Виды колоректального рака
Рак кишечника классифицируется по нескольким критериям: по клинической и макроскопической картине, по месту локализации и по гистологическим признакам.
В зависимости от клинической картины различают:
По макроскопической картине колоректальный рак бывает:
В зависимости от локализации рак кишечника делят на:
По гистологическим признакам колоректальный рак делят на:
У пациентов с хроническими заболеваниями ЖКТ нередко развивается доброкачественное новообразование — аденома кишечника. Главная опасность таких опухолей в том, что они имеют свойство перерождаться в злокачественные новообразования.
У доброкачественных новообразований существует отдельная классификация²:
Профилактика
Лучшая терапия – это профилактика, основой которой являются регулярные обследования. Людям старше 50 лет или пациентам, уже перенесшим рак кишечника, рекомендуется проведение систематических осмотров с применением колоноскопии. Так можно предотвратить 90% случаев раковых заболеваний кишечника. При этом в наше время данная процедура стала куда менее травмирующей. Обследование и удаление полипов можно пройти под «мягким» наркозом (седацией), абсолютно безболезненно.
Чтобы снизить риск вероятности развития рака кишечника, необходимо также минимизировать факторы риска:
Заключение
Колоректальному раку в большей степени подвержены взрослые люди старше 50 лет, а также пациенты с полипозом кишечника в анамнезе. Соблюдение мер профилактики и своевременная диагностика помогут сохранить жизнь и здоровье. На ранних стадиях болезни прогноз обычно благоприятный.



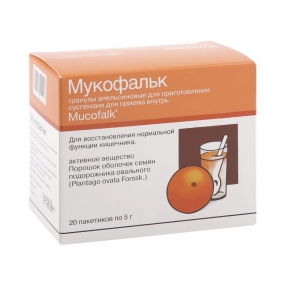











.png)