Препарат за 150 миллионов рублей что это
Укол за 150 миллионов. Инъекция спасительна, но цена неподъемна
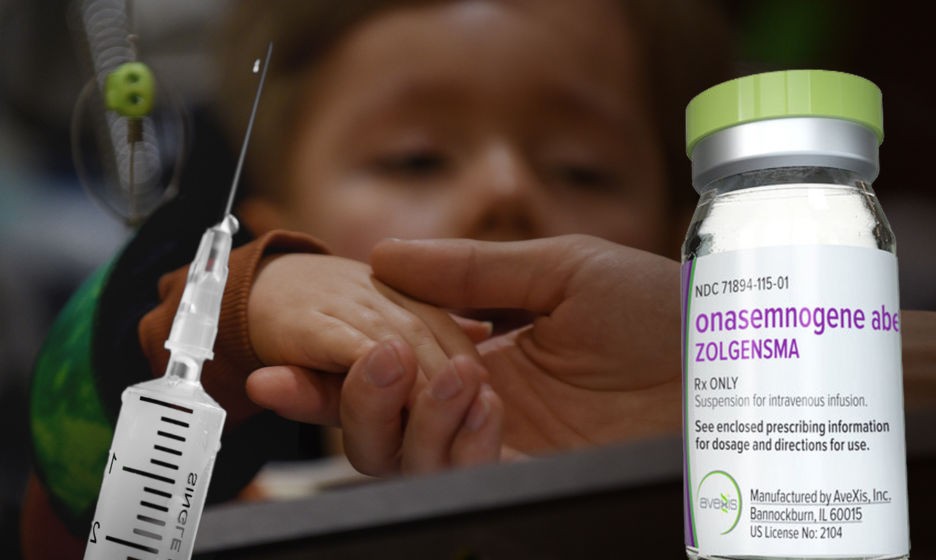
Появление нового революционного лекарства дало надежду на полное выздоровление детям со СМА по всему миру. Для того, чтобы лекарство начало действовать, нужна только одна инъекция. Однако вместе с подготовкой к введению инъекции и последующей реабилитацией общая стоимость лечения составляет более 150 миллионов рублей.
Без волшебников не обойтись
Уже двум детям из России – Кате Рубцовой и Диме Тишунину – необходимая сумма была собрана. Кате всю сумму оплатил анонимный «волшебник» – так родители назвали неизвестного жертвователя. Диме собирали деньги всем миром, была проделана огромная работа, к которой подключились десятки волонтеров. Половину суммы оплатил неизвестный донор. Родители других детей, изучив все возможные варианты, также приняли решение собирать деньги на «Золгенсма».
Большинство фондов, узнав сумму, отказывают в помощи, поэтому сбор приходится вести на личные карты, что для многих жертвователей является сомнительным. Но у родителей другого выхода нет. Они обращаются к власти с петициями, где просят обратить внимание на их проблему, но деньги надо собирать быстро, так как с каждым днем их детям становится все хуже.
Почему есть препараты, которые стоят таких огромных денег? Из чего складывается эта цена? Есть мнение, что общество подходит к новой страшной реальности – с каждым годом будут появляться лекарства от заболеваний, которые раньше считались неизлечимыми, но стоимость их будет абсолютно неподъемной. Так ли это? На эти и другие вопросы «Правмиру» ответил директор научно-исследовательского центра «Герофарм», кандидат медицинских наук Роман Драй.
Пациент платит за неудачу фармкомпаний
Стоимость препарата обычно складывается из стоимости клинических исследований (это главные траты) и себестоимости производства. Также многие фармкомпании в себестоимость закладывают не только разработку данного препарата, но и все неудавшиеся разработки других лекарств для этой же болезни. То есть на рынок выходит только один препарат, но деньги закладывались на несколько попыток, в том числе и неудачных. Хотя политика ценообразования у каждой компании, конечно, разная.
Еще лет 20-30 назад почти все лекарства были химическими. Сейчас все больше лекарств производится благодаря биотехнологиям (то есть с использованием живых организмов и биологических процессов), что тоже намного дороже. Генная терапия – это новейший вид лечения, и он только набирает обороты. Сравнительно недавно начались клинические исследования в области генной терапии, и совсем небольшое количество препаратов во всем мире были одобрены и вышли на рынок.
Важно понимать, что пока они разработаны только для смертельных заболеваний, когда польза применения превышает риск.
Проще говоря, если больной не применит этот препарат, он точно умрет. А если применит – то выживет, хотя, возможно, и с какими-то нежелательными последствиями и реакциями для организма.
В случае «Золгенсма» идет серьезная нагрузка на печень. Если есть какой-то другой выбор, то генную терапию назначать не будут из-за нежелательных реакций. Насколько я знаю ситуацию, надо лечение СМА надо начинать как можно раньше, но и с одобренным в нашей стране препаратом «Спинраза» сейчас большие проблемы: препарат не выдают, и время уходит.
Хочешь жить – плати миллионы
И все же, если препараты генной терапии и дальше будут стоить таких денег, как, например, «Золгенсма», то это тупик. Для меня все равно остается загадкой, почему цена столь высока. Если это за счет технологии, то есть себестоимость производства высока, то у генной терапии тогда просто нет будущего – я не представляю, как люди смогут покупать его. Никакие лекарства не могут так стоить. Поэтому, на мой взгляд, должен быть какой-то прорыв в самой технологии.
Если же представители компании, назначая такую цену, как бы хотят сказать «за жизнь надо платить», тогда хотя бы понятно, что разработчики «отбивают» не клинические исследования и не производство препарата, а просто зарабатывают деньги. Насколько это приемлемо с этической точки зрения? Каждый решает для себя сам. Но я прекрасно понимаю, что собирать такие суммы на каждого ребенка всем миром просто нереально.
Это уже не краудфандниг, а… краудтритмент (crowdtreatment) — придется вводить такой новый термин). То есть это не сбор денег с миру по нитке, это уже лечение всем миром.
Я позволю себе представить некоторую утопию о том, как можно решить ситуацию. Первый этап — в России реально есть люди, которые могли бы помочь всем больным детям СМА сразу (на данный момент это около 800 зарегистрированных пациентов, и, чтобы их вылечить, нужно порядка 120 млрд рублей). Это группа людей, которые обладают реальными финансовыми ресурсами и реальной властью.
Понимаю, что звучит это маловероятно, но можно было бы договориться с ними со всеми и собрать эту сумму, если продать ее, например, как идею «программы искоренения СМА в России». Далее – введение скрининга на наличие СМА. Исследования показывают, что ранняя диагностика и начало лечения улучшают прогноз для пациентов со СМА. Третий этап — разработка аналога Золгенсма или оригинального отечественного лекарства.
Мы можем создать аналог не хуже
Уже сейчас несколько фармкомпаний в России потенциально могут заняться разработкой препарата против СМА. У любых лекарств есть определенный срок действия патента — в среднем около 15-20 лет. Как только патент заканчивается, на рынок приходят другие компании. Они делают дженерики, если это химические препараты, и биосимиляры, если это биотехнологические препараты. Они вкладывают гораздо меньшие деньги в разработку, клинические исследования. Их инвестиции гораздо меньше, чем у компании-разработчика, поэтому конечная стоимость воспроизведенного препарата будет меньше на 30, 40, а иногда и на 90 процентов.
Сама компания-разработчик, скорее всего, прекратит производство этого продукта и займется новыми препаратами. Такая практика необходима, чтобы все люди могли иметь доступ к инновационной терапии. В противном случае только богатые люди смогут получать новые виды лечения.
Нам, в России, нужна технология производства подобных лекарств. Любой препарат разрабатывается 7-10 лет. На мой взгляд, все реально.
Еще несколько лет назад мы не знали, как подступиться к биотехнологиям, сейчас в России фармацевты могут воспроизвести любой препарат. Когда-нибудь патент на «Золгенсма» закончится, и можно сделать его копию или разрабатывать инновационный препарат. В любом случае, технологию генной терапии нужно развивать уже сейчас.
Что такое Золгенсма. Главное — о самом дорогом в мире лекарстве
Что такое спинальная мышечная атрофия?
Существует несколько типов СМА в зависимости от тяжести заболевания. При СМА I типа (примерно 50% случаев) проявления наступают в первые месяцы жизни. СМА II-IV типа проявляются позднее и протекают несколько легче. Помимо гена SMN1, у большинства людей есть также ген SMN2. Часть продукта SMN2 дублирует функции SMN1, но большая часть этого белка нефункциональна. Если у человека несколько копий гена SMN2, то тяжесть СМА обычно легче, но не всегда.
По данным регистра пациентского фонда «Семьи СМА» в России более 900 пациентов со СМА, однако если экстраполировать данные других стран, их должно быть примерно 2500-3500, то есть налицо недостаточная диагностированность населения. Ситуация будет изменяться по мере внедрения пренатального скрининга и генной диагностики.
Что такое Золгенсма?
Золгенсма – это препарат генной терапии для лечения спинальной мышечной атрофии (СМА) с мутациями в обоих аллелях (вариантах, полученных от мамы и папы) гена SMN1 (94% пациентов с СМА). В США препарат одобрен у пациентов в возрасте до двух лет. Он представляет собой нормальную копию гена SMN1, встроенную в геном специального вируса (аденоассоциированный вирус 9 серотипа, AAV9).
Препарат вводится пациенту внутривенно один раз. AAV9 хорошо проникает в клетки многих органов и тканей, включая моторные нейроны, которые более всего страдают при СМА. ДНК вируса практически не встраивается в геном клетки, а находится в ядре в виде отдельной молекулы, что повышает безопасность терапии с точки зрения генотоксичности. В клетках начинает производиться нормальный белок SMN1, что должно благоприятно влиять на течение болезни.
Какое лечение существовало до появления Золгенсмы?
До одобрения Золгенсмы единственным препаратом, нацеленным на причину болезни, была Спинраза, одобренная в США в конце 2016 года. Она представляет собой относительно небольшую молекулу, которая способствует производству полностью функционального белка SMN2. Таким образом, у пациентов с геном SMN2 производится белок, дублирующий функции дефектного SMN1.
В клиническом исследовании у детей до двух лет, которое стало основанием для одобрения препарата, 61% детей были живы и независимы от постоянной вентиляции легких (32% — в контрольной группе). Улучшение моторных навыков наблюдалось у 51% пациентов (и ни одного в группе контроля). У детей 2-12 лет среднее улучшение через 15 месяцев терапии составило 3,9 пунктов по шкале моторных навыков, в то время как в контрольной группе наблюдалось ухудшение в среднем на 1 пункт.
Наиболее частыми нежелательными явлениями, ассоциированными со Спинразой, были инфекции дыхательных путей и запоры. Также наблюдался повышенный риск тромбоцитопении, нарушений свертывания крови и почечной токсичности.
В России Спинраза была зарегистрирована в начале 2019 года, благодаря программе расширенного доступа около 40 пациентов получили препарат от компании Biogen бесплатно. Сейчас далеко не все нуждающиеся в препарате его получают.
Какие клинические исследования были проведены с Золгенсмой?
На момент одобрения FDA (Управление по надзору за качеством пищевых продуктов и медикаментов США) в мае 2019 года были доступны данные по 36 пациентам с СМА I типа в возрасте от 0,5 до 7,2 месяцев. Из них трое получили низкую дозу препарата, а 33 – высокую. Из получивших высокую дозу 31 пациент на момент одобрения (4-28 мес. после начала терапии) не нуждался в постоянной вентиляции легких. 19 пациентов, получивших высокую дозу, были способны сидеть без поддержки. Это очень хорошие результаты, потому что без лечения в живых к этому моменту осталось бы примерно 8-9 пациентов, и сидеть не мог бы никто. По обновленным данным, опубликованным в сентябре 2019 года, максимальный срок наблюдения за пациентами составил 4,6 лет, некоторые из них начинают самостоятельно стоять и ходить.
Важно отметить, что чем раньше было начато лечение, тем лучше результаты. Так, все пациенты, которые хорошо ответили на лечение, были пролечены в возрасте до 4 месяцев. У тех, кто начал терапию позднее, результаты сопоставимы с теми, кто получал Спинразу.
Компания также ведет исследование на пациентах, у которых симптомы еще не наступили, они получили терапию в течение 6 недель после рождения. Все 22 пациента живы, не нуждаются в постоянной вентиляции легких и начинают стоять и ходить, что было бы невозможно при естественном течении болезни.
Наиболее частыми нежелательными явлениями были рост печеночных ферментов и рвота. В одному случае у пациента наблюдалось острое повреждение печени.
В чем разница Спинразы и Золгенсмы?
Что у Золгенсмы с исследованиями на животных?
Исследования эффективности терапии проводились на мышах и свиньях. Было показано, что применение Золгенсмы приводит к улучшению моторных функций, нейромышечной проводимости, сердечной функции. Повышенные дозы Золгенсмы приводили к сердечной и печеночной токсичности.
В середине 2019 года компания Novartis, обладающая правами на Золгенсму, сообщила FDA, что часть данных на животных была подделана и этот факт компания скрыла при подаче документов на одобрение. Novartis обнаружила факт манипуляции за два месяца до подачи на одобрение, но решила не уведомлять о манипуляциях FDA, чтобы не задерживать одобрение препарата. Из ответа FDA ясно, что такая задержка бы действительно произошла, но сейчас одобрение отозвано не будет, потому что данные, с которыми производилась манипуляция, касаются предыдущей версии препарата и, таким образом, не влияют на эффективность и безопасность терапии, вышедшей на рынок.
В октябре 2019 года также стало известно, что при введении животным в спинной мозг Золгенсма может вызвать воспаление ганглиев дорсальных корешков. У людей такого эффекта пока не наблюдалось, но FDA на всякий случай приостановило текущее исследование по интратекальному введению Золгенсмы у пациентов старше 2 лет.
Какие еще препараты находятся в разработке?
Основной конкурент Золгенсмы и Спинразы – препарат Риcдиплам компании Roche: по нему опубликованы клинические данные, на основании которых компания подала на регистрацию в FDA. Согласно имеющимся данным, эффективность препарата превосходит эффективность Спинразы, и лишь немного уступает Золгенсме. Так, из 17 принимавших препарат пациентов через 12 месяцев в живых осталось 15. Пероральный прием и потенциально менее высокая стоимость (так как это низкомолекулярный препарат, а не вирусная конструкция) делает Рисдиплам привлекательной опцией для пациентов.
Профиль нежелательных явлений в исследованиях Рисдиплама в целом соответствовал тому, что можно ожидать для пациентов такого возраста, поэтому пока он проявляет себя как достаточно безопасный.
Подача документов на регистрацию Ридисплама в России ожидается в первом квартале 2020 года.
Ряд других препаратов находится на более ранних стадиях исследований.
Сколько стоят препараты?
Novartis исходила из того, что уже через 5 лет стоимость лечения Спинразой превзойдет стоимость Золгенсмы. Однако надо заметить, что период наблюдения за пациентами пока слишком мал, чтобы говорить о долговременном превосходстве Золгенсмы. Компания готова сотрудничать с государственными и частными страховыми системами в разных странах над схемами оплаты препарата, чтобы сделать его доступным для пациентов.
В декабре 2019 Novartis объявила, что раздаст 100 доз Золгенсмы бесплатно, используя принцип лотереи. Европейское пациентское сообщество SMA Europe подвергло компанию критике, упрекнув в неэтичности такого решения. Компания начала работу над улучшением выбранного подхода.
Материал подготовлен в рамках совместного проекта с сайтом о науке «Биомолекула«
Автор благодарит Ольгу Германенко, учредителя и директора фонда «Семьи СМА» за помощь в работе над текстом
Лекарство за два миллиона долларов. Почему лекарство от спинальной мышечной атрофии стоит так дорого
В последнее время внимание СМИ привлекла история сбора денег на лечение мальчика со спинальной мышечной атрофией. Целевая сумма составила 168 млн рублей, что соответствует стоимости одной инъекции препарата «Золгенсма» – 2,1 млн долларов США. Популярный рэп-музыкант Алишер Моргенштерн сделал существенный вклад в сбор средств, а также активно призывал своих поклонников жертвовать деньги на лечение. В середине сентября нужная сумма была собрана. Если оставить за скобками мотивы благотворительности эпатажного рэпера, остается несколько вопросов: почему лекарственный препарат стоит так запредельно дорого, должно ли государство оплачивать лечение в таких случаях и оправданно ли это? Попробуем разобраться с возможными ответами.
Чем лечится спинальная мышечная атрофия
Спинальная мышечная атрофия (СМА) — редкое генетическое нейромышечное заболевание, приводящее к потере двигательных нейронов, прогрессирующему истощению мышц и сопутствующим проблемами с движением. Это серьезная болезнь, которая со временем усугубляется: слабость конечностей, трудности при сидении, ползании или ходьбе, подергивание или дрожание мышц (тремор), проблемы с костями и суставами (сколиоз), затрудненное глотание и дыхание вплоть до необходимости механической вентиляции легких. При этом СМА не влияет на интеллект и не приводит к нарушениям обучаемости.
СМА делят на четыре типа, первые три диагностируют у детей младше 6 месяцев, между 7 и 18 месяцами и после 18 месяцев; четвертый тип поражает взрослых и обычно вызывает только легкие проблемы. В прошлом дети с заболеванием 1 типа редко проживали дольше первых нескольких лет. Но в последние годы, благодаря ранней диагностике и лечению, результаты улучшились. Большинство детей с типом 2 доживают до взрослого возраста и могут жить долго и полноценно. Типы 3 и 4, как правило, не влияют на продолжительность жизни. Заболеваемость СМА составляет приблизительно 1 на 11 000 живорожденных, причем доминирует СМА типа 1. В США насчитывается 10–25 тыс. больных СМА, в странах ЕС — 21–25 тыс., в России — предположительно, 2–3 тыс.
Если исключить неэффективную поддерживающую терапию, то для лечения спинальной мышечной атрофии есть лишь три препарата.
«Спинраза» (нунинерсен) — первое лекарство, одобренное FDA для применения детьми и взрослыми в 2016 году. Разработчиком является американская интернациональная биотехнологическая компания Biogen Inc. «Спинраза» с 2017 года также разрешена к применению в ЕС; в России — с 2019 года (ЛП-005730-160819). Активный компонент «Спинразы» представляет собой антисмысловой олигонуклеотид, действующий на гены выживаемости двигательных нейронов (SMN2, от Survival Motor Neuron), который вводят в спинномозговую жидкость инъекционно. За первым введением должны последовать еще три инъекции — через 2, 4 и 9 недель, а затем по дозе раз в 4 месяца. Терапию продолжают до тех пор, пока пациент получает от нее пользу. Цена «Спинразы» в США составляет 133 тыс. долларов за одну инъекцию, а стоимость лечения — 750 тыс. долларов за первый год терапии и по 375 тыс. долларов ежегодно в последующие годы.
«Эврисди» (рисдиплам) — первый пероральный препарат для лечения СМА, одобренный FDA августе 2020 года для лечения пациентов старше двух месяцев. В тот же год зарегистрирован в РФ (ЛП-006602-261120). Это разработка американской биотехнологической корпорации Genentech, Inc., входящей в состав F. Hoffmann-La Roche AG. «Эврисди», в отличие от «Спинразы», — это малая гетероциклическая молекула, которая выступает модификатором сплайсинга РНК, направленного на выживание SMN2. Препарат используют ежедневно и пожизненно. Годовая стоимость начинается с менее 100 тыс. долларов, а предельная достигает 340 тыс. долларов, в зависимости от массы тела пациента.
Таким образом, болезнь можно излечить и обратить вспять патологические изменения, сделав всего одну внутривенную инфузию. «Золгенсма» — самое дорогое лекарство в мире, цена составляет 2,125 млн долларов. Эту сумму помогал собирать Моргенштерн.
Ценообразование и Big Pharma
Выяснить причину непомерной стоимости попыталось интернет-издание FactChecker, основываясь на общении с врачами и заявлениях представителей компании Novartis. В первую очередь главной проблемой называют мизерный размер потенциального рынка. СМА встречается редко, поэтому необходим узкоспециализированный препарат — чем меньше случаев заболевания, тем выше будет его цена. Кроме того, «Золгенсма» вводится однократно.
«Оптовая стоимость приобретения (WAC) препарата „Золгенсма“ составляет 2,125 млн долларов — менее 50% от десятилетней стоимости текущей стандартной терапии хронической СМА в США и находится в пределах пороговых значений экономической эффективности для редких заболеваний, используемых Институтом исследований экономической эффективности. Ожидается, что со временем препарат сэкономит расходы системы здравоохранения на лечение и уход за пациентами со СМА. Мы налаживаем гибкие партнерские отношения с плательщиками, чтобы обеспечить доступность и приемлемую стоимость», — сообщил изданию FactChecker международный представитель компании Novartis.
Также он отметил, что окончательные решения о ценообразовании и возмещении расходов принимаются на местном уровне.
Согласно исследованию, опубликованному в 2016 году в журнале Journal of Health Economics, на создание одного нового лекарства уходит около 2,6 млрд долларов и более 10 лет. Только 14% лекарств, проходящих клинические испытания, в конечном итоге получают одобрение FDA, поскольку значительная часть испытаний не завершается успехом, как показало исследование Массачусетского технологического института (MIT). Исследователи из MIT и Института онкологии Дана — Фарбера предложили финансировать покупку дорогостоящих лекарств с помощью аналога ипотеки, чтобы пациенты могли платить в рассрочку при условии, что препарат работает.
С учетом большой вероятности неудачи компаниям-разработчикам приходится полагаться на малое количество успешных препаратов для того, чтобы компенсировать расходы и иметь возможность вкладываться в новые исследования. Кроме того, выпущенные на рынок лекарства сталкиваются с продукцией конкурентов, что ведет к снижению цены. Особенно мощное влияние оказывают препараты-дженерики, массово появляющиеся после окончания срока действия патента.
Рассчитано, что после появления 5–6 дженериков цены на такие препараты снижались примерно на 95%.
Кроме того, в РФ компанией BIOCAD разрабатывается отечественный аналог «Золгенсма» — ANB-4, с аналогичным механизмом действия. Однако неизвестно, когда завершатся испытания препарата, пройдут ли они успешно и сколько будет стоить новое лекарство для конечного потребителя. По весьма оптимистичным оценкам, ANB-4 может выйти на рынок через 3–5 лет.
Обоснование высокой цены «Золгенсма» в том, что именно такую цену установила компания Novartis, поскольку лекарство «радикально изменяет жизнь пациентов, страдающих от этого разрушительного заболевания, и их семей», а также в заявленной стоимости вывода новых препаратов на рынок. Но это утверждение отчасти противоречиво.
Начальные этапы разработки «Золгенсма» финансировались за счет Национального института здравоохранения, а также рядом благотворительных организаций, ориентированных на поиск новых средств для терапии СМА, включая многие американские благотворительные фонды: Cure SMA, Sophia’s Cure, Fighting SMA, Gwendolyn Strong Foundation, Miracle for Madison и другие. Часть этих фондов собирает пожертвования родственников и близких пациентов, чтобы финансировать разработку и клинические исследования новых лекарственных препаратов.
Главный исполнительный директор компании Novartis Васант Нарасимхан вполне обоснованно считает, что генная терапия является прорывным медицинским подходом, так как она дает возможность лечить смертельные генетические заболевания однократным введением препарата. Однако в ряде случаев подходящей заменой может выступать длительная терапия, вызывающая постепенные улучшения. Альтернативой для «Золгенсма» выступает «Спинраза» — стоимость ее применения составляет 4 млн долларов за десять лет.
Относительно короткий срок годности, не более 12 месяцев, усложняет ситуацию — из-за трудностей производства и хранения практически невозможно создавать запасы лекарства.
Неблагоприятные события прошлого года, связанные с пандемией COVID-19, также вынудили швейцарскую компанию закрыть одно производственное предприятие в конце марта 2021 года, всего через 14 месяцев после открытия. Несмотря на это, «Золгенсма», даже с ценником в 2,125 млн и просевшим из-за COVID-19 спросом, показала достойные результаты в 2020 году, едва не получив статус лекарства-блокбастера, — продажи достигли 920 млн.
Очевидно, что «Золгенсма» не может быть дешевой. Но как Novartis определяет фактическую отпускную цену? Различные компании для ценообразования применяют модели, где рассчитывается стоимость исходя из количества прожитых пациентом лет и с учетом эффективности лекарства. Следовательно, необходимо определить стоимость человеческой жизни, заложив определенную маржу на инвестиции компании. О действительной стоимости вывода на рынок нового лекарства мало что известно. Однако компания Novartis не с нуля разрабатывала препарат «Золгенсма» самостоятельно — его приобрели в процессе покупки AveXis, американской компании, создавшей лекарство-кандидат AVXS-101, названное позже «Золгенсма». Сумма сделки, проведенной в 2018 году, составила 8,7 млрд долларов.
Большинство систем медицинского страхования не поддерживают лечение по такой цене, а огромная стоимость также не служит гарантией того, что препарат оправдает все ожидания. С другой стороны, как отмечено выше, Novartis проявляет некоторую гибкость и разрешает выплачивать деньги в течение пяти лет по 425 тыс. долларов в год, а также планирует частично возвращать деньги, если лечение не сработает. Семьям пациентов следует иметь в виду возможность оплаты препарата в рассрочку.
Кошелек или жизнь
168 млн рублей — много это или мало? Для сравнения, на эту сумму можно построить детский сад на 168 мест (место для одного ребенка стоит примерно 1 млн рублей). А сколько стоит жизнь человека? Во многих цивилизованных странах прокламируется, что человеческая жизнь бесценна. Но по факту это не так. Стоимость жизни — экономическая величина, которую используют для количественной оценки выгоды от предотвращения смертельного исхода. В области общественных наук это предельная стоимость предотвращения смерти при определенных обстоятельствах. Часто она включает также качество жизни, ожидаемое время оставшейся жизни и потенциальный заработок. Последнее используется для страховых выплат или компенсаций после гибели человека. Поэтому в разных странах стоимость жизни значительно отличается. Например, в США она составляет примерно 9,6 млн долларов, в Германии — 1,65 млн евро (
2 млн долларов), в Индии — 0,64 млн долларов. Что касается России, по состоянию на 2020 год, стоимость статистической жизни определяют как 4,7 млн рублей (75,9 тыс. долларов по курсу 2019 года). По другой, более оптимистичной, модели — 15,7 млн для женщин и 18,2 млн для мужчин (218 и 253 тыс. долларов соответственно).
Теперь помещаем на одну чашу весов лекарство за 2,1 млн, а на другую — десятки тысяч… Вопрос, почему даже зарегистрированные дорогостоящие лекарственные препараты неохотно предоставляются госучреждениями, отпадает сам собой. Возможно, одним из вариантов частичного решения этой проблемы могло бы стать добровольное страхование новорожденного ребенка в тех случаях, когда родители имеют генетические аномалии. Также не помешает более тщательный выбор партнеров — с предварительным скринингом на наследственные заболевания до планируемого зачатия вместо игры в орлянку с генетикой.