Правосторонняя латерализация что это
Влияние семейного левшества на латерализацию языка в мозге
Поиск, выявление и уточнение нейрональных основ языка – центральная задача современной нейролингвистики. Одним из аспектов этой проблемы является вопрос о латерализации языка, то есть особенности распределения языковых функций между двумя полушариями головного мозга. Известно, что латерализация языка не универсальна и изменяется от человека к человеку. Традиционно полагают, что характер латерализации языка и ведущая рука человека имеют общую или, по крайне мере, пересекающуюся генетическую основу, и потому взаимосвязаны: чем более выраженной праворукостью характеризуется человек, тем ниже вклад правого полушария в языковую обработку (Fitch&Braccini, 2013; Knechtetal., 2000). Однако множество клинических наблюдений и экспериментальных данных указывают на неоднозначность этой связи. Недавно была предложена идея, что не ведущая рука сама по себе, но генетическая предрасположенность к левшеству в гораздо большей степени объясняет распределение нейронального субстрата различных языковых процессов между полушариями (Hancock, Bever, 2013). Текущий проект опирается на эту гипотезу и решает научную проблему о латерализации языка в головном мозге.
В 2015 году мы формировали теоретическую и методологическую базы исследования, проводили математическое моделирование индекса генетической предрасположенности к левшеству в русскоязычной популяции и подготавливали дальнейшие экспериментальные этапы. Прежде всего, мы собрали данные 2000 русскоговорящих испытуемых русской национальности, проживающих в России, по двум разработанным опросникам – на собственную ведущую руку испытуемого и ведущую руку родственников вплоть до третьего колена. В полученной выборке мы смоделировали индекс генетической предрасположенности к левшеству – с учетом количества неправоруких родственников и степени близости родства с ними. Посчитанный таким образом индивидуальный индекс предрасположенности к левшеству впоследствии используется в анализе нейровизуализационных данных.
Кроме того, мы разработали и опробовали несколько фМРТ-парадигм речевого локалайзера. Парадигма, в которой в экспериментальном условии испытуемые читают вслух предложения и завершают их подходящим по смыслу словом, а в контрольном зачитывают списки слогов, единственная вызывала надежные средневисочную и нижнелобную активации (характерные именно для языкового экспериментального задания) и потому была выбрана для последующего эксперимента. Такая парадигма используется на томографе Siemens MagnetomVerio 3T, с помощью которого получаются структурные изображения мозга высокого разрешения и функциональные Т2*-изображения. Метод сканирования с промежутками (sparse sampling) позволяет регистрировать речь испытуемых, когда томограф не производит шум. Также были разработаны несколько протоколов МРТ сканирования для сбора дополнительных нейровизуализационных данных об анатомических и функциональных связях головного мозга: трактографии (диффузная тензорная МРТ) и функциональной МРТ состояния покоя.
В 2016 году мы собрали данные 50 русскоязычных испытуемых с разной степенью леворукости и семейной предрасположенности к левшеству. В результате применения фМРТ-парадигмы с речевым локалайзером для каждого испытуемого была локализована связанная с речевым заданием средневисочная и нижнелобная активация головного мозга. При этом для испытуемых с различиями по доминантности рук оказалась характерна специфическая латерализация этой активации (рисунок 1). На основании данных МРТ состояния покоя были получены функциональные языковые сети покоя (рисунок 2), и данные диффузионно-тензорной МРТ позволили реконструировать дугообразные пучки обоих полушарий мозга. И выделенная на основе речевого локалайзера активация, и дугообразные тракты, и языковые функциональные сети оказались индивидуально латерализованы.
В 2017 году данные диффузионно-тензорной МРТ 50 испытуемых легли в основу реконструкций основных ассоциативных проводящих путей обоих полушарий и главного комиссурального пути – мозолистого тела – для каждого испытуемого (см. Рисунок 3). Для всех трех видов полученных нейровизуализационных данных (функциональной МРТ – речевого локалайзера, функциональной МРТ состояния покоя и диффузионно-тензорной МРТ) были вычислены индивидуальные индексы латерализации, которые затем были проанализированы на предмет корреляции с личной степенью доминантности правой или левой руки человека и со степенью его генетической предрасположенности к левшеству. Сходный анализ был проведен для 22 пациентов с поражением левого полушария мозга и сопутствующей афазией различной степенью тяжести – для выявления факторов, способствующих лучшему сохранению речевой функции после инсульта.
| Рисунок 3. Восстановленные ассоциативные тракты левого полушария у здорового испытуемого (слева) и пациента после инсульта (справа). |
На сегодняшний момент важнейшими полученными результатами являются следующие: 1) степень доминантности той или иной руки у человека – результат накопления фактора предрасположенности к левшеству через многие поколения и плохо предсказывается на основании данных только наиболее близких поколений; 2) личная рукость, выраженная в степени доминантности правой или левой руки, но не степень семейного левшества человека, является надежным предиктором латерализации языка в мозге (по данным разномодальной функциональной МРТ): чем выше степень праворукости, тем в большей степени речь леволатерализована – это верно как для здоровых людей, так и для пациентов с поражением мозга; 3) латерализация языковых сетей по данным активационных парадигм и состояния покоя независима или даже противоположна, то есть использование функциональной МРТ состояния покоя для локализации индивидуальных речевых зон неоправданно; 4) степень сохранности аркуатного (дугообразного) пучка в правом полушарии положительно связана со степенью сохранности речи у пациентов с постинсультной афазией вследствие поражения левого полушария мозга, то есть правополушарный аркуатный пучок может являться частью субстрата успешной постинсультной реорганизации речи.
Публикации
Доклады на конференциях
Позвоночный латеральный стеноз: что это такое, симптомы, лечение
Что такое позвоночный латеральный стеноз?
Позвоночный латеральный стеноз, что это такое? Чтобы вникнуть в суть вопроса, необходимо вспомнить анатомию, а именно строение позвоночного столба. Он состоит из ряда позвонков, между ними располагаются межпозвоночные диски. У них есть отверстия, они необходимы для прохода спинномозговых нервов, а также сосудов, снабжающих позвоночник питательными веществами. Внутри располагается полость, которую называют центральным позвоночным каналом.
Любые нарушения в строении позвоночника приводят к проблемам со здоровьем: сужение латерального кармана, канала позвоночного столба, отверстия между позвонками. Так, если у человека латеральный стеноз позвоночного канала, у него изменен диаметр отверстий, расположенных в межпозвоночных дисках. Это процесс, когда происходит прогрессирующее сужение в месте выхода спинномозгового корешка, который располагается между соседними позвонками (диаметр отверстия уменьшается до 4 мм). Из-за этого сдавливаются спинномозговые корешки, сосуды. Следствием этой патологии может быть полная инвалидизация. Если это латеральный стеноз позвоночника шейного отдела, то защемляются артерии, которые идут к головному мозгу. Когда у пациента латеральный стеноз позвоночника поясничного отдела, уменьшается размер отверстий в поясничном отделе.
Причины возникновения
Данная патология может быть врожденной, когда у ребенка уже имеются аномалии развития, т.е. укорочена передняя или задняя стенка дуги позвоночника, снижена высота межпозвоночного диска, уменьшено или деформировано тело позвонка. Если она проявляется позже, причиной может стать ряд заболеваний:
Классификация латерального стеноза позвоночного канала
Латеральный и центральный стеноз бывает как врожденным, так и приобретенным. Выделяют несколько степеней тяжести:
Симптомы
Болезнь характеризуется рядом симптомов:
Как диагностировать заболевание?
Если у вас поясничный латеральный стеноз, уже по симптомам можно поставить предварительный диагноз. Однако, чтобы подтвердить его, нужны аппаратные исследования: компьютерная томография, рентгенографическое исследование позвоночника в разных проекциях, МРТ. Если остались сомнения и доктор не уверен, где именно находится сужение, то назначается электронейромиография, миелография, сцинтиграфия.
Лечение латерального стеноза позвоночника
Если у вас латеральный стеноз позвоночного канала, врач-невролог проведет осмотр, а затем будет решать, какая терапия поможет именно в вашем случае. Это может быть как консервативное лечение, так хирургический метод.
Консервативное лечение
Если болезнь не запущена, врач начинает лечить больного при помощи консервативных методов. Это прием медикаментов, а также лечебная физкультура, физиолечение, массаж. Доктор может назначить вам следующие лекарственные препараты:
Оперативное лечение
Если врач испробовал все другие методы лечения, они не помогли, поражение позвоночника слишком сильное, назначается операция. Хирург должен освободить нервные корешки, сделать так, чтобы они не сдавливались. Это может быть как операция открытого типа, так и более простая эндоскопическая процедура. После операции нужно поговорить с врачом-реабилитологом, который расскажет, как восстановиться, как правильно себя вести, чтобы больше не беспокоили боли и не было проблем с позвоночником. Есть несколько видов подобных операций:
Возможные осложнения
Заболевание нужно вовремя лечить. Если этого не делать, то появятся изменения, многие из которых станут необратимыми:
Латерализация нижнечелюстного нерва с одновременной имплантацией
Е. Н. Шастин
профессор РАЕ, главный врач стоматологический клиники «Дентик Люкс» (Краснодар)
Имплантация широко применяется при реабилитации пациентов с потерей зубов и в большинстве случаев позволяет достигнуть удовлетворительных результатов при использовании стандартных процедур размещения имплантатов. Однако при прогрессировании атрофии альвеолярной кости использование стандартных процедур не позволит разместить имплантаты. Наибольшую сложность представляет установка имплантатов в атрофированных боковых отделах нижней челюсти.
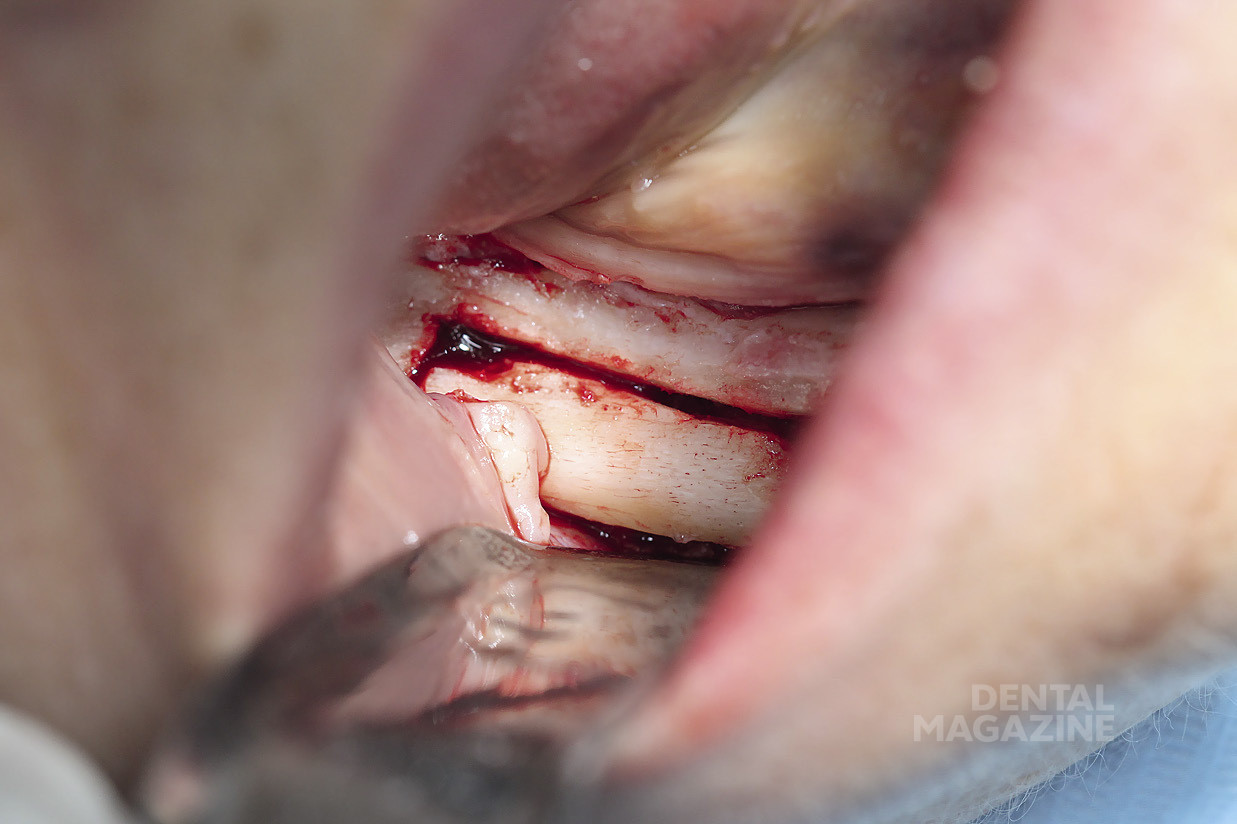
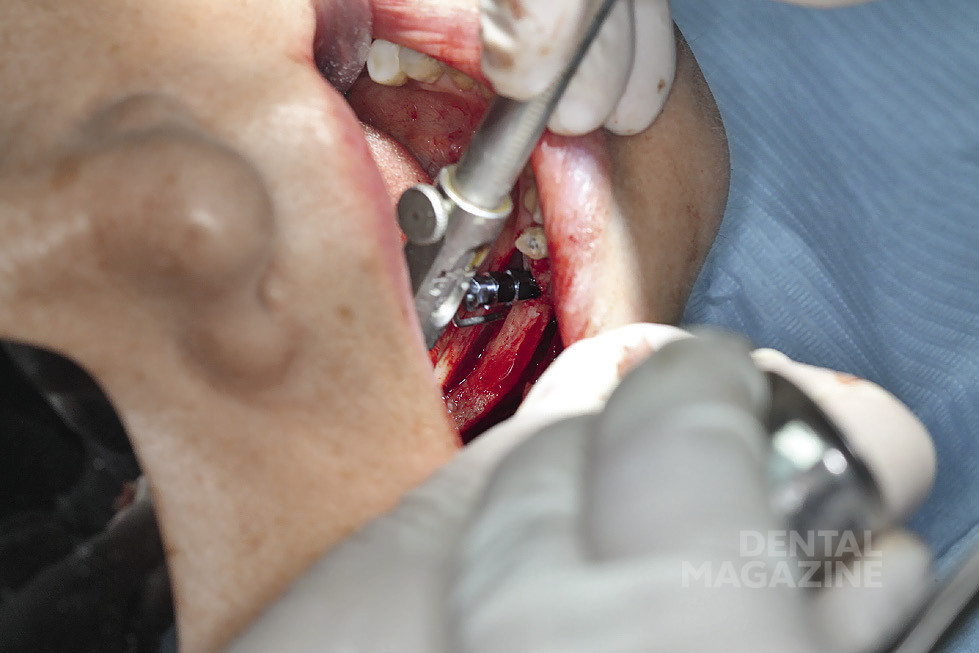
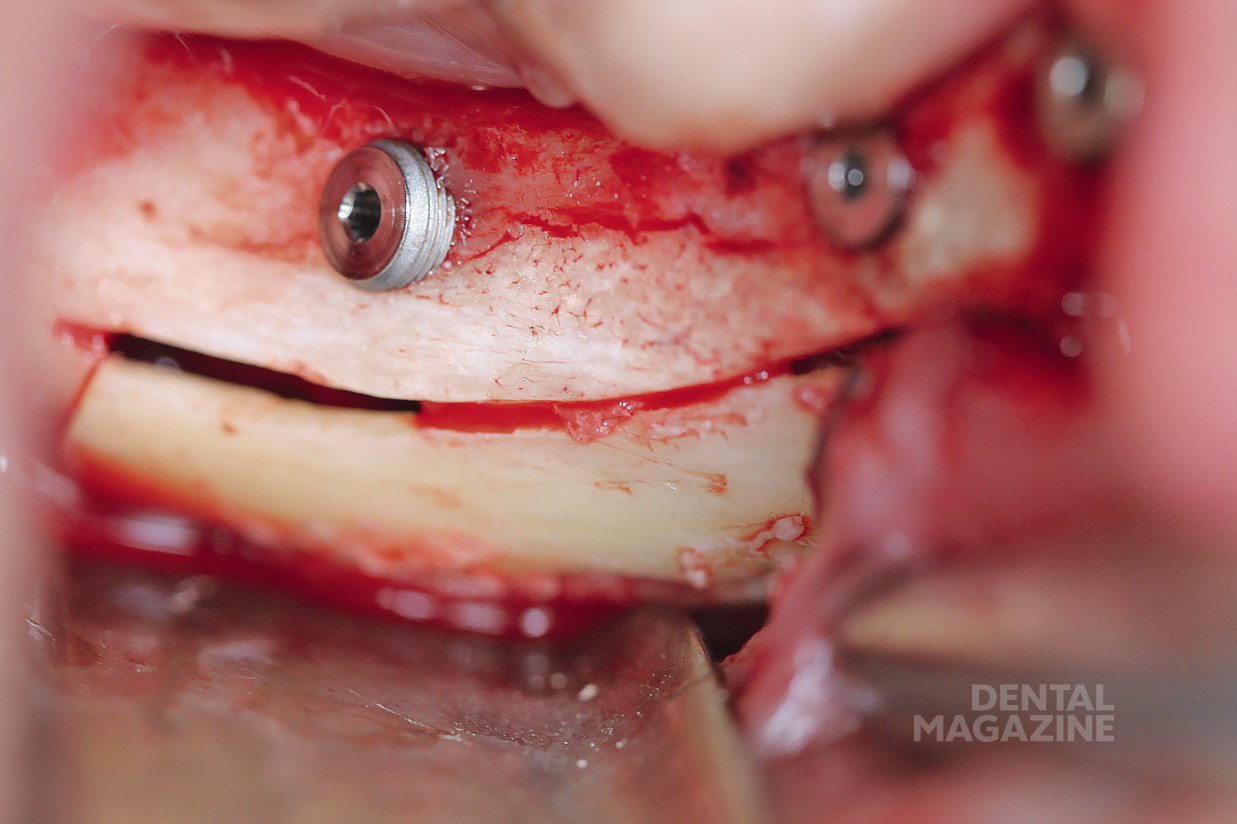
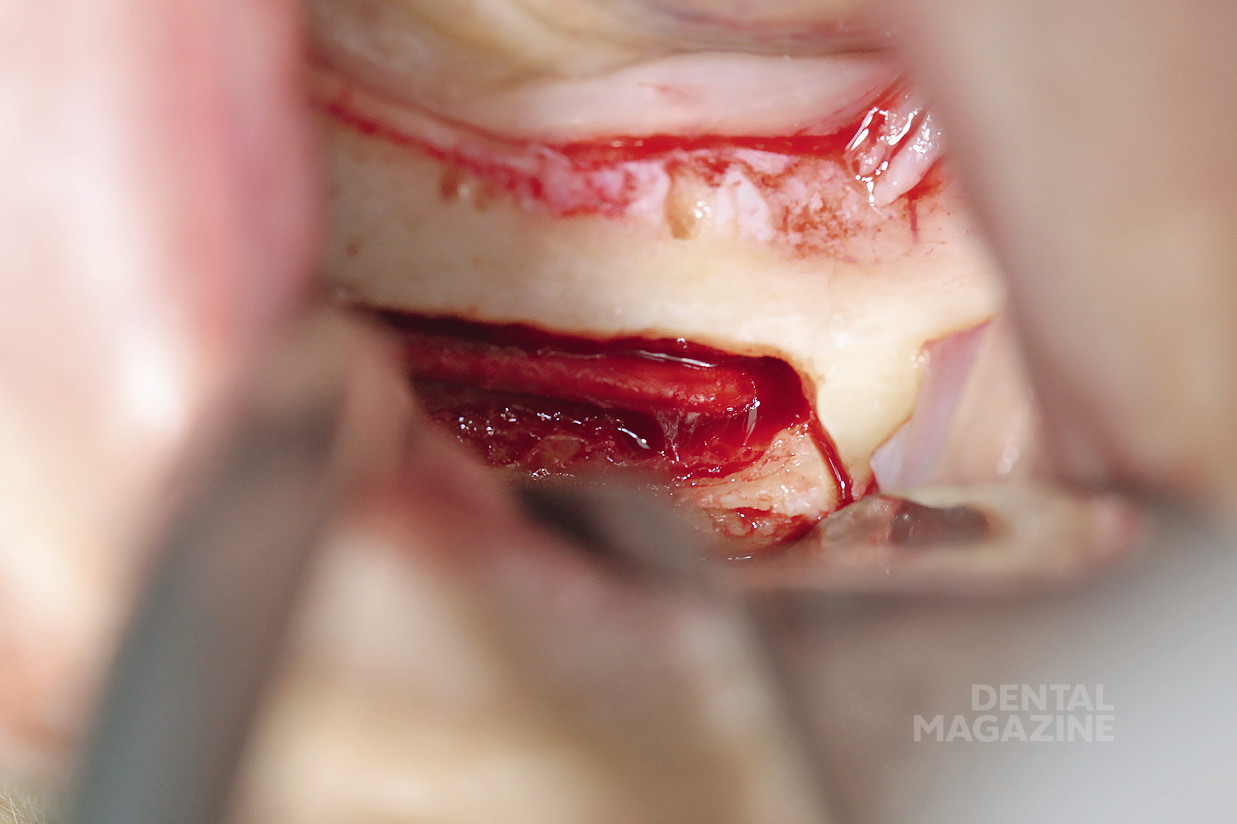
Это описано в работах (Rosenquist, 1994; Nocini et al., 1999; Chrcanovic & Custudio, 2009; Pavlikova et al., 2011). В 1987 году Jensen & Nock впервые описали технику установки имплантатов в дистальные участки нижней челюсти в сочетании с латерализацией (транспозицией) нижнего альвеолярного нерва. Основным риском применения данной техники является возможность повреждения нижнего альвеолярного нерва и развития длительной нейросенсорной дисфункции (Kan et al., 1997; Sakkas et al., 2008; de Castro e Silva et al., 2011). Пьезохирургическая техника остеотомии, получившая распространение среди имплантологов и хирургов, благодаря снижению риска повреждения мягких тканей и анатомических структур, а также легкости обращения с инструментом избавляет от необходимости использования пил и сверл при остеотомии (Eggers et al., 2004; Stubinger et al., 2005; Schlee et al., 2006; Bovi, 2005; Baldi et al., 2011; Nusrath & Postlethwaite, 2011). Мы осветим технику установки имплантатов в сочетании с пьезохирургической латерализацией нижнего альвеолярного нерва на примере двух клинических случаев.
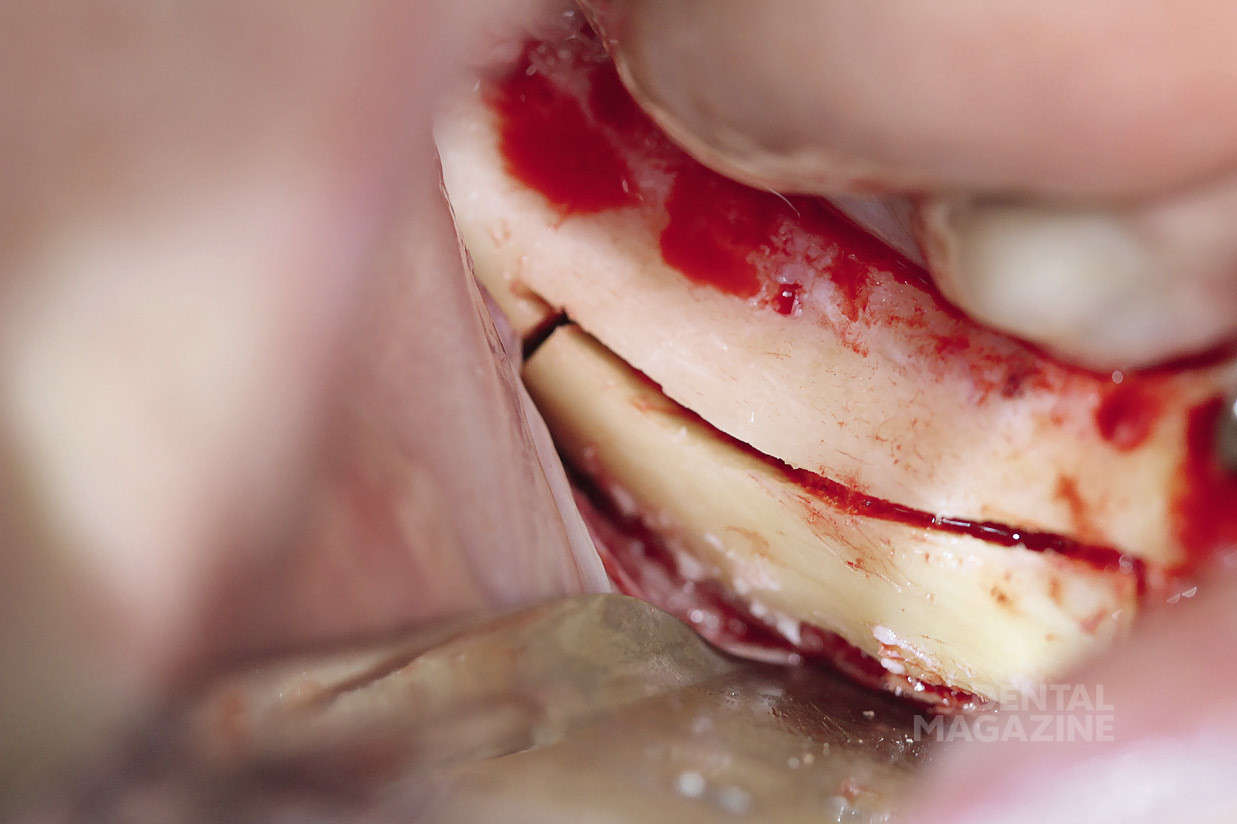
Пациент № 5612
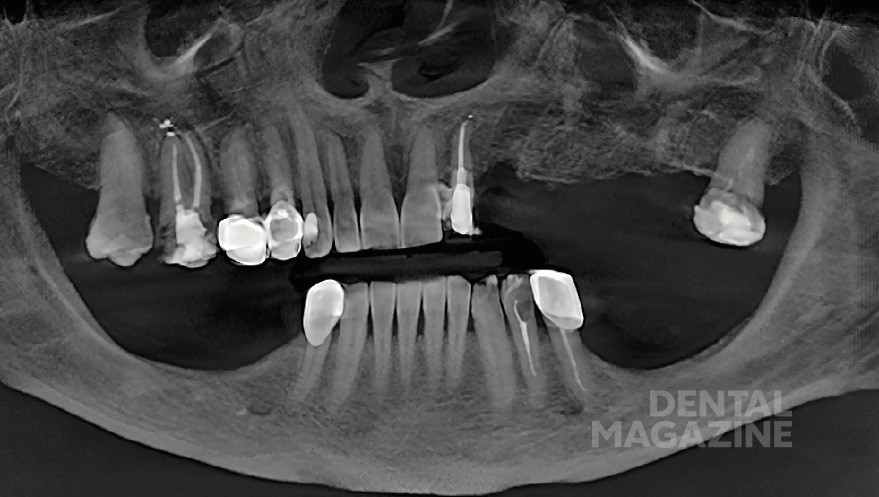
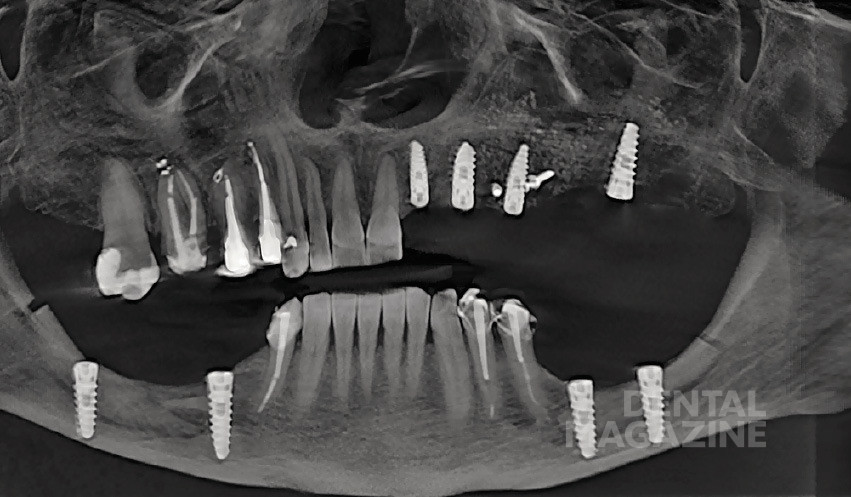
Рис. 1. Ортопантомограмма
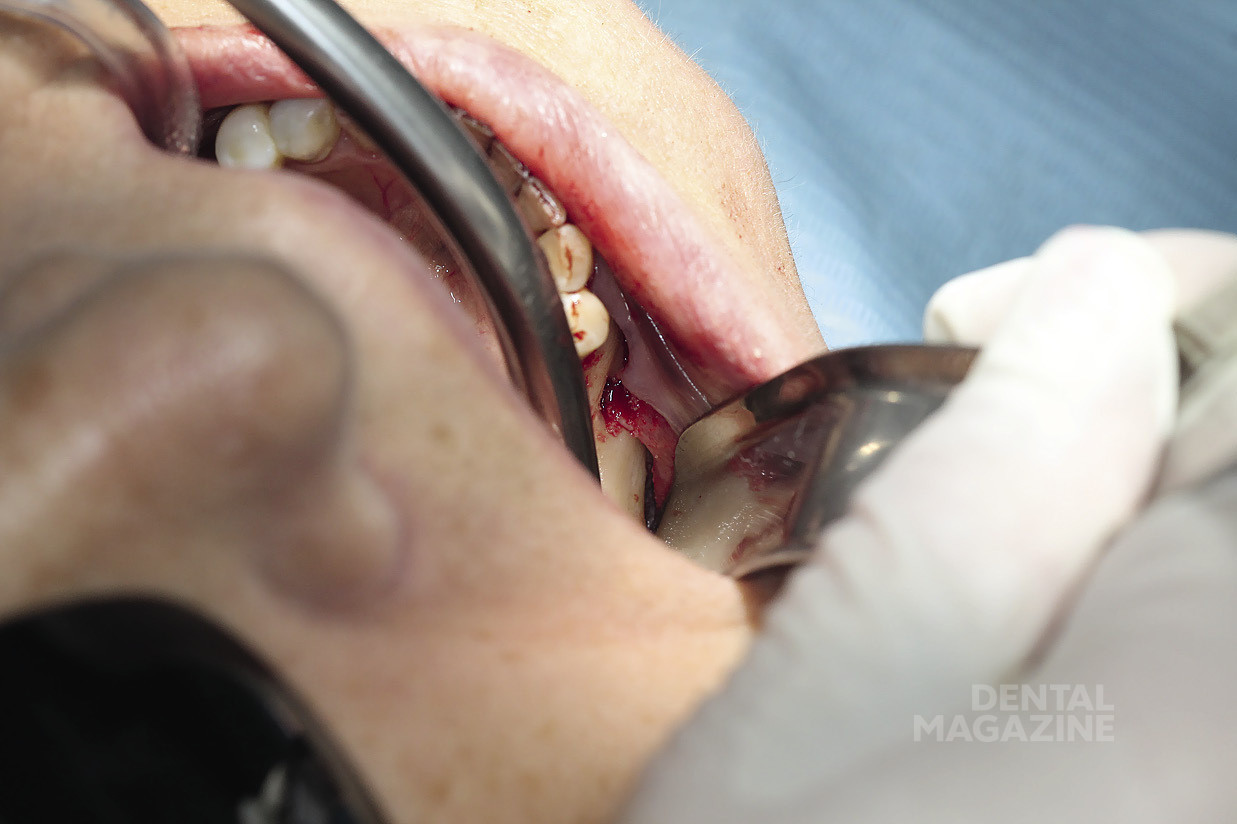
Рис. 2. Создание доступа
Рис. 3. Визуализация ментального отверстия
Рис. 4. Вид проведенных распилов
Рис. 5. Отделение костного блока
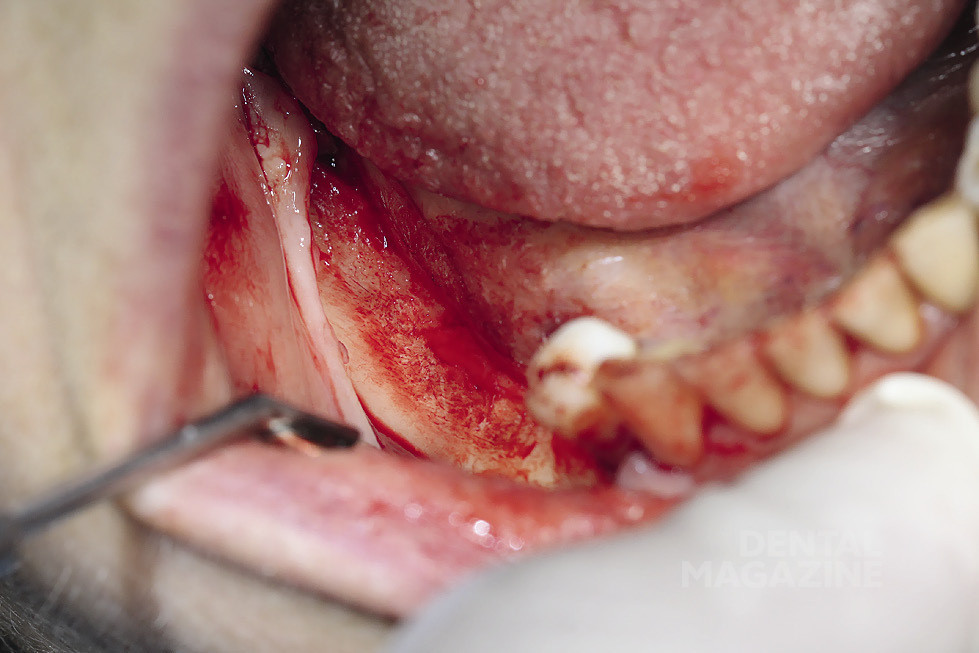
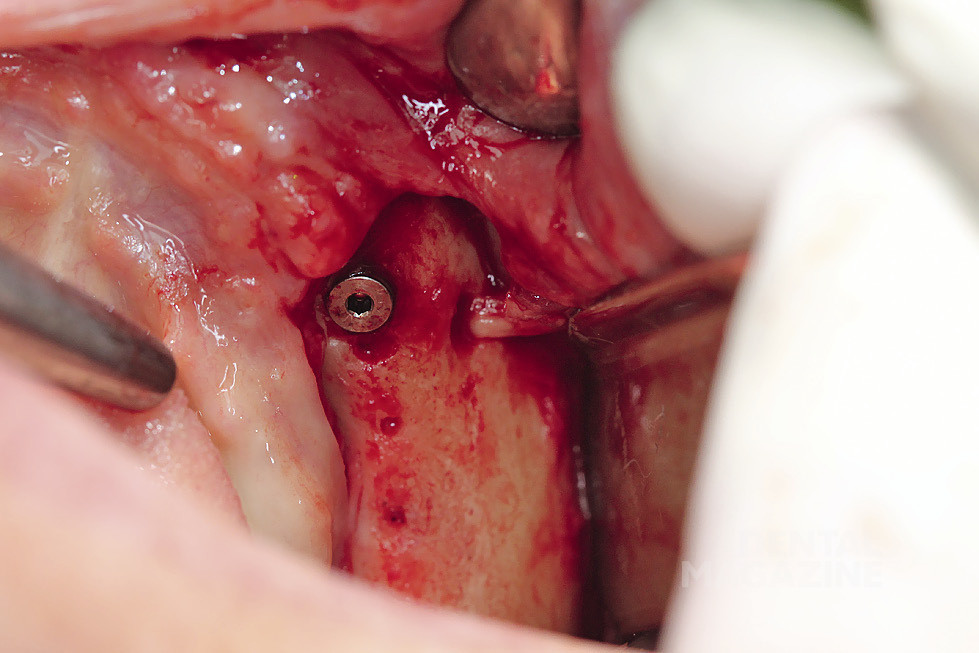
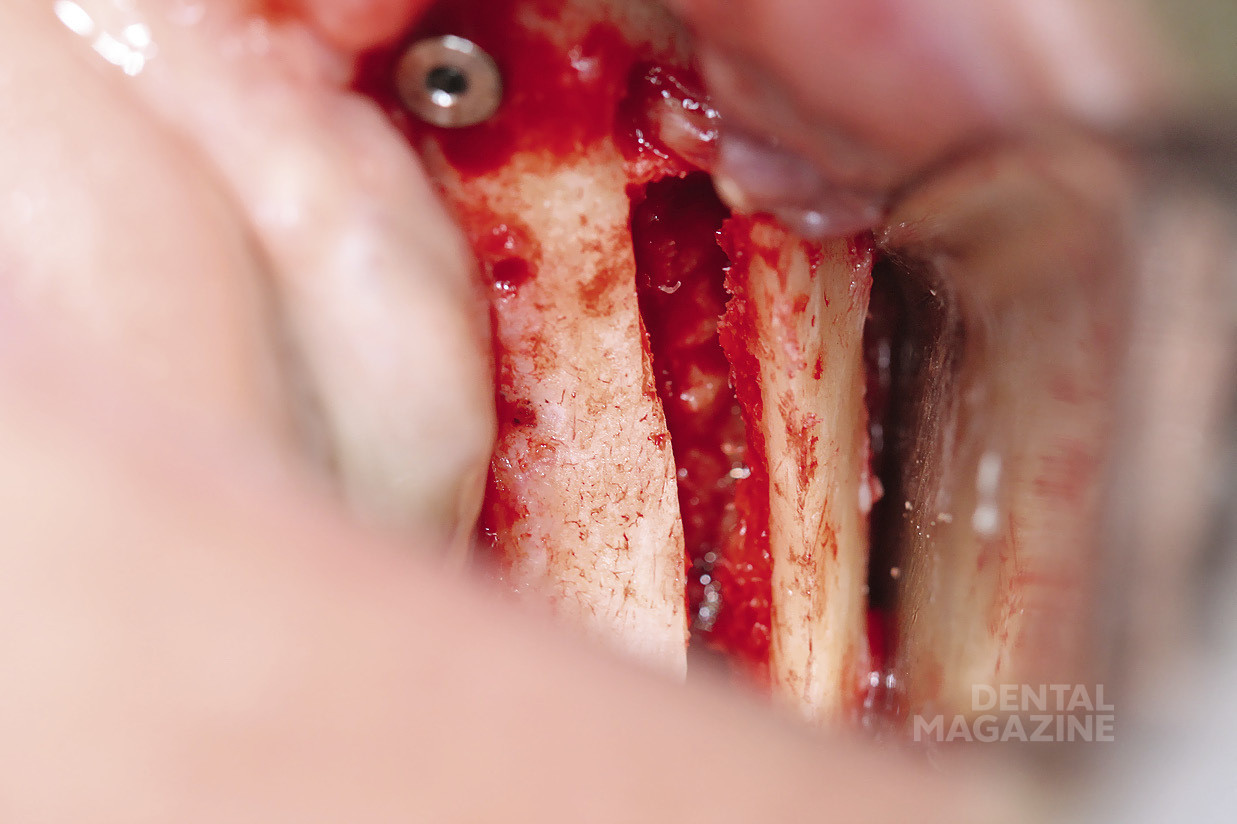
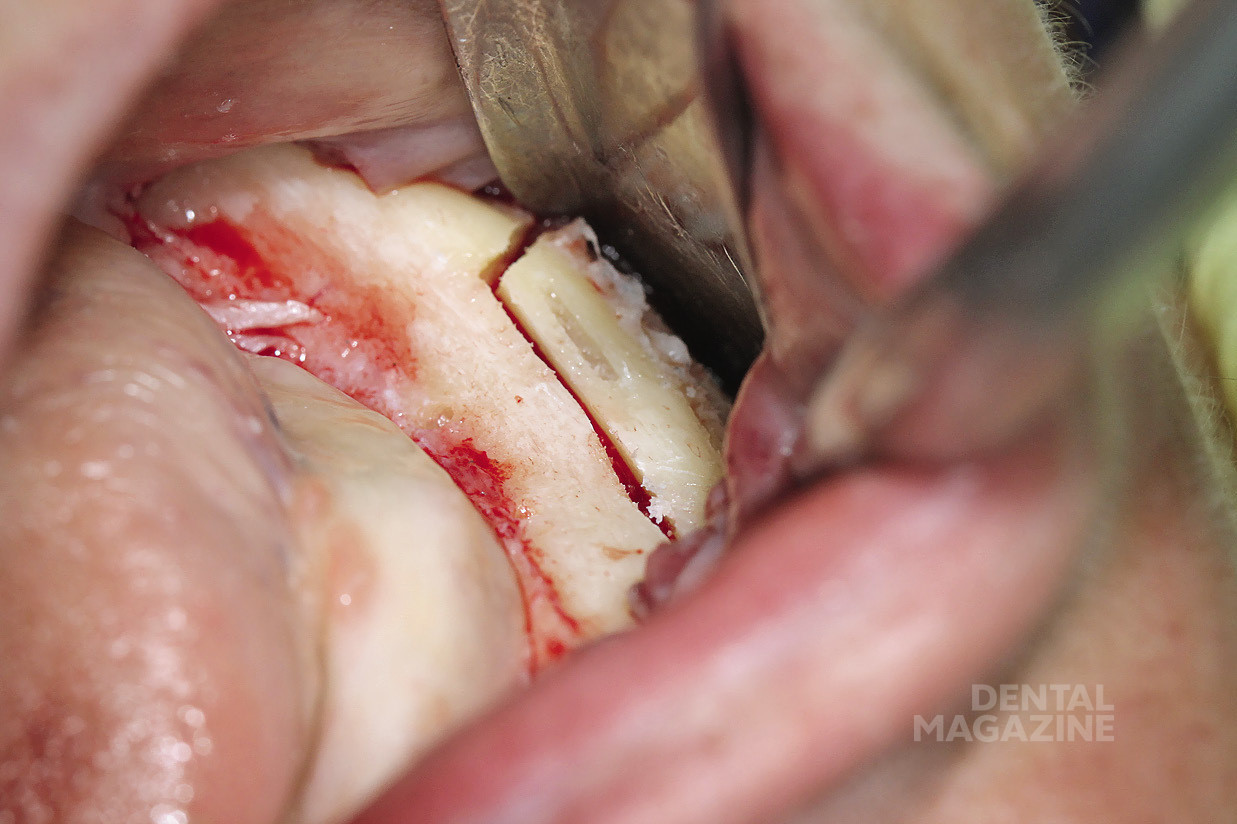
Рис. 6. Выделение нижнего альвеолярного нерва
Рис. 7. Выделение нижнего альвеолярного нерва атравматичным инструментом
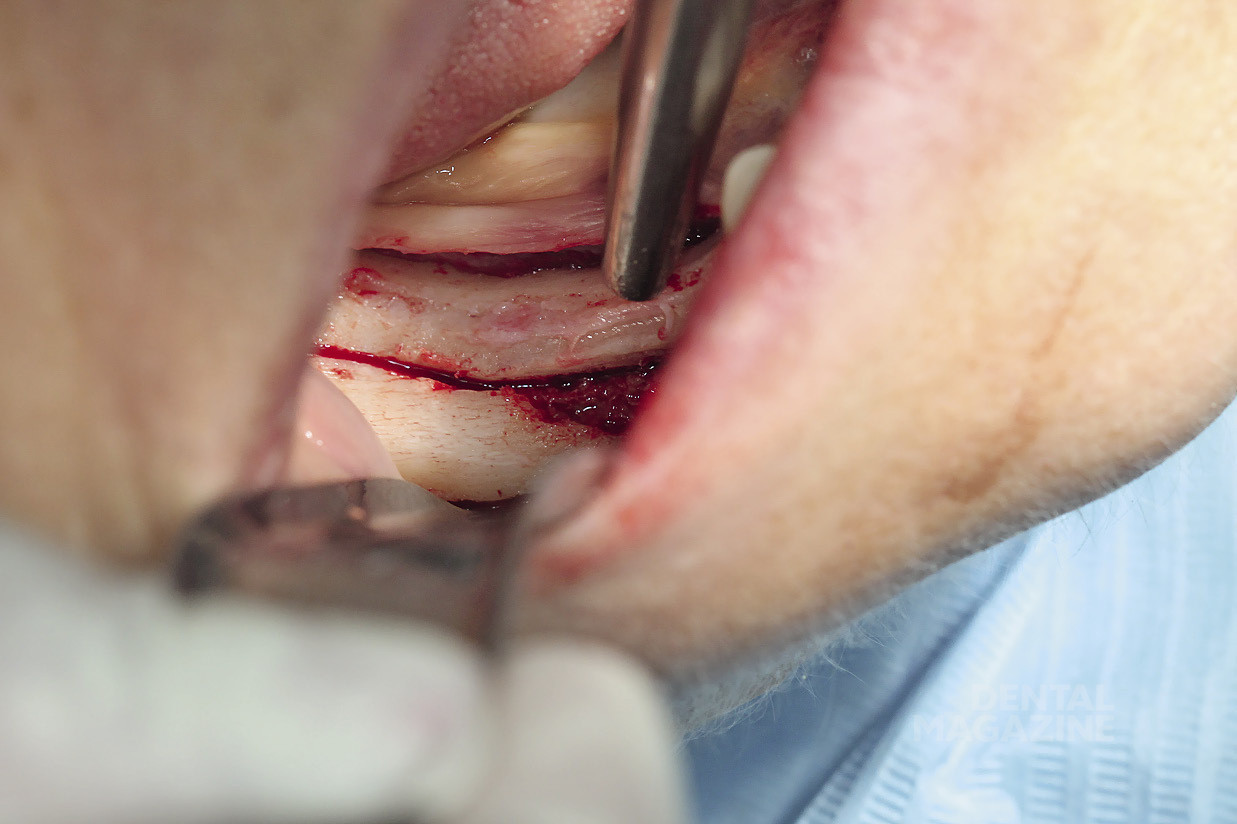
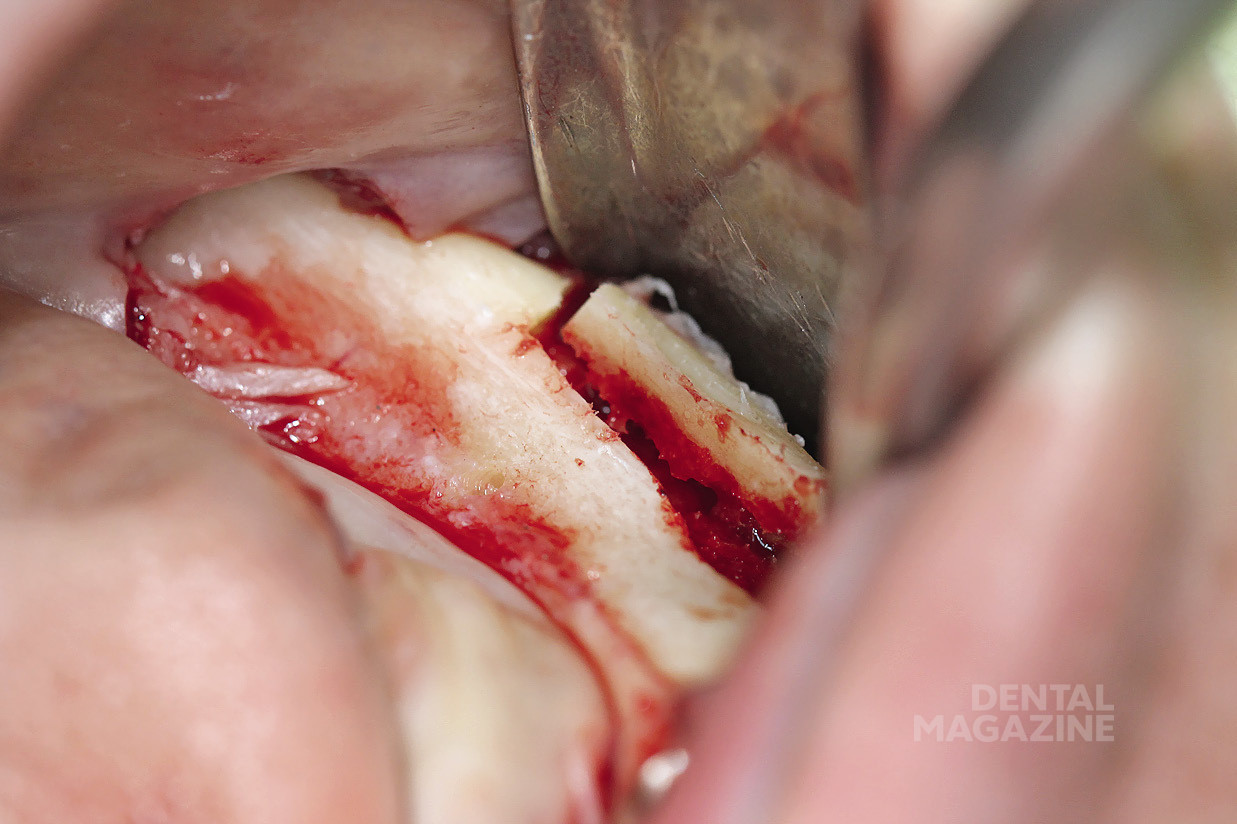
Рис. 8. Вид после мобилизации
Рис. 9. Резиновые полоски
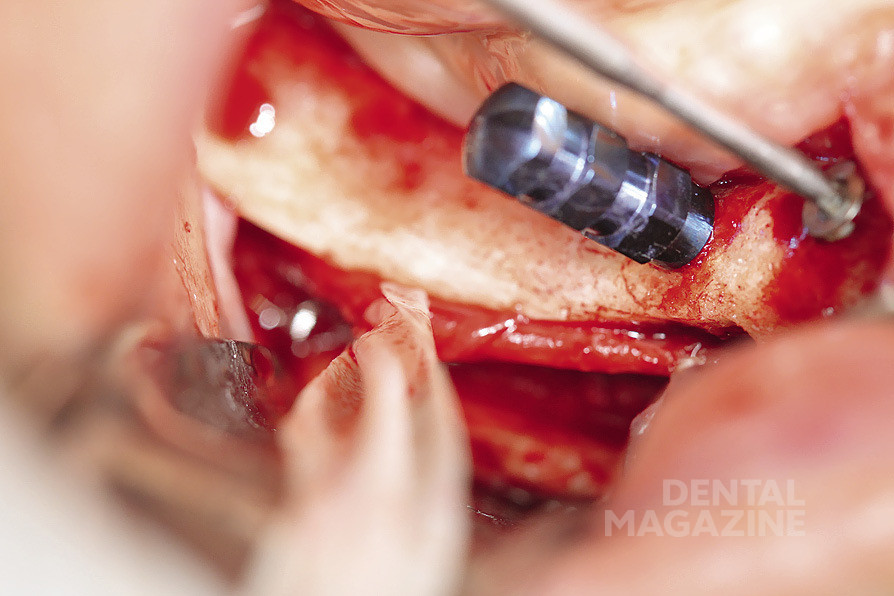
Рис. 10. Удержание сосудисто-нервного пучка
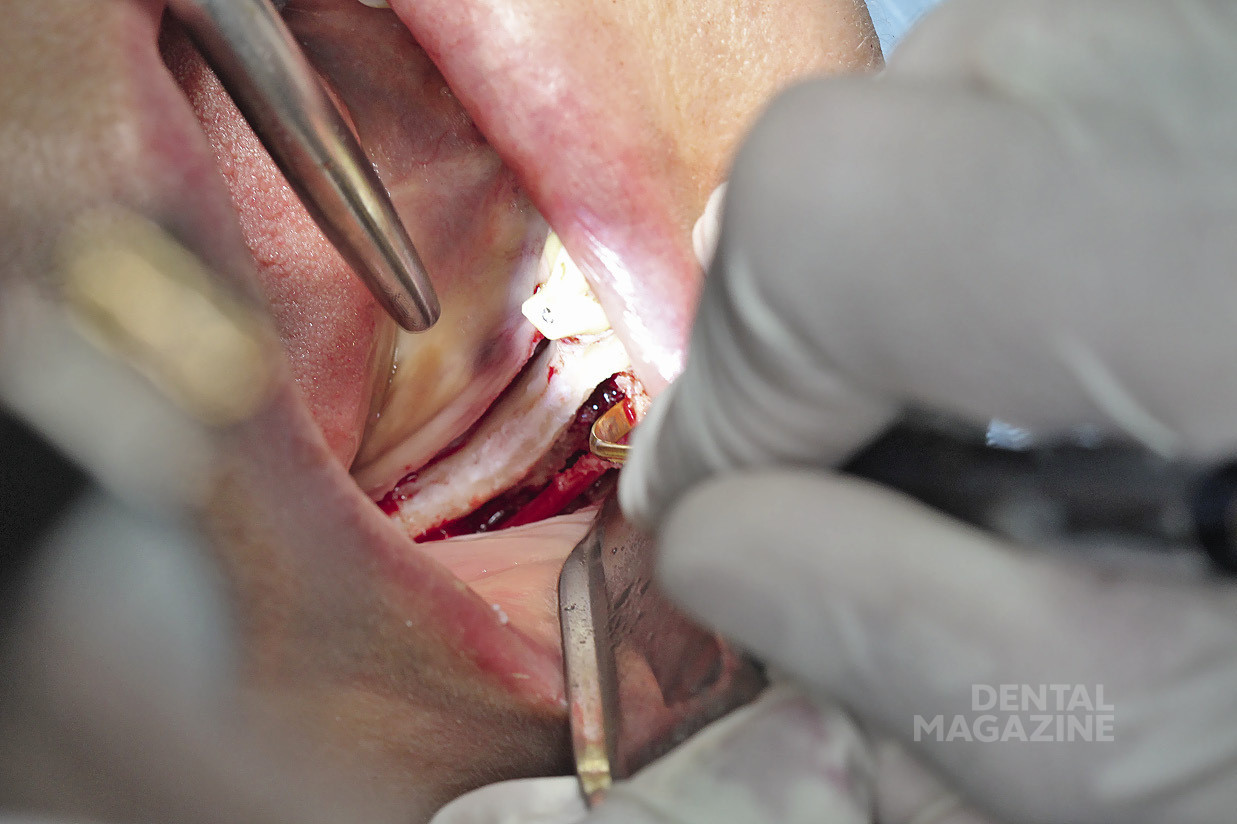
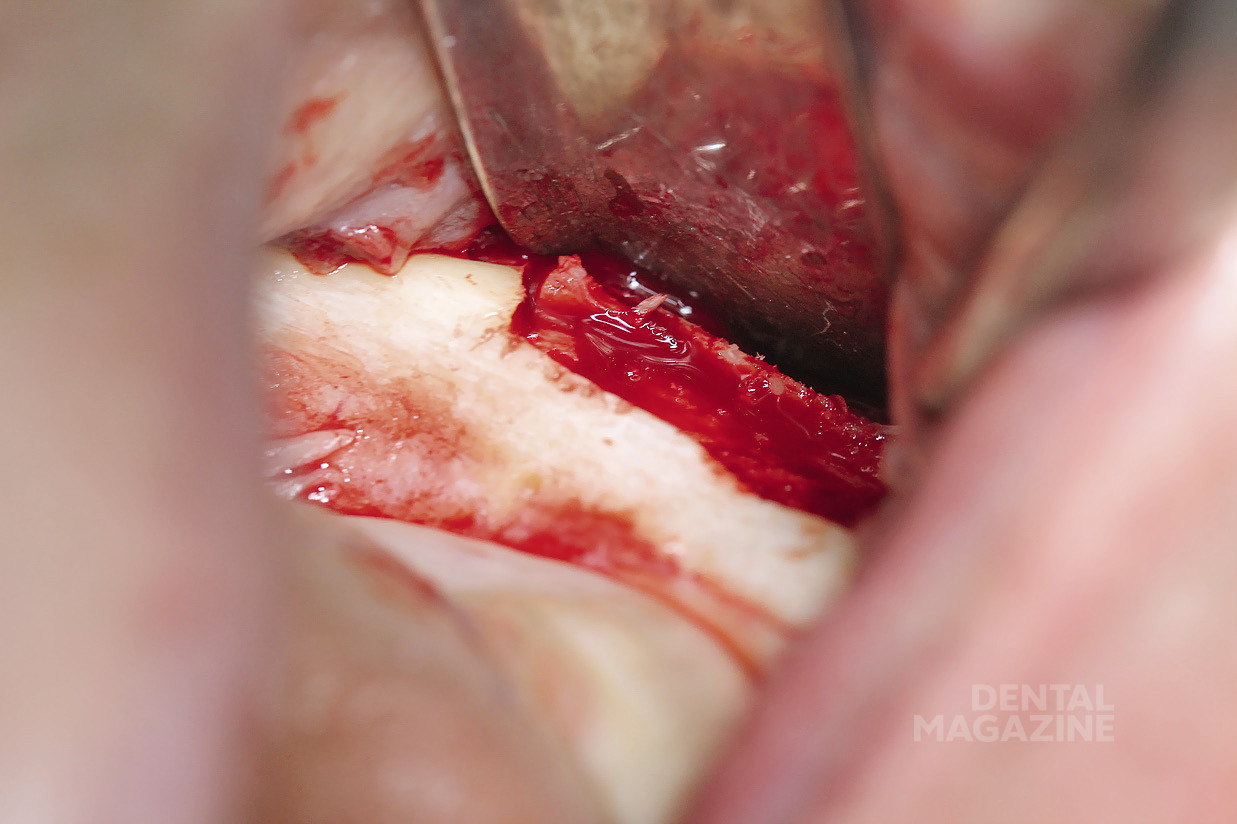
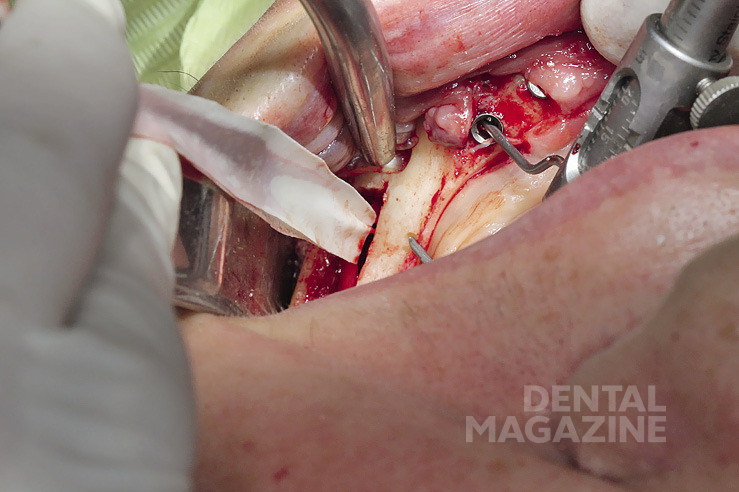
Рис. 11. Создание ложа под имплантат
Рис. 12. Препарирование по заранее спланированной разметке
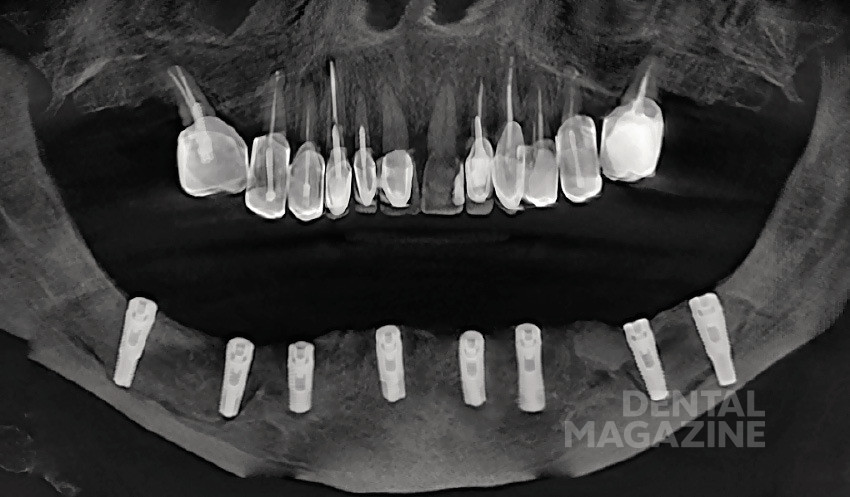
Рис. 13. Ортопантомограмма после операции
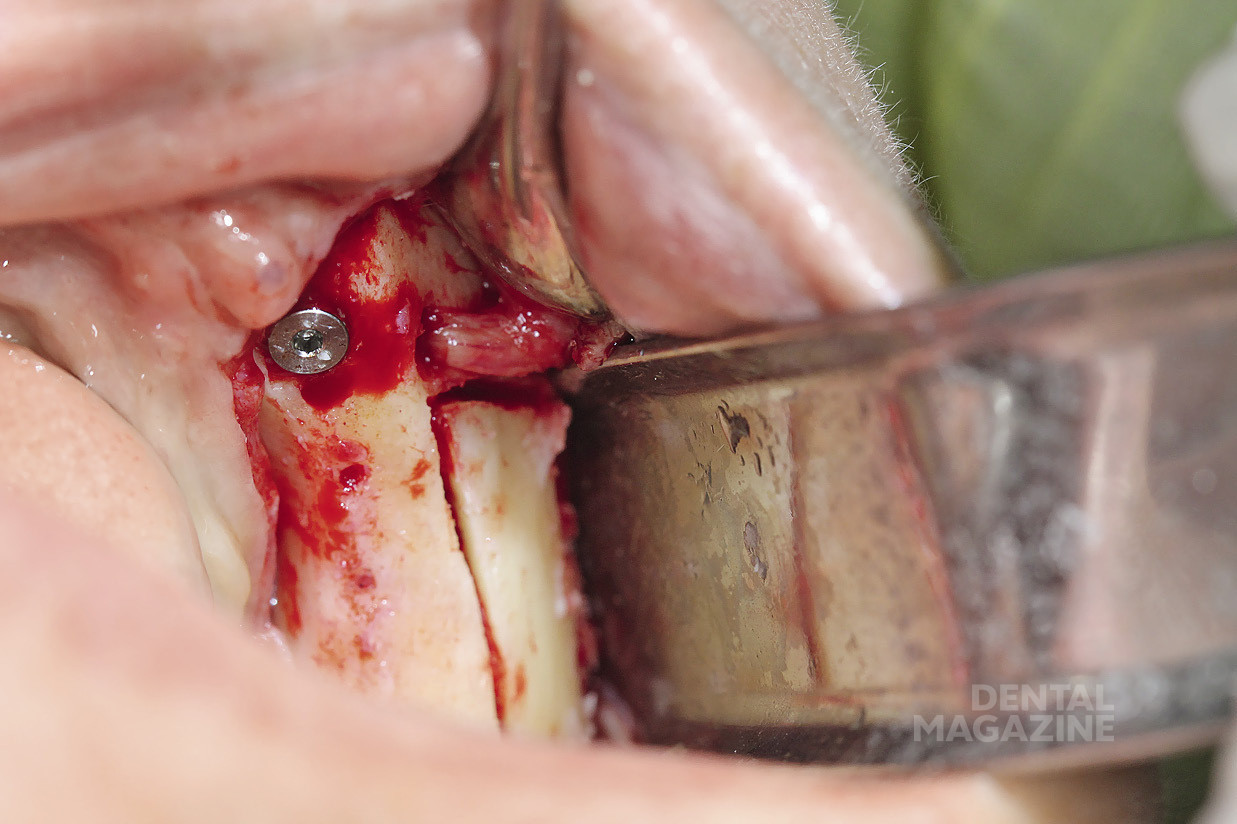
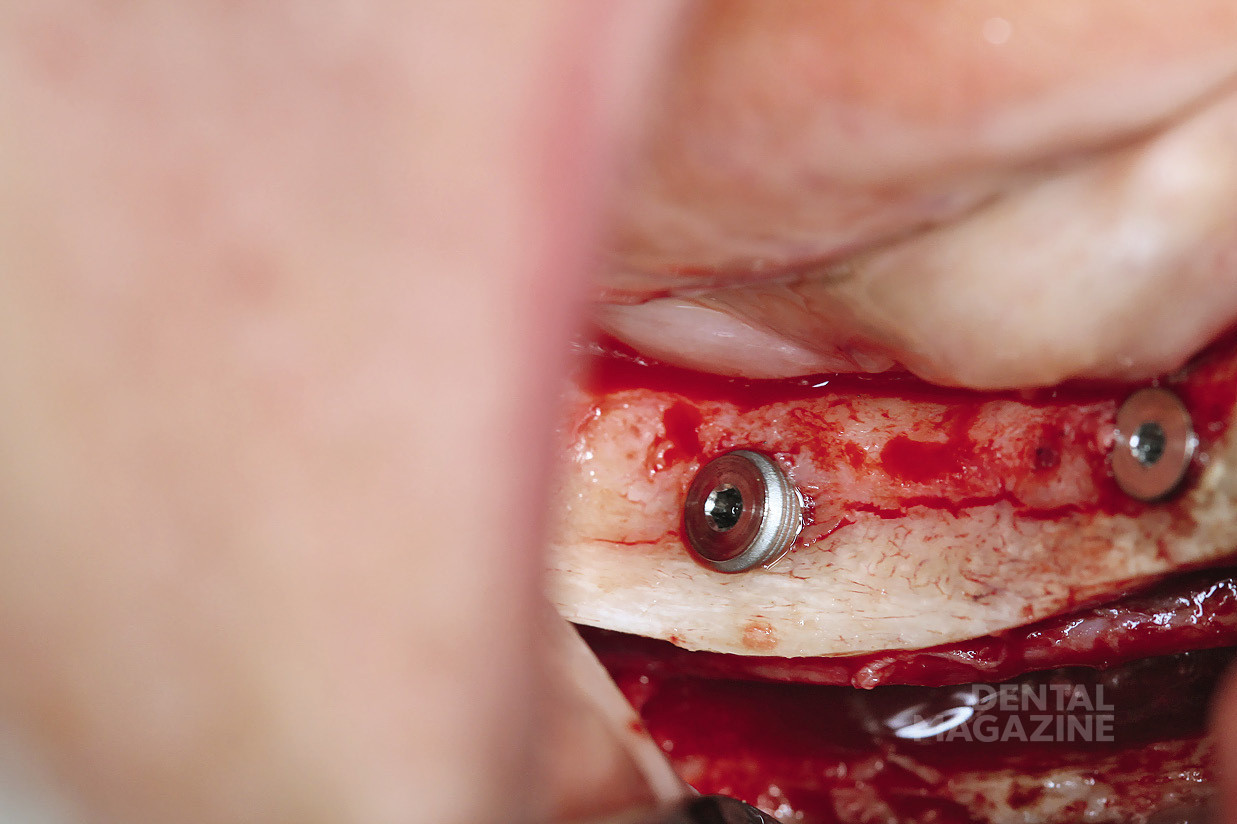
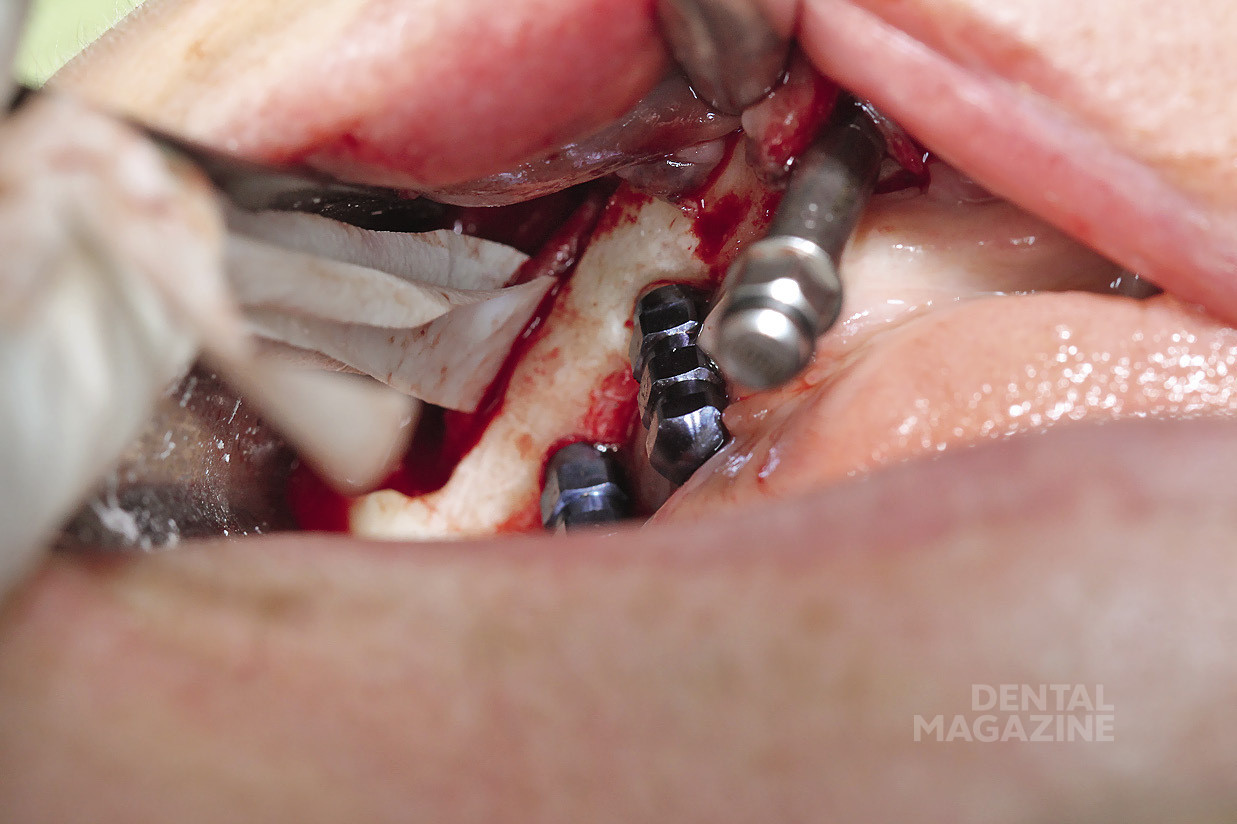
Рис. 14. Установка мезиального имплантата
Рис. 15. Проведение горизонтальных распилов
Рис. 16. Проведение вертикальных распилов
Рис. 17. Отделение костного блока
Рис. 18. Помещение костного фрагмента в физиологический раствор
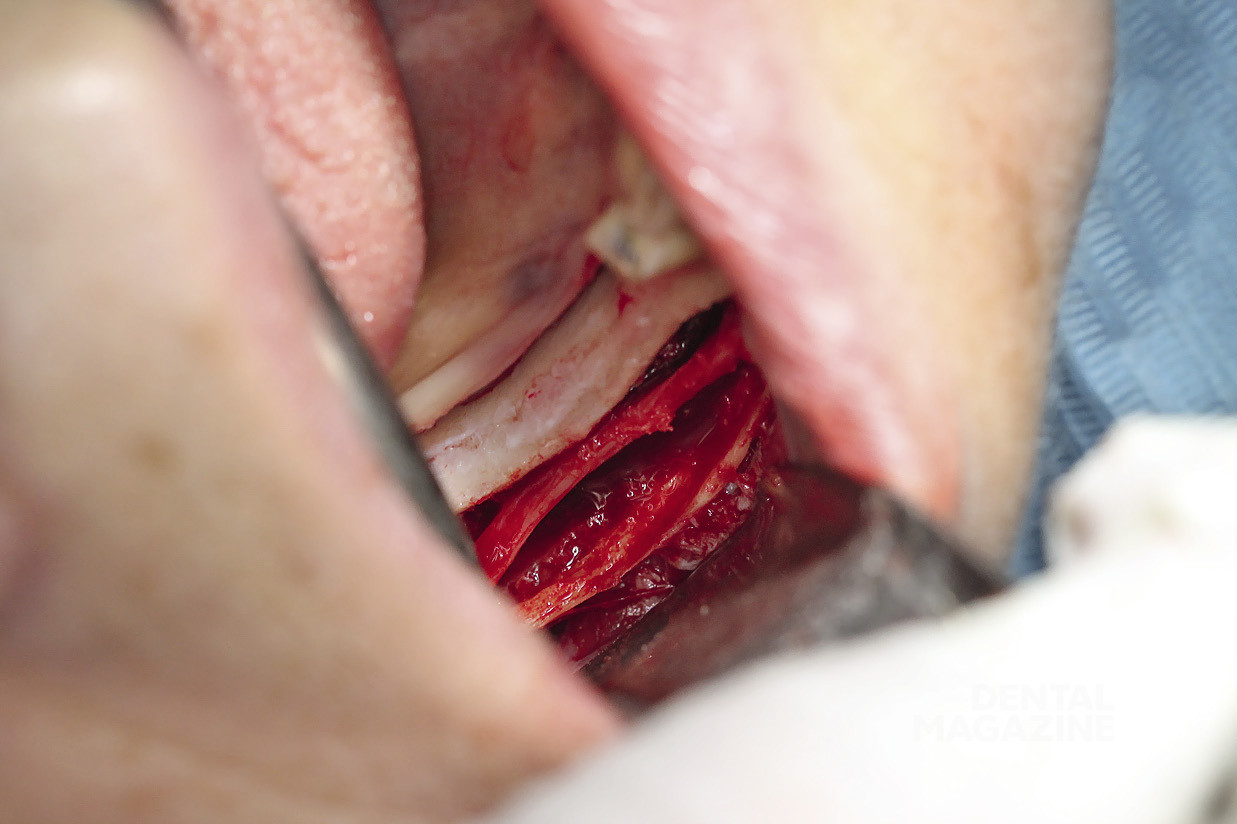
Рис. 19. Вид мобилизированного сосудисто-нервного пучка
Рис. 20. Удержание сосудисто-нервного пучка
Рис. 21. Возвращение костного блока на место
Рис. 22. Проведение распилов
Рис. 23. Отделение костного блока
Рис. 24. Вид после отделения костного фрагмента
Рис. 25. Вид после мобилизации
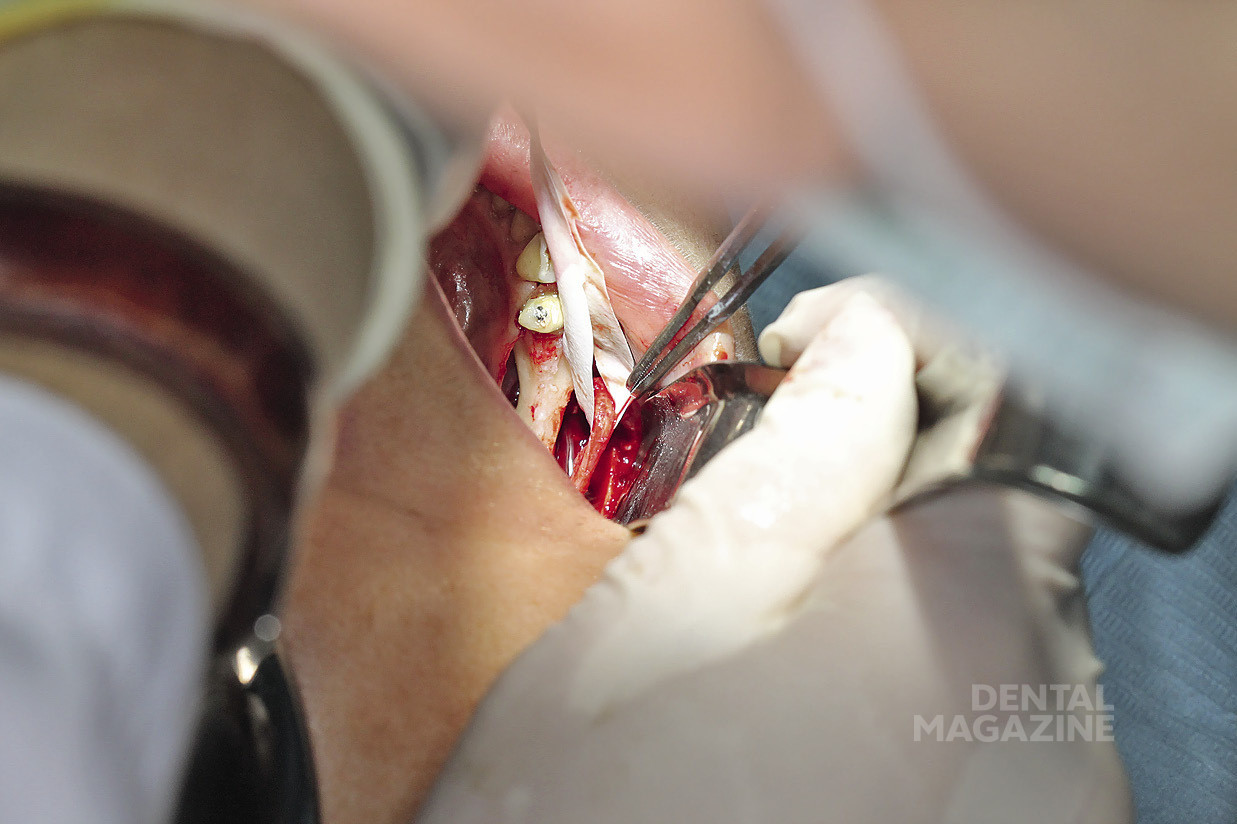
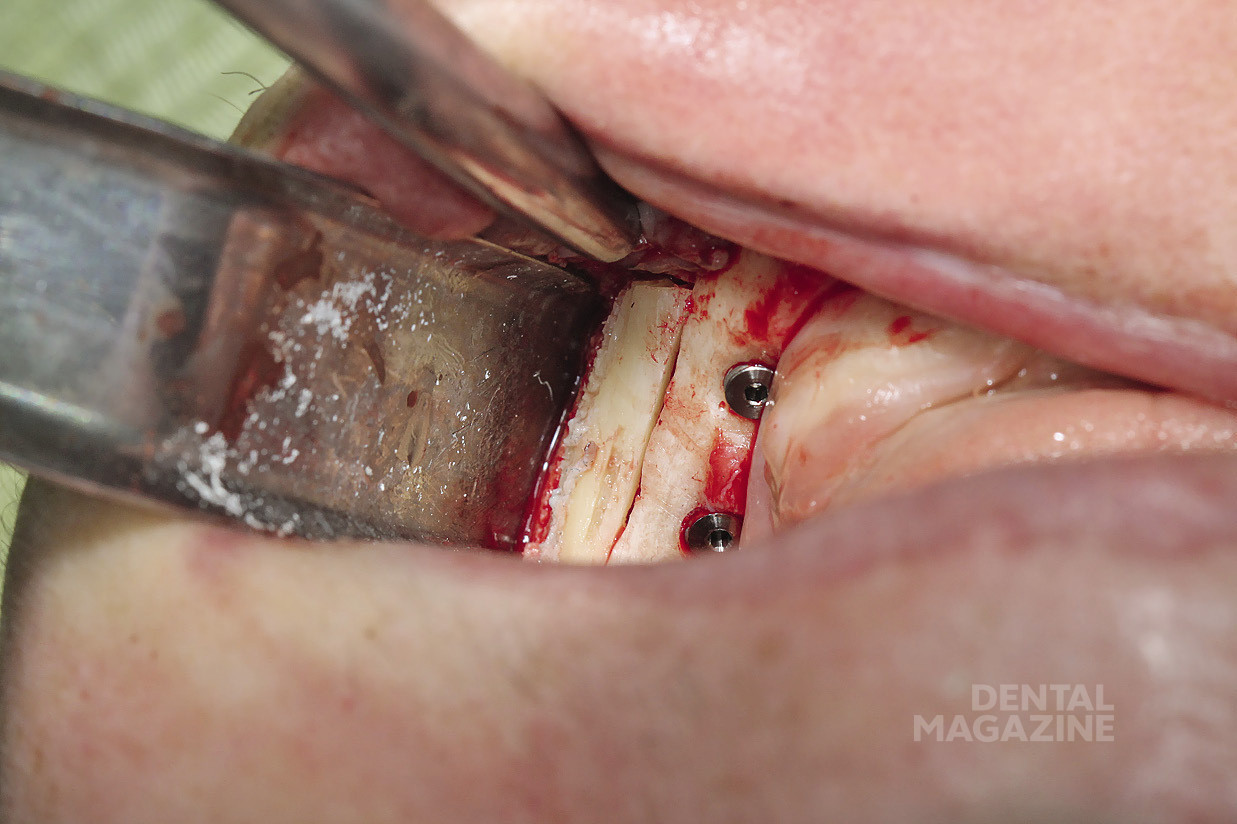
Рис. 26. Установка имплантатов по заранее спланированной разметке
Рис. 27. Соблюдение принципов параллельности на каждом этапе
Рис. 28. Возвращение костного фрагмента
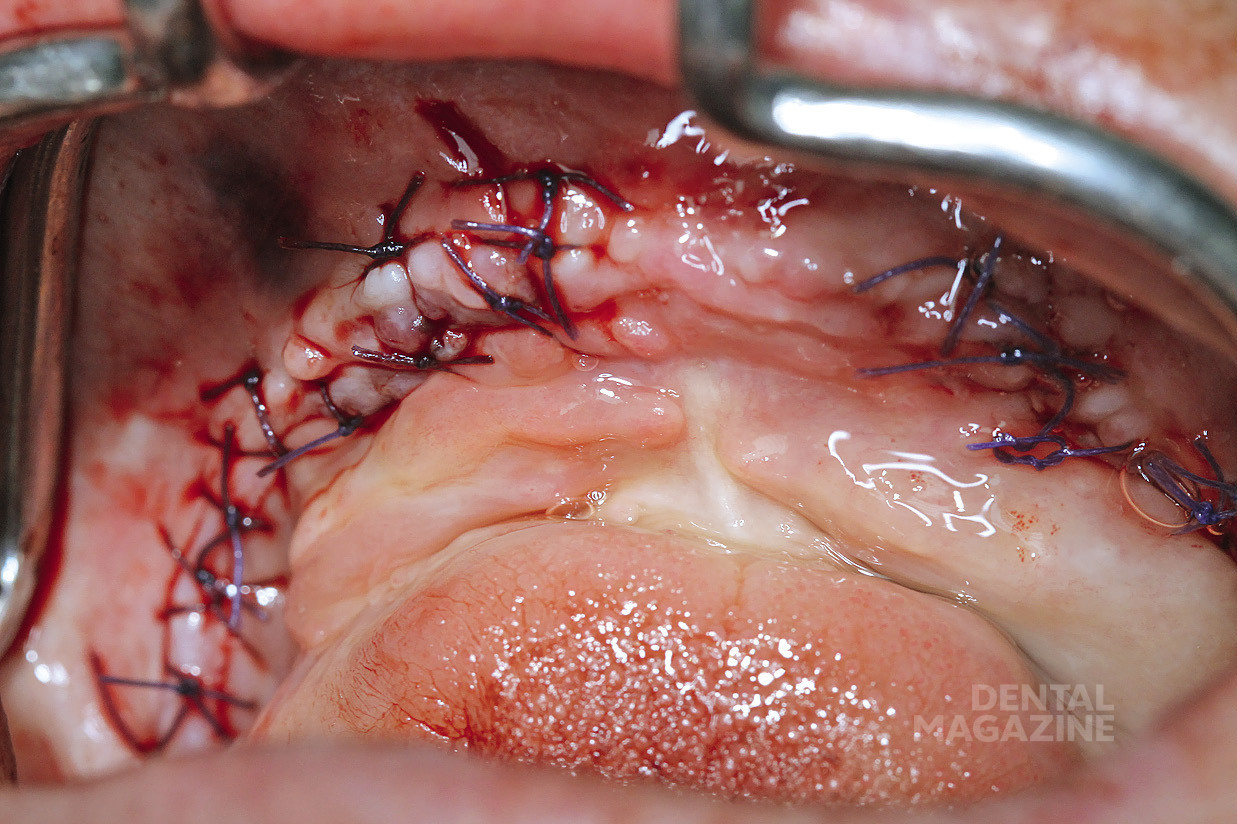
Рис. 29. Ушивание раны
Рис. 30. Ортопантомограмма после операции
После операции пациенту проводят конусно-лучевую компьютерную томографию для контроля результата оперативного вмешательства. Результаты вмешательства (согласно данным КЛКТ) оценены как удовлетворительные.
Применение пьезохирургии при латерализации нижнего альвеолярного нерва имеет следующие преимущества:
Многие авторы считают, что недостатком метода является увеличение операционного времени (Eggers et al.; Stubinger etal.; Schlee et al.; Bovi; Baldi et al.). В нашей практике использование пьезохирургии при транспозиции нижнего альвеолярного нерва увеличивает операционное время не более чем на 30 минут, что, по нашему мнению, несущественно по сравнению с полученными преимуществами.
Выводы
Применение пьезохирургии при транспозиции нижнего альвеолярного нерва позволяет снизить риски травмы нижнечелюстного нерва, что расширяет показания для применения методики у пациентов с выраженной атрофией дистальных отделов нижней челюсти.
Правосторонняя латерализация что это
Список сокращений
ННР — нижняя носовая раковина
КТ — компьютерная томография
ОНП — околоносовые пазухи
ХР — хронический ринит
За последние годы число больных, страдающих нарушением носового дыхания, непрерывно растет. Затрудненное носовое дыхание оказывает пагубное влияние на качество жизни, работоспособность и сон, а также является предрасполагающим фактором развития таких патологий, как воспалительные заболевания околоносовых пазух (ОНП), слуховой трубы, среднего уха, глотки, гортани и нижних отделов дыхательных путей, что может отрицательно сказаться на функциональном состоянии сердечно-сосудистой системы, приводит к целому комплексу неврологических расстройств. Так, например, при отсутствии носового дыхания вентиляция легких уменьшается на 25—30%. Одной из причин нарушения дыхательной функции носа является патология нижних носовых раковин (ННР) [1].
ННР — это единственная раковина, которая представлена самостоятельной костью. Она имеет сложное строение, а ее свободный конец — различную форму. У ННР выделяют челюстной отросток (processus maxillaris) — самый большой отросток ННР, представленный тонкой костной пластинкой, которая участвует в формировании медиальной стенки верхнечелюстной пазухи. Верхним концом челюстной отросток прикрепляется к верхнему краю свободного края ННР. Другой отросток, слезный (processus lacrymalis), расположен ближе к переднему концу ННР и участвует в формировании носослезного канала. Решетчатый отросток (processus ethmoidalis) расположен ближе к заднему концу ННР. Еще один отросток представлен костной пластинкой, форма которой вариабельна. При дыхании он создает турбулентные потоки воздуха, участвуя в реализации барьерной и дыхательной функций носа. Именно этот отросток становится причиной нарушения носового дыхания у пациентов.
Для критической оценки разных методов хирургического лечения ННР необходимо учитывать функции ННР. Во-первых, она участвует в формировании инспираторного сопротивления, что влияет на легочную вентиляцию [2]. Во-вторых, ННР является частью области носового клапана и помогает преобразовать инспираторный воздушный поток из ламинарного в турбулентный, что влияет на увлажнение, согревание и очистку вдыхаемого воздуха.
К сожалению, все известные методы консервативного лечения, направленные на различные звенья этиопатогенеза хронического ринита (ХР), не дают стойкого положительного эффекта, а затруднение носового дыхания остается преобладающим симптомом [3—5]. Таким образом, хирургическое лечение в большинстве случаев является единственным эффективным способом восстановления нормального носового дыхания [4].
Хирургическое вмешательство на ННР является одной из наиболее частых операций, которая выполняется с целью восстановления носового дыхания [6]. В основе всех хирургических методик заложен принцип уменьшения объема кавернозной ткани ННР за счет механического, физического или химического воздействия. Тем самым достигается увеличение просвета общего носового хода и улучшение носового дыхания [7, 8]. Выбор хирургической методики должен быть не только малоинвазивным и гарантировать раннюю реабилитацию больного, но и обеспечивать долгосрочную эффективность проведенного лечения.
Не следует забывать о том, что различные хирургические методики, применяемые при лечении ХР, не всегда оказываются функциональными, а зачастую — технически сложными, с большой степенью вероятности развития осложнений во время или после их проведения. На практике отмечается увеличение частоты послеоперационных рецидивов, хирургическое вмешательство носит кратковременный эффект, а иногда и вовсе не дает никакого результата и приводит к необходимости повторного хирургического лечения [9, 10].
Исходя из этого, можно сказать, что все известные методы хирургического лечения недостаточно эффективны, а проблема лечения ХР остается актуальной. До сих пор нет четких критериев и показаний к выбору конкретного метода операции и способа хирургического лечения.
На сегодняшний день используются три вида вмешательств на ННР, которые могут выполняться в нескольких модификациях: деструкция кавернозной ткани ННР при вазомоторном рините; щадящее иссечение ткани ННР (турбинотомия) при фиброзной гипертрофии ННР; подслизистая остеоконхотомия (подслизистая резекция кости носа) при косной гипертрофии ННР [11]. На практике применяется такой вид хирургического вмешательства на ННР, как медиальная люксация раковины с последующей латерализацией, который преследует цель увеличения просвета общего носового хода без вмешательства на тканях раковины [12, 13]. По сути это ятрогенный перелом ННР со смещением. Хотя этот вид операции широко применяется в практической оториноларингологии, можно с уверенностью констатировать, что на сегодняшний день нет четких показаний для проведения этого хирургического вмешательства и отсутствуют научные данные по его клинической эффективности.
Цель исследования — измерение определенных параметров и выявление анатомических особенностей ННР, влияющих на эффективность латерализации.
Материал и методы
Проанализировали цифровой архивный материал отделения лучевой диагностики на базе НИКИО им Л.И. Свержевского. Пациенты были разделены на две группы.
В 1-ю (катамнестическая) группу включили 73 добровольца без патологий ОНП (40 женщин и 33 мужчин; 146 ННР). Критериями исключения являлись: возраст менее 18 лет, посттравматические изменения лицевого скелета, хронические и острые воспалительные процессы в полости носа и ОНП, наличие операций в полости носа в анамнезе.
Всем пациентам выполнялась компьютерная томография (КТ) носа и ОНП при помощи программы RadiAnt DICOM Viewer в коронарной проекции с толщиной среза 0,5 мм. Изображение увеличивали до 300—600%, при котором четко выявлялась костная структура ННР.
Все измерения проводили на 4 уровнях (срезах): передний край костной пластинки ННР, processus lacrymalis, processus ethmoidalis, задний край костной пластинки ННР. На каждом срезе строили перпендикуляр (a) к дну полости носа в области передней носовой ости и измеряли расстояние в самой узкой части между смоделированной перегородкой носа и свободной костной пластинкой ННР (слева — СD, справа — EF). Дополнительно производили измерения расстояния между основаниями свободных костных пластинок ННР с 2 сторон (АВ). При проведении измерения толщины ННР было установлено, что костная пластинка ННР имеет локальные сужения — «перешейки».
Во 2-ю (клиническая) группу вошли 54 пациента (25 женщин и 29 мужчин; 108 ННР) в возрасте от 18 до 68 лет. Критерии включения: нарушение носового дыхания, искривление перегородки носа, гипертрофический ринит. Критерии исключения: костная гипертрофия ННР, наличие операций в полости носа в анамнезе, посттравматические изменения лицевого скелета. Всем пациентам были выполнены септопластика, двусторонняя нижняя щадящая конхотомия, латерализация ННР. КТ ОНП проводилась перед операцией и через 1 и 6 мес после вмешательства. На компьютерных томограммах носа и ОНП, полученных на дооперационном этапе, измеряли толщину костной пластики ННР (мм) на всем ее протяжении и отрезки СD и EF. Далее сопоставляли данные КТ до и после операции, при этом особое внимание уделяли положению косных отломков ННР по отношению к месту перелома и сравнивали полученные данные с результатами дооперационного исследования. Эффективность латерализации оценивали с позиции увеличения просвета общего носового хода, т.е. отрезков СD и EF после операции. В настоящем исследовании не оценивали клиническую эффективность латерализации как самостоятельного метода лечения, поскольку комбинировали ее с септопластикой и двусторонней нижней щадящей конхотомией.
Результаты и обсуждение
Обсуждение результатов в 1-й группе
По данным векторного анализа КТ анатомии ННР, в переднем отделе представлен пирамидальный отросток с широким основанием, толщина которого составляет 1,24±0,01 мм (рис. 1, табл. 2). На том же срезе отрезки СD и EF составили 8,87±1,57 мм (рис. 2). Отрезок АВ составил 20,25±2,10 мм, имел тенденцию к увеличению на последующих срезах и достигал максимума в области хоан.

У 100% добровольцев перешейки ННР на этом уровне не определялись.
Таблица 2. Параметры ННР относительно полости носа, мм

Постепенно основание отростка сужалось и на уровне processus lacrymalis ННР принимало форму ламеллы толщиной 0,96±0,01 мм, направленной вниз. При проведении измерения толщины ННР на уровне processus lacrymalis в 86 (58,9%) случаях было установлено, что по длине пластинка имеет локальное сужение (перешеек) толщиной 0,52±0,01 мм (рис. 3 а, б, табл. 1).

а — толщина ННР; б — стрелками показаны места сужения костной пластинки ННР.

В 52 (35,6%) случаях на уровне processus lacrymalis отмечено наличие 1 «перешейка», а в 34 (23,3%) — 2 и более, в то время как у 60 (41,1%) ННР наличие перешейка при КТ не было обнаружено. Отрезок AB увеличился на 2,8% и составил 20,83±2,42 мм, а CD и EF уменьшились на 21,6% и составили 6,95±1,09 мм (рис. 4, табл. 2).

На уровне processus ethmoidalis перешеек ламеллы ННР был зафиксирован в 121 (83,5%) случае. В 31 (21,3%) исследовании количество перешейков составило не более одного, а в 90 (61,6%) — от 2 до 5 (рис. 5, табл. 2).

Стрелками показаны «перешейки» ННР.
Отрезок АВ увеличился и составил 21,95±3,11 мм. На уровне processus ethmoidalis в 100% случаев было отмечено максимальное сужение общего носового хода и минимальные значения отрезков СD и EF 6,15±1,40 мм, что на 11,5—50,5% меньше, чем на остальных уровнях (рис. 6, табл. 2).

В дорсальных отделах длина ННР постепенно уменьшается, а толщина основания увеличивается, достигая 1,16±0,01 мм (рис. 7). В 100% случаях перешеек не визуализировался. Отрезки AB и CD, EF достигли своих максимальных значений 25,95±3,19 и 12,43±1,37 мм соответственно (рис. 8, табл. 2). На всех уровнях различий в строении ННР у мужчин и у женщин не было выявлено.

Стрелкой указан отрезок, определяющий толщину ННР.

Обсуждение результатов 2-й группы
Во 2-й группе, в зависимости от эффективности латерализации (по результатам контрольной КТ ОНП через 1 и 6 мес после операции) пациенты были разделены на 2 подгруппы. Из 54 прооперированных пациентов во 2-а подгруппу вошло 36 (67,7%) человек, у которых было отмечено смещение костного отломка латерально, за счет чего происходило увеличение просвета общего носового хода. Именно эти данные свидетельствуют об эффективности латерализации. У всех пациентов подгруппы 2-а перелом пришелся на «перешеек», который располагался максимально близко к основанию костной пластинки ННР. Ширина отрезков СD и EF увеличивалась в среднем на 3,5±1,38 мм (рис. 9 а, б). В подгруппе 2-б у 18 (32,3%) пациентов увеличение отрезков СD и EF после латерализации не наблюдалось, а места перелома проходили намного дальше от места крепления свободной костной пластинки ННР (рис. 10 а, б).

а — до операции; б — через 6 мес после операции, стрелками показаны места переломов ННР

а — до операции; б — через 6 мес после операции, стрелками показаны места переломов ННР.
Заключение
Анализ КТ ОНП показал, что свободная костная пластинка ННР имеет места сужения («перешейки») толщиной 0,52±0,01, через которые в 100% случаев проходит линия перелома при латерализации. На уровне лакримального отростка «перешейки» определялись в 58,9% случаев, а на уровне этмоидального отростка составили 82,9%.
С использованием анализа КТ ОНП до и после хирургического лечения была объективно оценена эффективность смещения отломков при латерализации. Выявили, что положительный результат зависел от анатомического строения и уровня линии перелома ННР и был зафиксирован у 67,7% пациентов (перелом приходился у основания свободной костной пластинки ННР), в то время как у 32,3% пациентов латерализация оказалась неэффективна (перелом определялся дистальнее основания ННР).
Участие авторов:
Концепция и дизайн исследования — Г.Ц.
Сбор и обработка материала — Г.Ц., Т.К., М.М.
Статистическая обработка — Г.Ц., А.Т., Т.К., А.К.
Написание текста — Г.Ц., А.А-К., Т.К.
Редактирование — Г.Ц, Н.К.
Авторы заявляют об отсутствии конфликта интересов.