После химиотерапии болит печень что можно принимать
Лечение после химиотерапии
Химиотерапия – один из безоперационных способов борьбы с раком. Лечение основано на введении в организм больного препаратов, которые содержат токсины и яды, сдерживающие или полностью прекращающие рост злокачественной опухоли. Химиотерапия наносит громадный урон человеческому организму. В результате воздействия ядов и токсинов повреждаются и гибнут не только атипичные клетки, но и здоровые, поражается печень, почки и другие системы. Поэтому после химиотерапии человеку необходимо лечение – комплексное, профессиональное, которое поможет справиться с побочными эффектами, пойти на поправку и полностью восстановиться.
Когда показана химиотерапия?
Решение о медикаментозном лечении онкологии принимает лечащий врач, основываясь на результатах анализов и аппаратных исследований. Как правило, к химиотерапии прибегают в следующих случаях:
Чаще всего медикаментозная терапия онкологии назначается для профилактики метастазирования ранее удалённых опухолей, а также лечения рака крови (лейкоз, гемобластоз) и других редких видов злокачественных новообразований (хориокарцинома, рабдомиосаркома). Также химиотерапия применяется для подготовки опухоли к операции – чтобы хирург мог её полностью удалить, не оставив ни единой раковой клетки.
Какие препараты химиотерапии для каких опухолей применяются
Это 2 группы средств консервативного лечения рака – цитостатики и цитотоксины. Первые проникают в атипичную клетку, нарушают её ДНК, запуская процесс самоуничтожения. Чаще всего для лечения используются следующие цитостатики: Гидроксимочевина, Фторурацил, Циклофосфан, препараты платины.
Цитотоксины уничтожают клетки – и раковые, и здоровые, вызывая тяжёлые побочные эффекты в организме у больных раком. Среди таких препаратов выделяют несколько групп:
Больше всего побочных эффектов у цитостатиков и цитотоксинов. Поэтому лечение после химиотерапии – неотъемлемая часть процесса избавления от рака. Оно позволяет ускорить восстановление клеток организма, облегчить состояние больного и улучшить качество его жизни.
Побочные эффекты химиотерапии
Рак – тяжёлое заболевание, которое требует от пациента немалых физических и эмоциональных сил для лечения. Побочные эффекты, среди которых не только физиологические, но и психологические страдания, многих выбивают из колеи, заставляя замкнуться, отгородиться от внешнего мира. Это часто приводит к ухудшению общего состояния больных раком.
Наиболее частые побочные эффекты при лечении химиотерапией:
Это лишь небольшая часть побочных эффектов при лечении рака химиопрепаратами. Реакция организма зависит не только от его индивидуальности, но и от применяемых средств. Если больному раком назначают для лечения лекарства таргетной терапии, то проблем с ЖКТ скорее всего не будет. У таких пациентов почти не бывает тошноты, рвоты, изжоги, поносов и запоров. Также большую роль играет предподготовка к лечению, которая позволяет провести реабилитацию большинства хронических заболеваний. Это помогает избежать их обострения после химиотерапии и быстрее восстановиться.
Лечение онкобольных после медикаментозной терапии рака
Применение лекарств для купирования злокачественного процесса имеет множество положительных моментов, за исключением одного – побочных эффектов. Однако с ними можно справиться, если своевременно начать лечение после химиотерапии рака.
Его назначает лечащий врач, опираясь на результаты последних анализов, аппаратных исследований и жалобы пациента. Лечение включает в себя:
Диета в пост лечении рака
Одна из распространённых реакций организма на терапию препаратами, содержащими яды и токсины – тошнота и потеря аппетита. Отказываться от еды нельзя, потому что она даёт силы для восстановления, однако рацион пересмотреть придётся.
Основные рекомендации по питанию больных раком, которые восстанавливаются после лечения химиотерапией:
Рекомендации по самому рациону касаются не только продуктов, но и приготовления различных блюд:
В день больному раком, который проходит лечение после воздействия химиопрепаратами, нужно выпивать около полутора литров жидкости. По этому вопросу рекомендуется проконсультироваться с врачом. Если наблюдается скопление жидкости в брюшине, лёгких или плевральной полости, её количество ограничивают.
Иммуномодуляторы в пост лечении рака
Химиотерапия для организма человека представляет сильнейший стресс. Больше всего повреждается костный мозг, отвечающий за кровь. После лечения её показатели значительно ухудшаются, показывая нехватку основных компонентов – лейкоцитов, эритроцитов и тромбоцитов, из-за чего возникают лейкопения, эритропения, тромбоцитопения.
Нехватка белых кровяных телец в организме сказывается на иммунитете – он становится настолько слабым, что больной может подхватить любую инфекцию или вирус, к которым ранее был невосприимчив. Для коррекции состояния больных раком лечение после химиотерапии всегда включает препараты-иммуномодуляторы, которые стимулируют гемопоэз (процесс кроветворения в костном мозге):
Иммуномодулирующие препараты применяются для улучшения качества жизни пациентов, больных раком. Их эффективность доказана более чем 30-летней практикой применения у онкологических больных во время химиотерапии и в период восстановления.
Симптоматическое лечение
Лечение расстройств ЖКТ
Первое, что делает врач – устанавливает причину состояния. Тошнота и рвота возникают не только от отравления организма больного раком при лечении токсическими противоопухолевыми препаратами. Часто это происходит в результате кишечной непроходимости – механической или динамической (отёк головного мозга, гиперкальциемия). Если ничего серьёзного не обнаружено, больному раком для лечения прописывают Церукал или Дексаметазон, если они действуют слабо, могут назначаться Зофран, Навобан, Осетрон.
Запор – один из побочных эффектов химиотерапии у особо тяжёлых больных. Здесь рекомендации врача исключительно индивидуальны. Если не стоит вопрос об оперативном лечении запора, проводят поэтапную терапию:
Диарея возникает либо как функциональное нарушение, либо как психоневрологическое осложнение после химиотерапии рака. Лечение включает в себя:
Если анализы выявляют инфекционную природу диареи, для лечения состояния назначаются антибиотики.
Печень и почки
Оба органа участвуют в фильтрации, а потому сильнее остальных поражаются при лечении от рака. Для восстановления печени сначала нужно её очистить от скопившихся в ней вредных веществ. Для этой цели применяется Легалон – препарат на основе семян расторопши. После очищения основная задача – восстановить повреждённые химиотерапией клетки печени, чтобы орган снова заработал корректно и начал выполнять свою прямую функцию – очищать кровь от вредных веществ. Для лечения используют БАДы – Эссенциале Форте, Карсил, Флор Эссенс.
С почками несколько сложнее. Агрессивное воздействие токсических/ядовитых препаратов может вызвать мочекислую нефропатию, почечную недостаточность. Для восстановления правильной работы почек применяют:
Если диагностируются воспалительные заболевания почек и мочевыводящих путей, для лечения назначаются антибактериальные препараты – Нитроксолин, Фурадонин.
Кровь
При лечении рака сильнодействующими токсичными препаратами в крови наблюдается сильная нехватка компонентов. Чтобы повысить уровень лейкоцитов, назначаются витаминные комплексы, содержащие витамины группы B, в частности B9 и 12.
Аскорбиновая и фолиевая (витамин B9) кислоты, кальций + витамин D3, магний и цинк ускорят выработку тромбоцитов. Эритроциты восстанавливаются самостоятельно. Повысить гемоглобин можно с помощью витаминов B12, B9, препаратов железа.
Психологическая помощь
Для пациентов, больных раком, свойственны стрессы и депрессия, которые загоняют человека в состояние безысходности и апатии. Это прямым образом сказывается на процессе лечения и выздоровления. Помощь психотерапевта в такой ситуации необходима. Важно найти своего врача, которому можно доверять и рассказывать о своих страхах и фобиях. Это поможет больному раком вернуться к полноценной жизни в социуме.
После каждого курса химиотерапии пациент нуждается в комплексном лечении. Выполняя все рекомендации лечащего врача, больной быстрее восстанавливается, что позволяет ему не выпадать надолго из нормальной жизни.
Что вам необходимо сделать
2. Нашим пациентам мы предлагаем курсы реабилитации:
3. Если вам понравилась статья оставьте комментарии ниже.
На пути к безопасной химиотерапии
На пути к безопасной химиотерапии
«Доспехи» из чертополоха: новая стратегия защиты печени от побочных эффектов лекарств.
рисунок автора статьи
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: На протяжении последних 50 лет химиотерапия, несмотря на серьёзные побочные эффекты, остаётся главным способом лечения рака. Значительный урон при этом наносится клеткам печени — гепатоцитам, в связи с чем понятие «гепатотоксичность» до недавнего времени было практически неотделимо от химиотерапии. Результаты новых исследований указывают на возможность сменить эту парадигму и сделать лечение рака гораздо более безопасным. Рассказываем о новом подходе, предложенном в 2020 году коллективом российских и американских учёных.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Лекарства из «чёрного ящика»
Лекарственная гепатотоксичность — это появление структурно-функциональных поражений печени, вызванных приёмом фармацевтических препаратов.
Противораковые средства на основе дакарбазина широко используются в клинической практике для лечения злокачественной меланомы, саркомы мягких тканей, классической лимфомы Ходжкина и неходжкинской лимфомы [8]. Однако, несмотря на высокую терапевтическую эффективность, данные многочисленных исследований свидетельствуют о тяжёлых гепатотоксических побочных эффектах дакарбазина [4], [9–10]. При этом наибольший урон печени наносят активные формы кислорода — свободные радикалы, которые вырабатываются в ответ на приём противоракового лекарства [10].
Новая стратегия защиты печени
На базе Государственного университета Южной Дакоты российско-американский коллектив учёных разработал стратегию по защите печени от негативного влияния противораковых препаратов. Предложенный подход, не нарушая эффективности химиотерапии, позволяет значительно снизить показатели гепатотоксичности, при этом морфология печени остается близкой к нормальной. Успешность разработки была подтверждена в ходе экспериментов на животных. Результаты этого исследования опубликованы в журнале Frontiers in Bioengineering and Biotechnology [11]. Кроме того, новая стратегия по снижению побочных эффектов гепатотоксичных лекарств была защищена патентом.
В чём новизна?
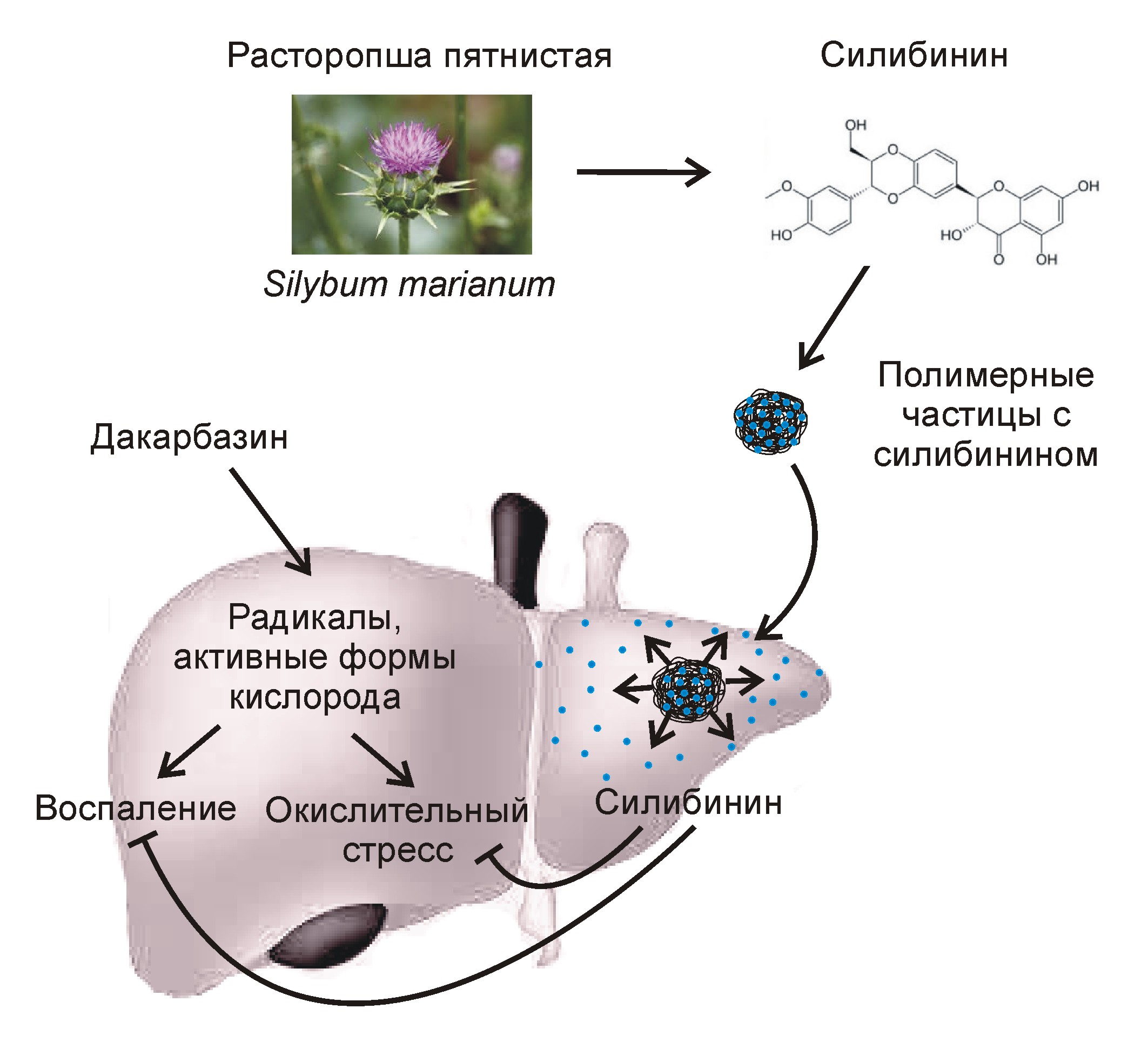
Существующие в настоящее время методы защиты печени от гепатотоксичных лекарств предполагают продолжительный приём таблеток, содержащих молекулы-протекторы. Одним из наиболее часто используемых гепатопротекторов с доказанной клинической эффективностью является силимарин или его активный компонент – силибинин. Это вещество, полученное из семян расторопши (чертополоха), активирует антиоксидантные клеточные механизмы, напрямую нейтрализует свободные радикалы, препятствует провоспалительной активации макрофагов печени, вызванной приёмом лекарств.
Важно отметить, что фармакокинетика лекарств-гепатопротекторов, включая силибинин, далека от идеальной. Вводимые перорально, они очень быстро выводятся из организма, и лишь небольшая их часть достигает печени, что не позволяет в полной мере запустить защитные процессы. К тому же при таком подходе часть протекторных агентов может попадать в опухоль и оказывать нежелательное воздействие на ход противораковой терапии. Стандартный внутривенный способ введения этих молекул в свободном виде практически неосуществим из-за их низкой растворимости в воде.
Фармакокинетика — совокупность процессов, происходящих с лекарством после его попадания в организм: всасывание, распределение, метаболизм и выведение.
Чтобы преодолеть вышеуказанные ограничения, учёные разработали новую стратегию высокоэффективной доставки силибинина в печень путем его внутривенного введения в наноинкапсулированном виде. Препарат предназначен для использования перед началом химиотерапии в качестве превентивного средства. За счёт применения полимерных нанокапсул в качестве носителя гепатопротектор за короткое время и в достаточном количестве накапливается в тканях печени и запускает в них каскад реакций, благодаря которым активируются механизмы антиоксидантной защиты клеток. Таким образом, препарат позволяет эффективно «подготовить» печень к встрече с цитотоксическим противораковым лекарством.
Новый препарат стал результатом совместной работы химиков и специалистов по биомедицинской инженерии. Его активным компонентом является силибинин, а носителем служат нанокапсулы из полилактид-ко-гликолида — безопасного биоразлагаемого полимера (рис. 1). Разработанный метод инкапсуляции позволил получить однородные по размеру наночастицы с высоким содержанием силибинина (его массовая доля составила 15%). Одним из достоинств данного препарата является то, что активный компонент медленно выделяется из нанокапсул, что обеспечивает его повышенную концентрацию в тканях печени в течение продолжительного времени.
Рисунок 1. Препарат на основе силибинина и полимерных наночастиц для защиты печени от побочных эффектов противоракового лекарства (дакарбазина).
рисунок автора статьи
Превратить недостатки полимеров в достоинства
Любопытно, что классическим «недостатком» полимерных носителей для адресной доставки лекарств обычно считается их быстрое накопление в печени. Это серьёзно ограничивает возможности терапии с использованием полимерных носителей, т.к. в идеале они должны достигать очага поражения, минуя здоровые ткани и органы, в особенности — печень. Но в данном случае задача адресной доставки была совсем иной. Необходимо было обеспечить попадание молекулы-протектора именно в печень, и учёные превратили ключевой «недостаток» полимерных носителей в ощутимое преимущество.
Стоит отметить, что использование нанокапсул снижает риск локализации гепатопротектора в опухоли, что неизбежно при пероральном приеме таблеток. Таким образом, удаётся избежать возможного нежелательного воздействия этих молекул на эффективность противораковой терапии.
Опсонизация — процесс адсорбции опсонинов (специальных белков) на поверхности инородных частиц, который стимулирует и облегчает их фагоцитоз.
Испытания на животных
В качестве противоопухолевого препарата, от которого нужно защищать печень, исследователи выбрали дакарбазин. Его часто используют для лечения злокачественных опухолей меланомы. К сожалению, несмотря на высокую терапевтическую эффективность, многочисленные исследования сообщают о гепатотоксических побочных эффектах лекарства, которые зачастую вынуждают прекращать терапию [4], [9]. В клинической практике наблюдались случаи острой печёночной недостаточности, веноокклюзионной болезни печени и даже смерти в течение нескольких дней после приёма дакарбазина.
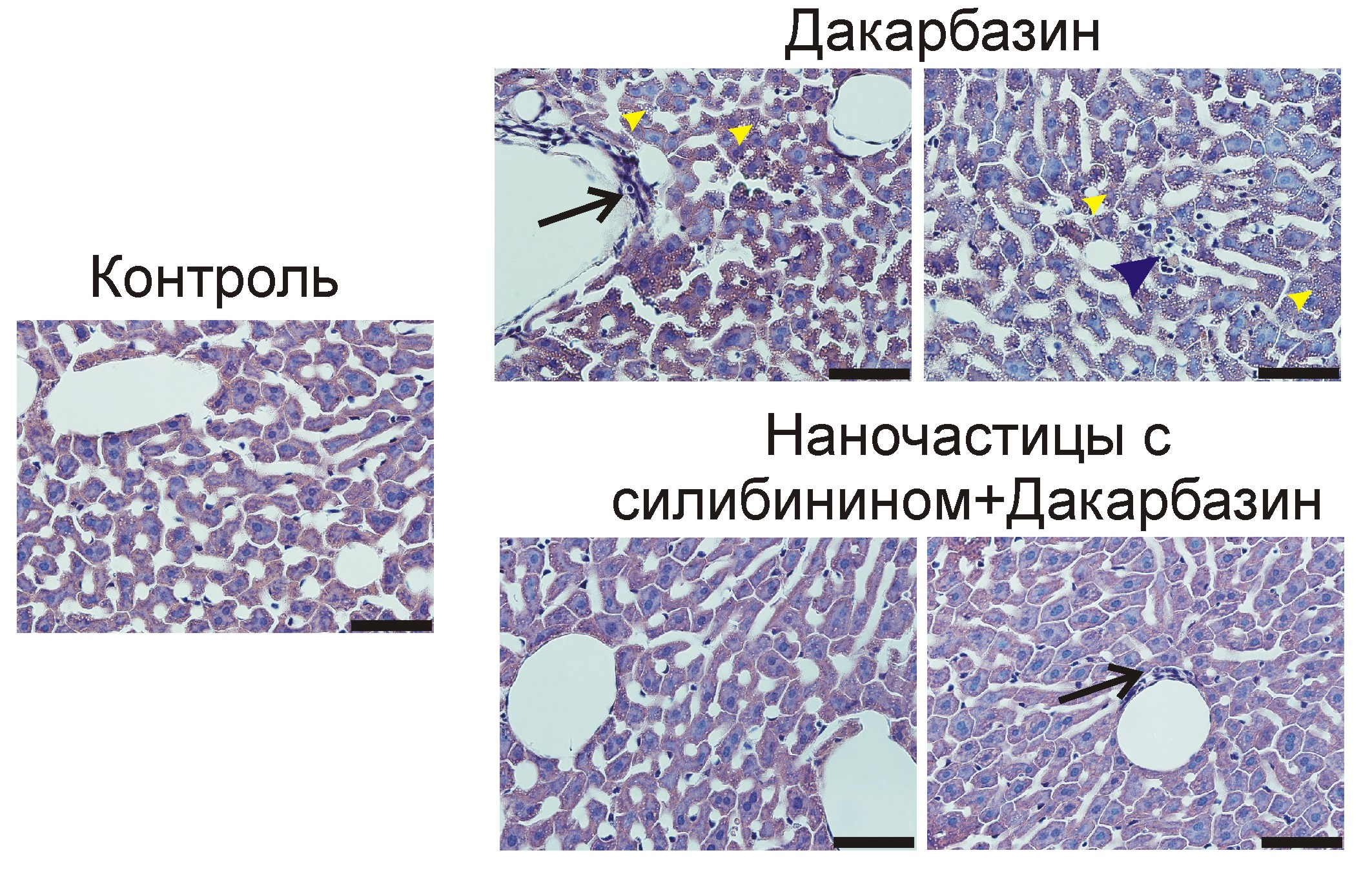
В ходе доклинических испытаний животные с раковыми опухолями подвергались химиотерапии путём системного введения дакарбазина. Часть мышей проходила предварительную «подготовку», получая разработанный учёными препарат для защиты печени. Исследователи подобрали оптимальный временной интервал между введением протектора и дакарбазина, позволяющий получить наилучший защитный эффект. У животных, прошедших стандартную химиотерапию, были обнаружены признаки серьёзного повреждения печени — некроз сосудистого эндотелия, вакуолизация и некроз гепатоцитов. А морфология печени мышей, предварительно получавших протектор на основе нанокапсул и силибинина, была близка к нормальной (рис. 2).
Рисунок 2. Морфология печени мышей, подвергавшихся воздействию дакарбазина и нового гепатопротектора. Контроль (нормальная морфология); дакарбазин (признаки повреждения печени); наночастицы с силибинином + дакарбазин (нормальная морфология, признаки повреждения отсутствуют). О некрозе гепатоцитов свидетельствует скопление лейкоцитов, поглощающих остатки погибших клеток (синяя стрелка). О некрозе сосудистого эндотелия свидетельствует скопление лейкоцитов в области эндотелия (чёрная стрелка). О вакуолизации свидетельствует наличие внутриклеточных пузырьков в гепатоцитах (жёлтые стрелки). Срезы окрашены гематоксилином и эозином.
Выбор оптимальных условий
Одним из механизмов действия силибинина является активация транскрипционного фактора Nrf2, который, в свою очередь, запускает в клетках экспрессию антиоксидантных ферментов, ферментов, восстанавливающих редокс-потенциал, и ферментов, способствующих деактивации свободных радикалов. Перед тем, как определиться с интервалом между введением протектора и дакарбазина, учёные поставили эксперимент, в котором определили, спустя какое время после однократного внутривенного введения протектора экспрессия этих ферментов в печени достигает максимальных значений. Именно это время соответствует наилучшей «подготовленности» клеток к встрече с цитотоксическим лекарством. Оно и было выбрано для дальнейших экспериментов в качестве интервала между введением протектора и дакарбазина (24 часа).
«Возможно, благодаря новой разработке удастся снять ограничения с широкого ряда лекарственных препаратов, использование которых лимитируется их гепатотоксичностью. Презентация наших работ в Бостоне на конференции CRS (Controlled Release Society) вызвала интерес со стороны фармацевтических компаний. Возможно, этот интерес перерастёт в проведение клинических испытаний», — отметил руководитель лаборатории, профессор Государственного университета Южной Дакоты Джошуа Рейнеке.
Все составные части разработанного препарата являются биосовместимыми и уже применяются в медицинской практике, что повышает шансы на ускоренный путь нового лекарства к клиническому использованию.
Диагностика и лечение гастроэнтерологических осложнений химиотерапии у онкогематологических больных в педиатрической практике

Мукозит является потенциальным осложнением системного противоопухолевого лечения. Рассмотрены подходы к диагностике, а также лечению и профилактике мукозита у онкологических больных. Тщательный контроль за пациентами и своевременное начало адекватной тера
Mucositis is a potential complication of systemic anti-tumor treatment. Approaches to the diagnostics were considered, as well as treatment and prevention of mucositis in oncologic patients. Thorough supervision over the patients and timely beginning of the relevant therapy allow to relief the developed complications quickly and completely, and continue anti-tumor treatment.
Злокачественные новообразования занимают одно из ведущих мест среди причин смерти людей во всех странах мира. Распространенность злокачественных новообразований среди детей и подростков в России высока, при этом она нарастала на протяжении прошлых лет (увеличившись, в частности, с 10,3 на 100 000 детей в 2002 г. до 12,3 в 2012 г.) и имеет тенденцию к дальнейшему росту [1]. Первое место в структуре онкологической заболеваемости у детей в России занимают лейкозы (35,6%), далее следуют опухоли центральной нервной системы (17,0%), лимфомы (11,0%), опухоли почек (7,1%), мягких тканей (5,5%), костей и суставных хрящей (4,6%) [2].
В современной педиатрической онкологии химиотерапия наряду с хирургическими методами и лучевым воздействием является одним из важнейших компонентов лечения больных. Ее совершенствование идет по пути как повышения воздействия на опухолевые клетки, так и снижения повреждающего действия цитостатических препаратов на нормальные ткани и физиологические функции организма.
Изменения со стороны желудочно-кишечного тракта (ЖКТ) на фоне полихимиотерапии являются самым частым осложнением данного метода лечения у пациентов с онкогематологическими заболеваниями. Эти осложнения в большинстве случаев изменяют состояние больных, являются предрасполагающим фактором для развития инфекций за счет нарушения барьерных функций слизистых оболочек, могут служить причиной летальных исходов [3].
Термин «химиотерапия» означает использование цитотоксических агентов, т. е. лекарств, токсичных для клеток. Химиотерапевтические средства назначаются или по одному (режим монохимиотерапии), или в комбинациях (полихимиотерапия). Эти медикаменты могут использоваться или как единственный метод лечения злокачественных опухолей, или в сочетании с другими методами противоопухолевой терапии (хирургическим или лучевой терапией). Назначение химиотерапии требует от врача и всего медперсонала знаний механизмов действия цитостатиков, правил их хранения и применения, а также знаний о непосредственных, отсроченных и отдаленных последствиях их использования [4].
В профессиональной среде онкогематологов для обозначения изменений ЖКТ на фоне химиотерапии часто используется термин «мукозит ЖКТ» [5].
Термин «мукозит» обозначает воспалительную реакцию со стороны слизистой оболочки на протяжении всего ЖКТ, возникающую при проведении химиотерапии и/или лучевого лечения, в результате которой происходит нарушение процесса непрерывного деления эпителиальных клеток, выстилающих ЖКТ, что делает ткань слизистой оболочки открытой для изъязвления и инфицирования. Образовавшиеся обширные язвенные дефекты являются причиной выраженного болевого синдрома, нередко требующего введения наркотических анальгетиков, приводят к синдрому мальабсорбции, нутритивной недостаточности, диктуют необходимость перехода на парентеральное питание больного [6].
Миелосупрессия может быть как следствием самого опухолевого процесса (лейкемии, метастазов в костный мозг), так и результатом цитостатического лечения. При использовании современных программ интенсивной химиотерапии это осложнение встречается практически у каждого второго леченого ребенка. Практически все цитостатики (за исключением аспарагиназы, винкаалкалоидов и блеомицина) являются миелотоксичными. Самым опасным проявлением миелосупрессии является нейтропения [4].
Нейтропения у больных, получающих химиотерапию, является одним из основных факторов, способствующих развитию инфекции. Нейтропения диагностируется при абсолютном количестве нейтрофилов в периферической крови менее 1,5 × 10 9 /л, а тяжелая нейтропения — менее 0,5 × 10 9 /л. Кроме того, больные в состоянии нейтропении с явлениями мукозита становятся чрезвычайно уязвимыми для инфекции, которая может оказаться фатальной. Все это требует продления госпитализации и существенно ухудшает качество жизни пациента [3].
Распознавание инфекций у больных с нейтропенией затруднено из-за извращения классической клинической картины в силу отсутствия у этих больных «нормального» воспалительного ответа [4].
Развитие побочных эффектов полихимиотерапии значительно ухудшает качество жизни больного и нередко представляет угрозу для жизни, что требует тщательного контроля состояния пациента на всем протяжении лечения, профилактики возможных осложнений, а при необходимости — осуществления деэскалации доз препаратов и проведения своевременной коррекции развившихся побочных эффектов.
Наиболее чувствительны к повреждающему действию химиопрепаратов быстро делящиеся ткани организма, к числу которых относится эпителий ЖКТ. Частота случаев гастроинтестинальной токсичности у больных, получающих полихимиотерапию, составляет 90%. Повреждение слизистой оболочки может развиться в любом отделе пищеварительного тракта (стоматит, эзофагит, гастроэнтерит, энтероколит, панкреатит, гепатит и реакция «трансплантат против хозяина (РТПХ)»). Наиболее часто отмечаются при проведении лучевой терапии опухолей головы и шеи, режима высокодозной химиотерапии (85–100%), реже при введении стандартных доз цитостатиков (5–40%). Наиболее часто мукозиты развиваются при применении препаратов фторпиримидинового ряда (5-фторурацил, капецитабин), метотрексата, этопозида, мелфалана, липосомального доксорубицина, бусульфана и др. [7].
В пределах 7–10 дня после химиотерапии или химиорадиотерапии у пациентов почти всегда развивается ороэзофагеальный мукозит или токсическое поражение ЖКТ [1, 8, 9].
Хотя гастроинтестинальная токсичность имеет индивидуальные особенности и в тяжести, и в продолжительности, это состояние достоверно приводит к нарушению приема пищи и мальабсорбции на срок до 2–3 недель после трансплантации костного мозга (ТКМ) [1, 9–11]. М. А. Кучер с соавт., опираясь на данные многих исследований, отмечают, что интестинальная токсичность возникает примерно у 99% больных, а мукозит 3–4 стадии — у 70% пациентов после трансплантации гемопоэтических клеток (ТГСК) [8, 12, 13].
Факт наличия мукозита способствует повышению риска возникновения инфекционных осложнений, увеличению продолжительности лихорадки, длительности использования парентерального питания, наркотических анальгетиков, увеличению смертности в первые 100 дней после ТКМ и ТГСК и затрат на лечение [13–16].
Единой общепринятой классификации мукозитов, развивающихся на фоне полихимиотерапии, нет [17].
M. Davila и R. S. Bresalier отмечают, что воспаление слизистой оболочки ЖКТ у пациентов с онкологическими заболеваниями может быть вызвано цитотоксическими эффектами химиотерапии и/или излучения или путем инфекции (вирусной, грибковой или бактериальной инфекции). Риск развития нередко повышается у ослабленных онкологических пациентов [18]. Другие причины мукозита, которые встречается у пациентов с раком, включают ГЭРБ, воспалительные заболевания кишечника (ВЗК), воспаление, индуцированное препаратами и РТПХ после ТГСК.
Учитывая имеющиеся данные, можно выделить следующую классификацию мукозитов у пациентов, получающих полихимиотерапию.
По этиологическим факторам выделяют:
Развитие мукозитов ранее связывалось с непосредственным цитотоксическим действием химиопрепаратов или лучевой терапии не только на опухолевые клетки, но и на быстро делящиеся нормальные клетки (в частности, эпителиальные клетки). Патогенез развития мукозита представлялся следующим образом: химиопрепарат и/или лучевое воздействие, вызывая прекращение процессов регенерации эпителия, приводит к образованию язвенного дефекта, колонизации бактериальной флорой и инфекционному воспалительному процессу. Именно вторичная инфекция считалась определяющим фактором в развитии мукозита, определяя его длительность и исходы. В настоящее время установлено, что инфекция является лишь дополнительным фактором в развитии осложнений полихимиотерапии.
Изучение патогенеза мукозита показало, что еще до развития каких-либо клинических проявлений первые морфологические изменения выявляются в подслизистом слое. Повреждение эндотелиальных клеток, апоптоз фибробластов развиваются гораздо раньше гибели эпителиоцитов [19]. Гибель подслизистых эндотелиоцитов, продуцирующих фактор роста кератиноцитов (ФРК), ключевого триггера роста и дифференцировки эпителиоцитов, приводит к истончению эпителиального слоя и образованию язв. Одновременно повышается продукция провоспалительных цитокинов (ФНО-α, ИЛ-6, ИЛ-1β), способствуя воспалительному процессу [20].
S. Sonis выделяет несколько фаз в развитии мукозита [21].
I. Инициирование: в результате прямого воздействия цитостатиков или лучевой терапии на эпителиоциты и клетки подслизистого слоя происходит высвобождение свободных кислородных радикалов (ROS), которые непосредственно повреждают клетки, ткани и кровеносные сосуды.
II. Первичное повреждение: ROS, воздействуя на клетки, вызывают повреждение нитей ДНК, приводящее к гибели клеток. Активация ядерного фактора транскрипции (NF-kB) в ответ на повреждение приводит к запуску целого каскада реакций, сопровождающихся выбросом провоспалительных цитокинов, а именно ФНО-α, ИЛ-6, ИЛ-1β. Одновременно активируются и другие гены, приводя к синтезу молекул адгезии, ЦОГ-2 и последующему ангиогенезу. В этой фазе снижается скорость обновления эпителия, что ведет к атрофии слизистой оболочки и подслизистого слоя.
III. Выработка и передача сигналов: активация фактора транскрипции — не единственный путь, ведущий клетки к апоптозу, параллельно или последовательно с ним ROS активирует керамидный путь за счет ферментов сфингомиелиназы и керамидсинтетазы, непосредственно вызывающих апоптоз. Кроме того, распад фибронектина активирует макрофаги и последующую выработку матричной металлопротеиназы (ММР), которая еще более активирует ФНО-α и ведет к повреждению тканей. Эта фаза приводит к существенным биологическим изменениям в слизистой оболочке и подслизистом слое, хотя визуально ткань может выглядеть неповрежденной.
IV. Изъязвление: фаза, наиболее богатая клиническими проявлениями. Повреждение эпителиальных стволовых клеток приводит к эрозивным изменениям слизистой оболочки. Язва служит центром для бактериальной колонизации, особенно в окружающей среде, столь богатой микроорганизмами. Развивается вторичная инфекция. Продукты распада бактерий проникают через подслизистую оболочку и, стимулируя макрофаги, приводят к новому выбросу провоспалительных цитокинов. Как правило, эта фаза совпадает с глубокой нейтропенией, при этом целые бактерии могут вторгаться в подслизистую оболочку, вызывать развитие бактериемии или сепсиса [22].
V. Заживление: данная фаза характеризуется восстановлением скорости эпителиального обновления (пролиферации и дифференцировки клеток), нормализацией состава микрофлоры окружающих тканей. Как правило, фаза заживления совпадает с периодом восстановления показателей периферической крови и завершается к 15–16 дню от начала химиотерапии [23].
Клиническая картина
Клинические проявления мукозита в разных отделах ЖКТ различны, что обусловлено специфической структурой и функцией слизистых оболочек [7, 24–27].
Чаще мукозитом страдают дети, что связывают с высокими темпами метаболизма в тканях, высокой скоростью митозов клеток эпителия, особенностями онкологической патологии и схемами (протоколами) химиотерапии [28, 29]. Гендерных различий в связи с мукозитом в детской практике не отмечают [26, 30, 31].
Цитостатики нарушают дифференцировку эпителия слизистой оболочки, приводя к усиленной микробной колонизации ее изъязвлений грамположительными, грамотрицательными и анаэробными бактериями, грибами рода Candida. Эти процессы могут прогрессировать вплоть до развития бактериемии (фунгемии) и сепсиса у пациентов с миелосупрессией [22, 32–36].
Риск возникновения мукозита обусловлен двумя группами факторов: связанными с лечением онкологического заболевания и ассоциированными с пациентом. К факторам, связанным с лечением, относят выраженное токсическое действие отдельных препаратов на слизистую кишечника, дозировку, режим введения, а также сочетания препаратов и методов лечения. Среди цитостатических препаратов, применяемых в детской онкологии, наиболее выраженное токсическое действие на слизистую ЖКТ оказывают: антиметаболиты (метотрексат, меркаптопурин, фторурацил), антрациклины (доксорубицин), алкилирующие агенты (бусульфан, циклофосфамид, тиотепа), винкаалкалоиды (винкристин), комплексные соединения платины (цисплатин, карбоплатин), противоопухолевые антибиотики (блеомицин), ингибиторы топоизомераз ДНК (этопозид, топотекан) [37–41]. Пациенты, у которых мукозит возник на фоне первого курса химиотерапии, имеют повышенный риск развития данного осложнения при последующих курсах, что объясняют эффектом кумуляции препаратов [22, 42, 43]. Риск возникновения мукозита возрастает также при комбинировании химиотерапии и лучевой терапии [26, 41, 44, 45].
Большое значение имеют факторы риска, ассоциированные с пациентом. К ним относят возраст (моложе 30 лет); пол (чаще у женщин); тип опухоли (чаще при гемобластозах и лимфопролиферативных заболеваниях); плохая санация ротовой полости до начала лечения; наличие в анамнезе сахарного диабета; нарушения функции почек и печени [46].
Наиболее частые симптомы орального мукозита проявляются эритемой, отеком, воспалением, атрофией и изъязвлением, что сочетается с выраженной болезненностью, кровоточивостью, дисгевзией и нарушением питания [24, 47–51].
В клинической симптоматике эзофагитов наблюдаются одинофагия, дисфагия, особенно — боль и затруднение глотания при употреблении жидкой пищи, могут появиться жалобы на одышку и боли в груди, при присоединении инфекционного процесса будет наблюдаться лихорадка. Реже эзофагит может протекать бессимптомно. Чаще всего ограничивается поражением поверхностных слоев слизистой оболочки пищевода и только в исключительных случаях вызывает глубокое воспаление стенки пищевода, которое может привести к образованию стеноза или фистулы.
Наиболее частым специфическим симптомом мукозита желудка и двенадцатиперстной кишки является боль в животе. Боли при типичном течении эрозивно-язвенных поражений локализуются в основном в эпигастральной и периумбиликальной областях. По характеру боли могут быть различными от ноющих до режущих и приступообразных. Характер болевого синдрома зависит от возраста, индивидуальных особенностей больного, состояния его нервной и эндокринной систем, анатомических особенностей эрозивно-язвенного дефекта, степени выраженности функциональных нарушений ЖКТ. Диспепсические симптомы проявляются в виде тошноты, рвоты, чувства тяжести в подложечной области, жжения в эпигастрии и изжоги. С увеличением продолжительности заболевания частота симптомов диспепсии нарастает.
Клинические проявления мукозита кишечника могут варьировать от умеренной диареи до угрожающего жизни энтероколита. У детей отмечаются выраженная диарея с потерей жидкости и белка, потеря аппетита и болевой синдром. Кроме того, данные симптомы могут сопровождаться повышением воспалительных маркеров (C-реактивный белок, прокальцитонин). Учащение дефекаций, изменение консистенции (жидкий, примесь слизи, крови) и увеличение объема стула, иногда появление болезненных тенезмов, вздутие и болезненность при пальпации живота; нередко эти симптомы могут быстро разрешаться, однако в тяжелых случаях приводят к дегидратации и потере массы тела, электролитным нарушениям, угрожающим жизни больного. При постановке диагноза необходимо помнить о дифференциальной диагностике и наиболее частых причинах диарейного синдрома у детей с гематологическими и онкологическими заболеваниями, таких как индуцированный полихимиотерапией мукозит, длительный прием иммуносупрессивных препаратов, нейтропенический энтероколит, вирусное поражение кишечника (ротавирус, аденовирус, цитомегаловирус и др.), Cl. difficile-ассоциированное поражение, бактериальное поражение (Salmonellas spp., Shigella spp., Campylobacter spp.) [52–55].
Диагностика
Для объективизации степени тяжести гастроинтестинального воспаления слизистой оболочки, вызванного химиотерапией у детей, были бы очень полезны специфические биомаркеры. Однако до настоящего времени такого идеального биомаркера гастроинтестинального воспаления слизистой оболочки нет. Как возможный биомаркер, дыхательная проба c 13 C-сахарозой показана для неинвазивной оценки состояния тонкой кишки у детей [56–58]. Главные недостатки этого метода — специализированное оборудование, необходимое для анализа. Кроме того, образцы выдыхаемого воздуха требуется брать каждые 15 минут в течение 2 часов, что позволяет приравнивать его к инвазивным методам у тяжелобольных детей и создает трудности при проведении у детей раннего возраста [56–59]. Другой дополнительный биомаркер — аминокислота цитруллин. Цитруллин синтезируется исключительно энтероцитами тонкой кишки, поэтому является надежным маркером массы энтероцита [60]. В доклинических исследованиях гастроинтестинального воспаления слизистой оболочки, вызванного метотрексатом у крысы, уровень цитруллина в крови был связан с длиной ворсинки [61–64]. Кроме того, в доклиническом исследовании снижение цитруллина было взаимосвязано с атрофией слизистой оболочки, независимо от рациона крыс [65]. Также в нескольких клинических исследованиях у взрослых больных снижение аминокислоты цитруллин в крови коррелировало с тяжестью гастроинтестинального воспаления слизистой оболочки кишечника и низкая концентрация цитруллина была достоверно связана с бактериемией [57–59, 66, 67]. Цитруллин, как показали исследования, является маркером гастроинтестинального воспаления слизистой оболочки, вызванного химиотерапией, у детей с онкологическими заболеваниями. Цитруллин сравнивали по шкале оценки NCI-CTCAE с выраженностью гастроинтестинального воспаления слизистой оболочки тонкой кишки, уровнем ИЛ-8 в крови и стуле, фекальным кальпротектином и тестом c 13 C-сахарозой у детей с воспалением слизистой оболочки, больных раком. Из всех этих параметров уровень цитруллина в крови сильнее всех коррелировал с критериями NCI-CTCAE, что позволяет обнаружить даже субклиническое воспаление слизистой оболочки ЖКТ [68]. Таким образом, цитруллин крови является возможным диагностическим инструментом воспаления слизистой оболочки тонкой кишки.
Для оценки степени тяжести мукозита используется шкала критериев тяжести мукозита (токсичности) NCI-CTC (табл. 1) [46, 69].
Причины мукозита с диарейным синдромом можно определить на основании анамнеза, внимательного клинического осмотра и анализа особенностей полученной больным терапии, тем не менее, в ряде случаев необходимы дополнительные тесты. Должно быть проведено исследование для определения клостридиальных токсинов А и Б в кале. У детей в состоянии нейтропении ректальное обследование делать не следует из-за возможной травматизации слизистой. Можно решиться на эту процедуру в исключительных случаях для выявления источника кровотечения, если таковое имеет место. Методом неинвазивной диагностики является ультразвуковое исследование органов брюшной полости, варианты лучевой диагностики. Инвазивный метод — эндоскопия с возможным взятием образца для гистологического исследования. Могут быть проведены другие исследования, если их результаты повлияют на принятие решений по поводу лечения, в частности микробиологическое исследование стула.
Для оценки степени тяжести используется шкала критериев токсичности NCI CTC (версия 3.0) [69] (табл. 2).
Профилактика и лечение
В качестве мер профилактики развития мукозита рекомендуются [70]:
При возникновении мукозита назначается терапия, направленная на купирование и ослабление субъективных симптомов, уменьшение воспаления, репарацию повреждений, профилактику инфекционных осложнений:
К местным средствам можно также отнести обработку полости рта маслом шиповника, облепихи, раствором прополиса, витамином В12 [71]. Другие методы лечения [71–75] представлены в табл. 3.
При мукозитах с диарейным синдромом важно поддержание водного баланса. Могут использоваться растворы для оральной регидратации. При выраженной диарее или при рвоте показана внутривенная регидратация с коррекцией электролитных и других обменных нарушений (например, восполнение потери альбумина) [79]. Возможно применение препаратов сорбентов. Лечебные протоколы, включающие препараты с высоким риском развития диареи, должны предусматривать комплекс мер, направленных на профилактику развития этого осложнения (адекватная инфузионная терапия, поддержание электролитного баланса, парентеральное питание, в отдельных случаях — назначение лоперамида).
Для профилактики и лечения диареи важное значение имеет соблюдение диеты. Основы диетического питания это высококалорийная, механически и химически щадящая пища с достаточным количеством белка и витаминов. Рекомендовано исключить продукты, способствующие процессу брожения в кишечнике (виноград, сливы; кисломолочные продукты), и увеличить потребление продуктов, богатых крахмалом (рис, бананы, сухари). Необходима коррекция питьевого режима — обильное питье (не менее 3–4 л в сутки), которое позволяет во многих случаях избежать парентерального введения растворов и электролитов. С этой целью используются безалкогольные мягкие напитки (кисель, чай), минеральная вода (Ессентуки, Нарзан и др.) или растворы для оральной регидратации до 1000–1500 мл в сутки. Симптоматическая терапия диареи у онкологических больных осуществляется с учетом ее конкретного патогенеза и в общем виде заключается в назначении диеты, препаратов, уменьшающих перистальтику кишечника, противовоспалительных, вяжущих средств, биологически активных веществ, нормализующих кишечную флору, антибиотиков. Кроме того, при наличии болевого синдрома назначаются анальгетики, спазмолитики. Дополнительными средствами лечения диареи могут быть биопрепараты. Продолжающаяся более 48 ч диарея может потребовать введения синтетического аналога соматостатина, при присоединении лихорадки — назначение антибиотиков и проведение инфузионной терапии для компенсации электролитных нарушений, предотвращения гиповолемии и шока [80].
Заключение
Мукозит является потенциальным осложнением системного противоопухолевого лечения. Наиболее опасным является поражение нескольких отделов ЖКТ, приводящее к расстройству водно-электролитного баланса, нарушению абсорбции в желудочно-кишечном тракте и ограничению потребления пищи в связи с болевым синдромом в верхних и нижних отделах ЖКТ. Следствием таких нарушений является нутритивная недостаточность, повышение риска развития инфекционных осложнений, длительности использования парентерального питания, использование наркотических анальгетиков и затрат на лечение. Назначение химиотерапии требует от врача и всего медперсонала знаний по механизму действия цитостатиков, правил их хранения и применения, а также знаний о непосредственных, отсроченных и отдаленных последствиях их использования. Таким образом, тщательный контроль над пациентами, выявление причинных механизмов токсичности и своевременное начало адекватной терапии позволяют быстро и полностью купировать развившиеся осложнения и продолжить противоопухолевое лечение.
Литература
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва









.gif)
.gif)