После азитромицина понос у взрослого что делать
Клинико-фармакологические особенности азитромицина как основа эффективности коротких курсов антибактериальной терапии
Азитромицин остается сегодня одним из предпочтительных антибиотиков для лечения инфекций верхних и нижних дыхательных путей. Он обладает высокой активностью в отношении наиболее вероятных бактериальных возбудителей респираторных инфекций, включая внутрикл
Azithromycin currently remains one of preferable antibiotics in treatment of upper and lower air passage infections. It has high activity in respect of the most probable bacterial agents of respiratory infections, including intracellular pathogens and hemophilic bacillus.
История группы макролидных антибиотиков началась в 1952 году, когда из культуры Streptomyces erythreus был выделен эритромицин. Этот антибиотик с успехом применялся в течение многих последующих лет [1]. Химическую основу макролидов составляет макроциклическое лактонное кольцо, связанное с одним или несколькими углеводными остатками. В зависимости от числа атомов углерода в структуре молекулы, макролидные антибиотики подразделяются на 14-членные (эритромицин, кларитромицин, рокситромицин, диритромицин), 15-членные (азалиды) — азитромицин и 16-членные (спирамицин, джозамицин, мидекамицин, рокитамицин, мидекамицина ацетат). В настоящее время к классу макролидов относится большое количество препаратов (рис. 1).
Часть макролидов является природными, а часть — полусинтетическими.
По отчетам Европейского общества антимикробной химиотерапии (European society of antimicrobial chemotherapy, ESAC), макролиды занимают второе место по объему потребления среди антибиотиков, применяющихся в амбулаторной практике, уступая только пенициллинам [4]. В Австрии проведен анализ многолетней динамики использования антибактериальных препаратов разных классов с 1998 по 2007 г., результаты которого свидетельствуют о неуклонном росте потребления современных макролидов. При этом особенно активно используется именно азитромицин. Так за рассмотренный период использование эритромицина сократилось на 75%. В то же время увеличение показателя потребления (количество упаковок препарата на 1000 человек) у азитромицина составило 24,7%. Для кларитромицина значение данного показателя снизилось на 9,9% [5]. В основе такого высокого уровня потребления азитромицина и его продолжающегося роста лежат фармакологические свойства молекулы, спектр действия, особенности фармакокинетики, наличие лекарственных форм для энтерального и парентерального введения.
Азитромицин был синтезирован в 1981 году путем включения атома азота в 14-членное лактонное кольцо эритромицина между 9-м и 10-м атомами углерода. Он был отнесен к группе полусинтетических 15-членных макролидных антибиотиков — азалидов и остается пока в ней единственным. В 1988 г. по завершении многочисленных доклинических и клинических испытаний оригинальный азитромицин был выведен на мировой фармацевтический рынок. В этом же году он был зарегистрирован в СССР и странах Восточной Европы под торговым названием Сумамед®, которое в настоящее время очень хорошо известно врачам различных специальностей: педиатрам, терапевтам, пульмонологам, оториноларингологам, гинекологам, урологам и др. Механизм антибактериального действия азитромицина аналогичен таковому других макролидов. В его основе лежит ингибирование РНК-зависимого синтеза удлинения белковой молекулы, чувствительной к действию антибиотика бактерии [6]. Антибиотик обратимо связывается с 50S-субъединицей бактериальной рибосомы микроорганизма, блокируя процессы транспептидации и/или транслокации, в результате преждевременно отщепляется растущая тРНК-полипептидная цепочка и прекращается сборка белковой молекулы. Азитромицин характеризуется наличием значимого постантибиотического и суб-МПК эффектов в отношении S. pneumoniae, S. pyogenes, H. influenzae и Legionella pneumophila [6]. Под постантибиотическим эффектом понимают персистирующее ингибирование жизнедеятельности бактерий после их кратковременного контакта с антибактериальным препаратом, а суб-МПК эффект заключается в подавлении роста микроорганизмов при воздействии антибиотика в концентрации, ниже минимальной подавляющей концентрации (МПК).
Азитромицин активен в отношении большинства потенциальных возбудителей инфекций дыхательных путей. Важно, что в отличие от других макролидов он активен против H. influenzae, включая штаммы, продуцирующие β-лактамазы. Также препарат имеет наивысшую среди макролидов активность в отношении Mycoplasma pneumoniae (табл.).
Уникальным среди антибиотиков азитромицин сделали фармакокинетические параметры, особенно наличие тканевой (тканевонаправленной) фармакокинетики. Препарат частично метаболизируется в печени путем деметилирования (известно 10 его метаболитов, не обладающих фармакологической активностью), а 50% с желчью экскретируется в кишечник в неизменeнном виде и выделяется с каловыми массами. Небольшая часть дозы (6–11%) выделяется с мочой. В отличие от 14-членных макролидов, а также препаратов — фторхинолонов, азитромицин не оказывает значимого ингибирующего влияния на микросомальную систему цитохрома Р-450. Это предопределяет низкую вероятность лекарственных взаимодействий [8]. Так, в отличие от эритромицина и кларитромицина азитромицин не взаимодействует с теофиллином, карбамазепином, варфарином, рифабутином и другими лекарствами, метаболизм которых осуществляется на ферментах-цитохромах Р450. В то же время при одновременном приеме антацидов всасывание азитромицина может нарушаться, что, впрочем, характерно для очень большого числа различных лекарственных средств.
М. В. Пчелинцев, кандидат медицинских наук
ГБОУ ВПО СПбГМУ им. И. П. Павлова МЗ РФ, Санкт-Петербург
Антибиотикоассоциированный колит, тяжелого течения. Разбор клинического случая
Авторы клинического разбора:
Ивашкин Владимир Трофимович – академик РАМН, профессор, заведующий кафедрой проведевтики внутренних болезней и директор клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии Первого МГМУ им И.М. Сеченова.
В клинику обратился пожилой мужчина 62 лет с жалобами на жидкий стул до 8 раз в сутки, повышение температуры тела до 38-39С, боль в околопупочной области спастического характера, общую слабость и похудание на 7 кг в течение месяца.
При объективном осмотре состояние средней тяжести, 38С, кожа и видимые слизистые бледные, язык сухой, живот увеличен в объеме за счет метеоризма, при пальпации умеренно болезненный по ходу толстой кишки.
Требовалось установить предварительный диагноз. Отрицательные результаты исследования кала на дизгруппу ставили под сомнение наличие кишечной инфекции, дебют воспалительных заболеваний кишечника у мужчины в 62 года представлялся маловероятным. Имеющиеся факторы риска антибиотикоассоциированного колита – прием антибиотиков, пожилой возраст, наличие сопутствующей патологии (ишемическая болезнь сердца, гипертоническая болезнь) свидетельствовали с высокой вероятностью о наличии антибиотикассоциированного колита, тяжелого течения (псевдомембранозный?).
Было начато обследование. В анализах крови обращали на себя внимание нормохромная железодефицитная анемия, лейкоцитоз со сдвигом лейкоцитарной формулы влево вплоть до миелоцитов, тромбоцитоз и ускорение СОЭ. Также выявлена гипонатриемия, гипоальбуминемия, снижение уровня железа, резкое повышение уровня С-реактивного белка, реакция кала на скрытую кровь с бензидином – положительная. При исследовании кала методом ИФА обнаружены токсины А и В C.difficile. Для исключения дилатации толстой кишки был сделан обзорный снимок брюшной полости в положении лежа – ширина петель в пределах нормы. При ультразвуковом исследовании брюшной полости обращало на себя внимание утолщение стенок толстой кишки до 10 мм. Утолщение стенок толстой кишки, сужение просвета кишки отмечалось и при компьютерной томографии органов брюшной полости.
При сигмоскопии: аппарат введен в сигмовидную кишку, на осмотренных участках слизистая умеренно гиперемирована, с множественными белесоватыми включениями. Слизистая прямой кишки гиперемирована, отёчна. Заключение: антибиотикоассоциированный колит (псевдомембранозный). (Рис. 2).
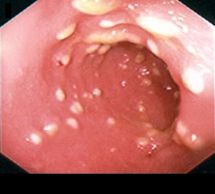
Рис. 2. Сигмоскопия
Морфологическая картина соответствовала псевдомембранозному колиту: выявлялся некроз эпителия, фибриновый выпот с нейтрофилами, типичные изъязвления слизистой напоминающие извержения вулкана, формирование псевдомембран (Рис.3).
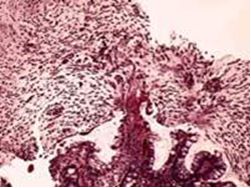
Рис. 3. Морфологическая картина псевдомембранозного колита
Таким образом, был установлен следующий клинический диагноз: Антибиотикоассоциированный колит, тяжелого течения (псевдомембранозный). Синдром нарушенного всасывания: железодефицитная анемия. Гипоальбуминемия.
Лечение больного включало регидратационную терапию, парентеральное питание, с дальнейшим переводом на энтеральное питание, метронидазолом 500 мг в/в каждые 6 ч, ванкомицином 250 мг 4 раза в сутки. Пробиотические препараты не назначались. На фоне лечения состояние больного улучшилось, нормализовалась температура тела, постепенно уменьшилась частота стула и общая слабость, больной прибавил в весе и был выписан в удовлетворительном состоянии.
Через 2 недели после выписки из стационара больному была назначена антибиотикотерапия после экстракции зуба, которая была прервана на 2-е сутки в связи с возникновением диареи. Больной обратился в нашу клинику. Был заподозрен рецидив C.difficile-ассоциированного колита, что было подтверждено обнаружением токсинов C.difficile в кале. Назначена терапия ванкомицином в начальной дозе 500 мг 2 раза в сутки с последующим постепенным снижением дозы в комбинации с пробиотическим препаратом Флорасан А по 1 капсуле 3 раза в день на 14 дней. Состояние больного быстро улучшилось, в течение 1 года наблюдения рецидивов диареи не отмечалось.
Пробиотические препараты (Флорасан А) оказывают отчетливый эффект в лечении антибиотикоассоциированного колита, что делает актуальным включение пробиотиков в схемы лечения. Важными элементами профилактики антибиотикоассоциированных поражений кишечника служат дифференцированное назначение антибиотиков под строгим и обязательным контролем врача, а также обязательное назначение пробиотиков одновременно с началом антибактериальной терапии.
Гастроэнтеролог: как восстановить ЖКТ после антибиотиков
Открытие антибиотиков стало для медицины настоящей революцией. Более 90 лет они эффективно лечат многие болезни, в основе которых бактериальные инфекции и снимают осложнения буквально за считанные часы. Эффективность настолько высокая, что, даже зная о серьёзных побочных последствиях после их применения, современная медицина от них не отказывается, потому что замены этому виду лекарственных препаратов нет. Сегодня мировой рынок этого вида лекарственных препаратов оценивается в 50 млрд. долларов и продолжает расти быстрыми темпами.
Что такое антибиотики, как они действуют и, каким образом можно восстановить желудочно-кишечный тракт после их применения?
Между бактериями и клетками человеческого организма есть сходства и одно принципиальное отличие. Дело в том, что у клеток человека в отличие от бактерий нет клеточной стенки, а антибиотики уничтожают бактерии именно, действуя на стенку и нарушая механизм формирования белка или ДНК, которые у бактерий весьма специфичны. При этом уничтожаются как вредные бактерии, так и полезные, что вызывает дисбактериоз, который если не лечить может затянуть проблемы с желудочно-кишечным трактом на длительное время.
Основные симптомы дисбактериоза:
- боли в области желудка; тошнота и отрыжка, частая изжога; частицы не переваренной пиши в стуле; сухость кожи, бывают случая появления высыпаний; ломкость и слоение ногтей; сухость волос; потеря веса, снижение иммунитета, ухудшение общего состояния.
Проблемы могут усилиться при наличии стрессов, хронических болезней, включая заболевания ЖКТ, неправильного питания, употребления алкоголя, газированной воды. Вот почему многие пациенты, которые прошли курс лечения этими препаратами, задают вопрос, как восстановить ЖКТ после антибиотиков.
При восстановлении микрофлоры гастроэнтерологи советуют включить в рацион кисломолочные продукты, рыбу и мясо нежирных сортов в запеченном или отварном виде, различные супы-пюре с перетёртыми овощами, компоты, кисели, слизистые каши.
- алкоголь; курение; еда всухомятку; жирные мясо и рыба; яйца в варёном и жареном виде; свежий белый хлеб; молоко и свежевыжатые соки; соусы и приправы.
Лечение дисбактериоза врачами гастроэнтерологами Екатеринбурга в медицинском центре «Семейная клиника»
Правильно установленный диагноз и профессионально разработанная тактика лечения являются ключевыми условиями успешного лечения дисбактериоза и быстрого восстановления микрофлоры желудочно-кишечного тракта.
В зависимости от результатов анализов гастроэнтерологи Екатеринбурга нашей клиники могут назначить ряд лекарственных препаратов таких как:
- пребиотики – препараты, подавляющие патогенную флору, препятствующие её развитию и укрепляющие иммунитет; пробиотики – препараты, содержащие комплекс живых микроорганизмов, способных вести борьбу с вредными бактериями; антисептики – средства, которые уничтожают патогенную флору; бактериофаги – препараты, способные бороться с сальмонеллами, энтерококками, стафилококками.
Диарея при заболеваниях органов пищеварения
В практике гастроэнтеролога диарея – один из наиболее распространенных симптомов, который может быть признаком многих различных патологических состояний
В практике гастроэнтеролога диарея – один из наиболее распространенных симптомов, который может быть признаком многих различных патологических состояний. С точки зрения существующих диагностических критериев диарея – патологическое состояние, которое подразумевает изменение как формы кала, так и частоты дефекаций. Прежде всего это учащение стула (более 3 раз за сутки), кроме того, выделение жидких каловых масс (водянистых или кашицеобразных) объемом более 200 мл.
Различают острую и хроническую диарею. Симптомы острой диареи могут проявляться от нескольких дней до 4 нед. В большинстве случаев эпизоды острой диареи связаны с вирусной, бактериальной или паразитарной инвазией. При хронической диарее симптомы наблюдаются более 4 нед.
Заболевания органов пищеварения, как правило, сопровождаются хронической диареей. К ним относятся: атрофические гастриты со сниженной секреторной функцией желудка, постгастрорезекционные и постваготомические расстройства, хронический панкреатит с внешнесекреторной недостаточностью поджелудочной железы, билиарные дисфункции и постхолецистэктомический синдром, хронические заболевания печени, патология тонкой кишки, сопровождающаяся развитием синдрома мальабсорбции, бактериальная контаминация тонкой кишки, язвенный колит и болезнь Крона, опухоли тонкой и толстой кишки, ишемический и псевдомембранозный колиты, функциональные заболевания кишечника, гормональноактивные опухоли желудочно-кишечного тракта (ЖКТ).
Различают четыре патогенетических варианта диареи.
Достаточно часто хроническая диарея является клиническим признаком синдрома мальабсорбции. Этот термин уже многие годы широко применяется в зарубежной литературе. Синдром мальабсорбции характеризуется расстройством всасывания в тонкой кишке питательных веществ и нарушением обменных процессов. В основе развития данного синдрома лежат не только морфологические изменения слизистой оболочки тонкой кишки, но и нарушения ферментных систем ЖКТ, двигательной функции кишечника, а также расстройства специфических транспортных механизмов.
В отечественной клинической практике чаще применяют термин «хронический энтерит». Однако гистологическое исследование у большинства таких больных хронического воспаления не выявляет.
Синдром мальабсорбции может быть обусловлен поражением любого из слоев стенки тонкой кишки. Нарушения всасывания бывают частичными (затрудняется абсорбция отдельных нутриентов) или общими (затруднена абсорбция всех продуктов переваривания пищи).
Различают первичную и вторичную мальабсорбцию. В основе первичной мальабсорбции лежат ферментопатии, наследственно обусловленные изменения строения абсорбтивного эпителия (глютеновая болезнь, непереносимость дисахаридов, коллагеновая спру, тропическая спру).
Вторичная мальабсорбция обусловлена повреждениями различных слоев стенки тонкой кишки, а также других органов (болезнь Уиппла, Крона, хронический энтерит, резекция кишки, патология поджелудочной железы, резекция желудка, отравления, лучевые повреждения, амилоидоз, инфекционные и вирусные заболевания, иммунодефицитные состояния).
Напомним о функциональной морфологии тонкой кишки. Она состоит из четырех оболочек: слизистой, подслизистой, мышечной и серозной.
Слизистая оболочка образует спиральные или циркулярные складки, за счет которых всасывающая поверхность возрастает в 2–3 раза. Кроме того, циркулярное расположение складок способствует перемешиванию химуса и задержке его в образующихся нишах. На поверхности слизистой расположено множество ворсинок. Они представлены выпячиваниями собственной пластинки, покрыты столбчатым эпителием, бокаловидными клетками, однослойным каемчатым эпителием, 90% его составляют энтероциты со щеточной ШИК-положительной каемкой, образованной микроворсинками. На поверхности каждого энтероцита расположено 1500–2000 микроворсинок, которые увеличивают всасывающую поверхность кишки в 30–40 раз (до 200 м2). Щеточная каемка характеризуется высокой активностью щелочной фосфатазы. Среди каемчатого эпителия располагаются бокаловидные клетки.
В основании крипт расположены единичные клетки с крупными эозинофильными гранулами. Это клетки Панета, напоминающие ацинарные клетки поджелудочной железы. Есть данные, что клетки Панета должны компенсировать нарушенную экзокринную функцию поджелудочной железы (содержат трипсин, фосфолипазу, ингибитор трипсина). Кроме того, клетки Панета содержат лизоцим, иммуноглобулин А, т.е. выполняют бактерицидную функцию.
Эпителиальные клетки, покрывающие участки кишки, занятые пейеровыми бляшками, отличаются по строению и функции; их называют мембранозными клетками (М-клетками). Микроворсинок на них мало, активность ферментов ниже. М-клетки захватывают и транспортируют антигены из просвета кишки к лимфоидной ткани. Кроме того, в тонкой кишке много эндокринных клеток.
При мальабсорбции наблюдаются симптомы, связанные с дефицитом электролитов, микроэлементов, витаминов. Может развиваться плюригландулярная недостаточность (гипофизарно-надпочечниковая, половые расстройства, снижение функции щитовидной железы). Напротив, функциональные заболевания кишечника никогда не сопровождаются обменными нарушениями, общее состояние больного не страдает. Однако постановка диагноза функционального расстройства (СРК, функциональной диареи) – всегда очень ответственная и серьезная задача, требующая исключения органической патологии кишечника, инфекционных и глистных заболеваний. В дифференциальной диагностике следует исключить так называемые «симптомы тревоги» (потеря веса, лихорадка, кровь в кале, анемия, отягощенный семейный анамнез по раку толстой кишки, лечение антибиотиками). Существуют диагностические критерии, позволяющие дифференцировать СРК и органические заболевания ЖКТ:
Современная диагностика заболеваний органов пищеварения, ассоциированных с диареей, достаточно сложна и включает в себя помимо клинических большой перечень лабораторных и инструментальных методов.
Прежде всего это общеклинический анализ крови и мочи, копрологическое исследование, биохимический анализ крови (общий белок и белковые фракции, глюкоза, липиды крови, электролиты, сывороточное железо, печеночные пробы, панкреатические ферменты), ЭКГ, микробиологическое исследование кала для исключения инфекционного генеза диареи, определение эластазы-1 в кале. Для оценки кислотопродуцирующей функции желудка проводят рН-метрию. Рентгенологическое исследование включает исследование желудка и пассаж бария по тонкой кишке, при необходимости – ирригоскопию.
В стандарт диагностики при диарее входит и УЗИ органов пищеварения (печень, билиарный тракт, поджелудочная железа, кишечник). При хронической диарее проводится эзофагогастродуоденоскопия с биопсией из нисходящего отдела двенадцатиперстной кишки или проксимального отдела тощей кишки для гистологического исследования, качественного определения активности фермента лактазы в биоптате, бактериологического исследования (для диагностики бактериальной контаминации тонкой кишки); для исключения патологии толстой кишки – колоноскопия с осмотром терминального отдела тонкой кишки. В последние годы для оценки состояния кишечника (особенно тонкой кишки) применяются исследования с помощью видеокапсул.
Дыхательный водородный тест с помощью газоанализаторов позволяет определять избыточный бактериальный рост (бактериальную контаминацию) в тонкой кишке, ферментопатии, моторную функцию тонкой кишки.
В настоящее время появился дыхательный углеродный тест с изотопом С 13 для оценки функционального состояния гепатоцитов, внешнесекреторной функции поджелудочной железы, выявления ферментопатий, бактериальной контаминации тонкой кишки и моторной функции ЖКТ. В трудных диагностических случаях для исключения иммунодефицитных состояний проводят оценку иммунного статуса больного (основные субпопуляции иммунокомпетентных клеток, иммуноглобулины в сыворотке крови). Для оценки местного иммунитета в перфузате тонкой кишки определяют острофазные белки, альбумин, α-1-антитрипсин, секреторный иммуноглобулин А. Стандартным методом, рекомендуемым ВОЗ для оценки проницаемости кишечного барьера, является иммуноферментный метод с нагрузкой овальбумином куриного яйца.
В диагностике глютеновой энтеропатии, помимо гистологического исследования биоптата слизистой тонкой кишки, необходимо определение в сыворотке крови антител к глиадину, тканевой трансглютаминазе и определение антиэндомизиальных антител.
Оценку моторной функции кишечника, помимо рентгенологического исследования, можно проводить и с помощью радионуклидного метода после завтрака с радиометкой Тс 99 (сцинтиграфия желудка, тонкой и толстой кишки).
Лечение хронического диарейного синдрома при заболеваниях органов пищеварения должно быть комплексным, обеспечивать нормализацию нутритивного (трофологического) статуса пациента и развитие адаптационно-компенсаторных процессов, что способствует улучшению качества жизни.
Первым и ведущим должно быть назначение диетотерапии. Лечебное питание при диарее включает назначение стандартной диеты, при необходимости – элиминационных диет и смесей для энтерального питания.
Вариант стандартной диеты характеризуется повышенным содержанием белка (110–120 г), физиологической нормой жиров (90 г) и углеводов (300–350 г), витаминов и минеральных веществ в суточном рационе. Энергетическая ценность составляет 2500–2600 ккал. Предусматривается кулинарная обработка продуктов, позволяющая максимально щадить слизистую тонкой кишки и замедлять продвижение пищи. Питание дробное, исключаются продукты с грубой клетчаткой, молоко, консервы, острые и соленые блюда, спиртные напитки.
Элиминационные диеты подразумевают исключение молока при лактазной недостаточности, назначение безглютеновой диеты и исключение продуктов, содержащих «скрытый» глютен (консервы, колбасные изделия, квас, джин, продукты с глютенсодержащими стабилизаторами) при глютеновой энтеропатии.
Назначение смесей для энтерального питания пациентам с клиническими проявлениями синдрома мальабсорбции, с дефицитом массы тела необходимо во всех случаях, когда стандартной диетой не удается обеспечить нутритивную поддержку. Применяют стандартные, полуэлементные, модульные, иммуномодулирующие и специальные метаболические смеси для коррекции метаболических нарушений, как альтернатива лекарственным препаратам (Нутризон, Клинутрен, Берламин Модуляр, Унипит, Пептамен и др.).
Для коррекции обменных нарушений в ряде случаев применяют заместительную терапию, включающую пероральные регидратационные растворы (Регидрон, Гастролит, Глюкосалан и др.), парентеральное введение белков, аминокислотных смесей в сочетании с анаболическими стероидами (Ретаболил), глюкозы, электролитов, витаминов группы В, аскорбиновой кислоты, препаратов железа.
Для подавления роста патогенной микробной флоры в верхних отделах тонкой кишки назначаются антибактериальные препараты широкого спектра действия – сульфаниламиды (Бисептол, Фталазол, Котримоксазол), производные нитрофуранов (Фурагин, Фуразолидон), хинолоны (Нитроксолин), фторхинолоны (Цифран) в средних терапевтических дозах в течение 5–7 дней. Для подавления роста анаэробных бактерий применяют метронидазол 0,5 г 3 раза в день в течение 7–10 дней. Эффективны кишечные антисептики, имеющие широкий спектр действия: Интетрикс по 1 капсуле 3 раза в день – 7–10 дней, Эрсефурил по 200 мг 4 раза в день – 7 дней.
Помимо этого, в настоящее время для деконтаминации тонкой кишки используют препараты, обладающие пробиотическим действием: Энтерол по 1 капсуле 2 раза в день в течение 14 дней, Бактисубтил по 1 капсуле 2–3 раза в день в течение 3–4 нед, а также препараты на основе сенной палочки (Споробактерин, Биоспорин, Бактиспорин).
После проведения антибактериальной терапии эффективно использование пребиотиков (Хилак форте – 40–60 капель 3 раза в день в течение 2–4 нед; Дюфалак в пребиотической дозе 5–10 мл в день в течение 1 мес) для восстановления нормальной микрофлоры кишечника. С этой же целью назначают препараты пробиотического действия (Линекс, Бифидумбактерин форте, Пробифор, Бифиформ, Ацилакт, Колибактерин в средних терапевтических дозах в течение минимум 4 нед), а также синбиотические биокомплексы (Нормофлорин Л, Нормофлорин Б, Нормофлорин Д) курсами по 2–4 нед.
Одним из пробиотиков, широко применяемых в клинической практике, является Линекс — комбинированный препарат, в состав которого входят три вида бактерий: Bifidobacterium infantis v. liberorum, Lactobacillus acidophilus и нетоксигенный молочнокислый стрептококк группы Д Streptococcus faecium. Линекс отвечает современным требованиям: содержит комплекс живых микроорганизмов, играющих важную роль в поддержании кишечного биоценоза, все три штамма бактерий Линекса устойчивы к воздействию агрессивной среды желудка, что позволяет им беспрепятственно достичь всех отделов кишечника, не теряя своей биологической активности. Применение Линекса безопасно в любой возрастной группе пациентов. Микробные компоненты Линекса обладают высокой резистентностью, что позволяет принимать препарат одновременно с антибиотиками и химиотерапевтическими средствами. Взрослым и детям старше 12 лет назначают по 2 капсулы 3 раза в сутки после еды. Курс лечения зависит от причин развития дисбиотических нарушений. В литературе не отмечено случаев побочных действий или передозировки Линекса.
В лечении антибиотикоассоциированной диареи и псевдомембранозного колита препаратами выбора являются ванкомицин, метронидазол, Энтерол. Пациентам с болезнью Уиппла назначают тетрациклин в дозе 1–2 г в день, Бисептол – 6 мг/кг массы тела в течение 5–9 мес с последующим снижением дозы.
Ингибиторы кишечной моторики и секреции назначают короткими курсами или, по требованию, в случаях острой диареи, при СРК.
С древности врачи использовали при диарейном синдроме настойку опия. В настоящее время назначают лоперамид (Имодиум) для уменьшения частоты стула и гиперсекреции слизи в кишечнике – по 1–2 капсуле 1–4 раза в сутки до появления нормального стула или отсутствия дефекации более 12 ч. Наряду с лоперамидом, к регуляторам моторики кишечника относят платифиллин, гиосцина бутилбромид (Бускопан), дротаверин (Но-шпа), которые назначают по 40–80 мг 3 раза в сутки, Метеоспазмил (1–2 капсулы 3 раза в сутки). При гормонально активных опухолях хорошим антидиарейным эффектом обладают аналоги гормона соматостатина (Октреотид, Сандостатин).
Вяжущие, обволакивающие средства сорбируют жидкость, избыток органических кислот, токсинов. К ним относятся препараты, содержащие белую глину, танин, висмут; Неоинтестопан, Таннакомп (обладающий вяжущим, обволакивающим и антибактериальным действием), Альмагель, Смекта, которые назначают на 5–7 дней.
В клинической практике с этой целью используют и лекарственные растения: чернику, черемуху, зверобой, кору дуба, ольховые шишки, кожуру плодов граната в виде отваров.
Энтеросорбенты препятствуют воздействию бактериальных и вирусных агентов, токсинов, осуществляют цитопротекцию. К ним относят Смекту, Энтеросгель, Полифепан, Фильтрум-СТИ, Неоинтестопан, которые назначают в среднем на 10–14 дней, в интервалах между приемами пищи. При холегенной диарее эффективны Холестирамин, Билигнин.
Ферментные препараты назначают для оптимизации процессов полостного пищеварения. При лактазной недостаточности у детей применяют фермент Лактаза Бэби (1 капсулу с каждым кормлением ребенка в возрасте до 1 года; детям до 7 лет – 2–5 капсул с пищей, содержащей молоко). Взрослым пациентам рекомендуют элиминационную диету (с исключением молока). При выборе ферментных препаратов, содержащих панкреатин, необходимо отдавать предпочтение средствам, характеризующимся высоким содержанием липазы, а также обращать внимание на форму выпуска (минимикросферы, устойчивые к действию желудочного сока) (Креон, Панцитрат). Суточная доза ферментных препаратов в лечении синдрома мальабсорбции должна составлять 30000–150000 ЕД (в пересчете на содержание липазы).
Глюкокортикостероидные препараты применяют при тяжелых и средней степени тяжести формах глютеновой энтеропатии (при средней степени тяжести 20–30 мг при пересчете на преднизолон, при тяжелых формах — 50–70 мг в течение 2 нед с постепенным снижением дозы до полной отмены).
Таким образом, диарея может быть признаком многих заболеваний органов пищеварения. Адекватные диагностические мероприятия при диарейном синдроме позволяют врачу назначать оптимальное комплексное, этиотропное и патогенетическое лечение.
Литература
И. Д. Лоранская, доктор медицинских наук, профессор
РМАПО, Москва
_575.gif)
_575.gif)
