Полный регресс опухоли после химиотерапии что это
«Врачи отметили регресс опухоли. Это означало, что можно обойтись без операции!»
Столкнуться лицом к лицу с диагнозом рак – испытание для любого человека. В этом убедился и Андрей Власов. Два года назад у 53-летнего петербуржца врачи обнаружили новообразование гортани. Сегодня Андрей рассказал, как он смог побороть страшное заболевание.
— Образ жизни у меня нездоровый. Стаж курения около 40 лет – вредная привычка появилась с 15 лет. В среднем выкуривал больше пачки сигарет в день. Да и работа в сфере финансов нервная, много стрессов. Экологическая обстановка в нашем городе тоже не самая благополучная.
Осенью 2017 года у меня начал пропадать голос. Ну пропадает и пропадает, простудился, осень. Обратился к ЛОРу без задней мысли, врач ничего у меня не нашел и назначил какие-то пилюли и таблетки от ангины. Но голос не восстановился. Я пошел в Медсанчасть №157. Отоларинголог Виктор Евгеньевич Иванов заметил у меня в горле новообразование и направил в онкологический диспансер. Оказалось, очень вовремя.
Знакомые посоветовали обратиться в НМИЦ онкологии им. Н. Н. Петрова, что я и сделал. Пришел на прием к Замире Ахмедовне Раджабовой. А она женщина жесткая, сразу сказала: «Либо лечим, либо не лечим». Никаких полумер. Но, мне кажется, с нами так и надо, нельзя позволять человеку, у которого выявляется подобное заболевание, опускать руки, бороться нужно начинать сразу. Описала, что меня ждет, если не лечить. Не то чтобы страшно, но перспектива очень нехорошая. Многие, оказавшись в моей ситуации, раскисают и не знают, что делать, а некоторые и вовсе становятся «потеряшками» — после консультации пропадают из поле зрения врачей. Но лично я все обдумал и решил – если есть факт болезни, нужно действовать.
Конечно, члены моей семьи испугались. Но настрой близких сыграл свою роль в борьбе с болезнью. Я признателен и благодарен своей супруге, она не запаниковала. Знаю случаи, когда в семье говорят «это конец», и человек без поддержки просто не справляется. Для себя я в тот момент решил: не время умирать! У меня маленькая дочка, ей тогда было 14 лет, взрослый сын. Глубоко в душе я скрытый оптимист и на тот момент был твердо убежден – всё будет хорошо. Я настроился на выздоровление.
Я прошел все обследования, подлечил сопутствующее заболевание – язву, передал весь пакет документов в НМИЦ им. Н. Н. Петрова. Там мне поставили точный диагноз – опухоль голосового отдела гортани второй стадии.
Отдельно хочу отметить систему организации приема больных и организацию процесса консультирования в НМИЦ онкологии им. Н. Н. Петрова. Уже через пару недель мне позвонила старшая сестра отделения и сказала прибыть на госпитализацию – с тарелкой, ложкой, в общем, со всем необходимым.
При госпитализации выдают анкету, где есть два вопроса: «Боитесь ли вы лечения?», «Нужна ли Вам психологическая помощь?» Я ответил, что боюсь. А вот психологическая помощь мне была не нужна, потому что я ощущал поддержку со стороны медицинского персонала, и на меня сильное воздействие оказывала уверенность лечащего врача – Максима Андреевича Котова.
После первого курса химиотерапии сдал анализы, прошел контрольные обследования, и врачи отметили регресс опухоли. Это означало, что можно обойтись без операции!
Когда я начал проходить лучевую терапию, доктор Ольга Валерьевна Зотова предупредила о том, что у меня пропадет голос. Но не навсегда, а на время. Так и случилось. А через два месяца я снова смог разговаривать. Конечно, у меня поражена слизистая, я кашляю и есть насморк, но я могу говорить.
Что касается химиотерапии ‒ я плохо ее переносил, но меня активно поддерживали врачи и медсестры. За время лечения я похудел на 20 килограмм, превратился в серенького человека, меня просто сдувало ветром, а последний, пятый курс добил меня полностью – у меня еще и язва обострилась. Но в феврале 2018 года лечение завершилось.
В том же 2018 году, к сожалению, от онкологии погибли несколько моих друзей. Они обнаружили заболевание уже на поздних стадиях. Думаю, ранняя диагностика могла бы их спасти. По моему мнению, люди до последнего не обращаются к врачу, потому что никто не хочет услышать плохих вестей от доктора. Но чем раньше «поймать» болезнь, тем больше вероятность вылечиться и прожить больше. Я всем друзьям и знакомым советую наблюдать за своим здоровьем.
Например, члены моей семьи очень внимательно относятся к здоровью. А дочке мы решили сделать прививку от ВПЧ – это снизит риск возникновения рака половых органов.
Сейчас ко мне обратился знакомый с абсолютно аналогичной ситуацией – у него тоже диагностировали рак гортани. Раз в две недели я его «консультирую» в формате «иди туда, делай то». В данный момент он находится на лечении, в самой активной фазе. И мы с ним периодически созваниваемся, я его морально подготавливаю к побочным эффектам лучевой и химиотерапии. Очень важно в такой ситуации правильно себя настроить. Если человек сдастся, то болезнь быстро распространится по всему организму.
Мы воспитаны в советские времена, когда считалось, что рак – это приговор. Но современная медицина позволяет вылечить эту страшную болезнь. Я очень благодарен всем врачам НМИЦ онкологии им. Н. Н. Петрова. Здесь по полису ОМС я получил очень мощное и эффективное лечение. Главное – вовремя выявить заболевание, вовремя получить лечение и верить в лучшее.
Беседовала
ИОАННА ЧЕРНОВА
специалист по связям с общественностью НМИЦ онкологии им. Н. Н. Петрова
Санкт-Петербургский государственный университет
Высшая школа журналистики и массовых коммуникаций
Как в фильмах не будет: что должен знать о химиотерапии каждый пациент
Химиотерапия — страшно и невыносимо. Об этом говорит нам медиапространство, и неудивительно, что из-за такой гиперболизации многие пациенты боятся ее едва ли не больше, чем самого заболевания. Однако ни один фильм и ни один роман не рассказывает, что это такое, как работает и насколько оправдан страх лекарственного лечения. Вместе с химиотерапевтом клиники «Луч» и научным сотрудником СПбКнПЦСВМП(о) Марией Степановой мы составили инструкцию для пациентов и разобрались, что такое лекарственная терапия и от чего зависит схема лечения.
Что такое лекарственное лечение
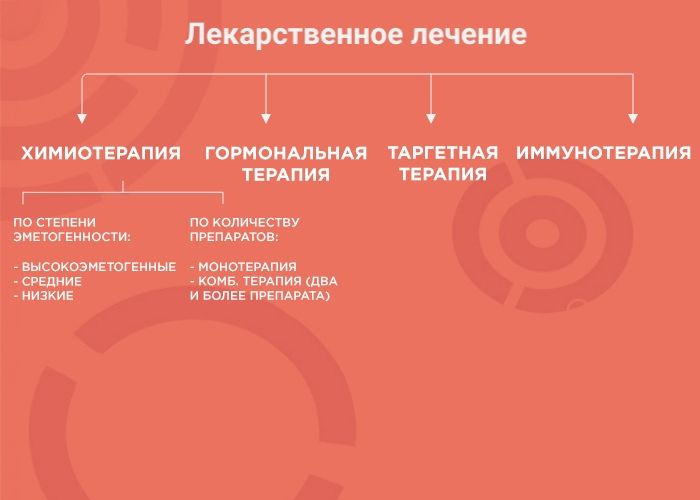
Лекарственная терапия — один из вариантов лечения онкологических заболеваний. Ее возможности и эффективность зависят от типа злокачественного образования. В лекарственной терапии выделяется четыре вида: химиотерапия, наиболее изученный вид терапии; гормонотерапия; таргетная терапия (англ. target «цель, мишень») и иммунотерапия, самый молодой и мало изученный вид лечения. Чтобы понять, почему врач выбирает тот или иной вид терапии, давайте рассмотрим каждый из них более подробно.
Химиотерапия (ХТ)
Некоторые до сих пор ошибочно считают, что лекарственная терапия сводится исключительно к химиотерапии. Действительно, долгое время лекарственное лечение злокачественных опухолей отводилось цитостатикам, противоопухолевым препаратам, принцип действия которых — разрушение быстро делящихся клеток. В том числе — злокачественных.
— Для пациента, который беспокоится о выраженности тошноты важно знать, какие препараты входят в конкретно его схему лечения. Я всегда рассказываю об этом и при необходимости назначаю препараты для снижения побочных эффектов. Чаще всего это сочетание внутривенного и таблетированного вариантов противорвотных препаратов. Однако, плохое самочувствие может нагнать пациента уже дома, и тогда я обсуждаю это и назначаю препараты, которые он может принимать без надзора врача.
— Получается, как в фильмах бывает редко?
— Крайне редко! Конечно, мутить будет, и многие сравнивают это ощущение с токсикозом во время беременности. В таких случаях я рекомендую пить чай с имбирем, использовать жевательные резинки, карамель с кислым вкусом, соленые и кислые продукты.
При химиотерапии используют множество препаратов с разным механизмом действия, ориентированным под разные особенности опухоли. Поэтому врачи используют либо монотерапию (один препарат), либо комбинированное лечение (два и более препарата). Это позволяет усилить противоопухолевый эффект и уменьшить вероятность развития устойчивости опухоли к лечению.
Выделяют также чувствительные к ХТ опухоли (например, герминогенные опухоли, хорионкарциномы, лимфомы) и опухоли, малочувствительные к ХТ (меланома, некоторые виды сарком). Чтобы найти оптимальные варианты лечения для увеличения продолжительности жизни, сейчас активно ведутся клинические исследования о возможности комбинировать этот вид терапии с иммунотерапией.
Гормональная терапия (ГТ)
При гормональной терапии применяются препараты, подавляющие выработку в организме его естественных гормонов или их взаимодействие с рецепторами. Самый частый вариант опухоли, где применяется данный вариант лечения, — рак молочной железы (РМЖ). При выполнении иммуногистохимического (ИГХ) исследования и наличии положительных рецепторов эстрогена и/или прогестерона, оптимальной опцией лечения является гормонотерапия. С ее помощью, можно остановить опухолевый рост и даже добиться полного или частичного исчезновения опухоли.
— Особенность применения этих препаратов, в том что они в подавляющем случае в таблетированной форме и имеют приемлемую токсичность по сравнению с ХТ. Это позволяет пациентам совмещать лечение с работой, хобби и путешествиями.
Таргетная терапия (ТТ)
В отличие от ХТ таргетные (целенаправленные) препараты атакуют только опухолевые клетки. Опухоль для ТТ — своего рода мишень, уничтожение которой означает прекращение репликации (воспроизведения) клеток и метастазирования.
Все началось с того, что врачи отметили недостаточный эффект от цитостатиков и начали внедрять иммуногистохимические параметры. Иммуногистохимическое исследование (ИГХ) выявляет в образце ткани белки, специфичные для того или иного вида клеток. Это позволяет отличать один вид опухоли от другого и выявлять маркеры, которые отвечают за лекарственную чувствительность опухолевой ткани.
— Таргетная терапия начинается с немелкоклеточного рака легкого: в порыве клинических исследований врачи разработали препарат, который начали применять в рамках клинических исследований. Широкое использование Ирессы в клинической практике сопровождалось преимущественно разочарованиями, связанными с редкостью проявления лечебного эффекта. Загадка разрешилась достаточно быстро: анализ нуклеотидной последовательности гена EGFR, проведенный тремя независимыми исследовательскими коллективами, установил, что опухоли легких, характеризующиеся чувствительностью к Ирессе или Тарцеве, содержат мутированную форму этого рецептора. Таким образом, с 2009 года Ирессу внедрили в клиническую практику для пациентов имеющих мутацию в гене EGFR. Особенность механизма действия ТТ, заключается в блокировании мутации, в результате чего опухоль не может делиться, — поясняет Мария.
Побочные эффекты при таргетной терапии менее выражены, и пациенту чаще всего не нужно находиться в стационаре. Некоторые таргетные препараты используются в таблетированной форме, во время их приема качество жизни пациента значительно не страдает, и пациенты могут вести привычный образ жизни.
Иммунотерапия (ИТ)
Иммунотерапия — самая молодая отрасль лекарственного лечения. Существует несколько групп иммунопрепаратов с разными механизмами действия. Одни воздействуют на звено образования кровеносных сосудов в опухоли и блокируют их развитие (после чего опухоль перестает получать питание и погибает), а другие активируют и направляют иммунные силы организма на борьбу с опухолью. занимает много времени, имеет свой спектр побочных эффектов, а также требует внимания врачей и тщательной оценки динамики состояния пациента.
— По идее мы с помощью введения препаратов обучаем иммунную систему распознавать клетки опухоли и разрушать их. Это все равно что установить антивирус, — объясняет Мария.
Цели и оценка эффективности лекарственного лечения
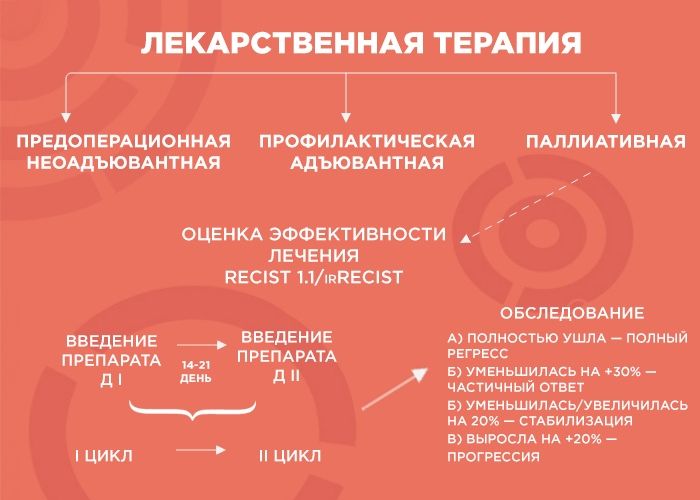
Лекарственная терапия бывает трех видов: предоперационная (неоадъювантная), профилактическая (адъювантная) и паллиативная (поддерживающая).
— Как проходит лечение в каждом из случаев?
— Начнем с предоперационной лекарственной терапии. Например, в отделение поступает пациент с диагнозом рак желудка. Результаты КТ показывают, что отдаленных метастатических очагов нет, однако в связи с распространением первичной опухоли операция на первом этапе невозможна. В этом случае лечение выглядит так: четыре курса терапии, затем — операция, а после нее — еще четыре курса адъювантной терапии. Зачем еще? Формально опухоль убрали, но есть риск возврата образования, и адъювантная терапия помогает его отсрочить.
Паллиативную терапию врач выбирает, когда хирургические методы бессильны (например, при отдаленных метастазах в легкие, печень, лимфоузлы и т.д.). Тогда лечение, в первую очередь, направлено на поддержание качества жизни пациента и контроль заболевания, и продолжительность лечения зависит от его эффекта. В химиотерапии врачи пользуются REСIST 1.1 — системой критериев оценки ответа опухоли на терапию, а в иммунотерапии — irRECIST.
— Объясню, как это работает, на примере пациента с опухолью толстой кишки и с множественными метастазами в печени и легких. Чтобы оценить серьезность ситуации, мы проводим обследование, выявляем наиболее измеряемые очаги и проводим два-три цикла химиотерапии. Большая часть курсов ХТ — введение препарата. Между первым введением и вторым — 14-21 дней — и этот временной промежуток называется циклом.
Далее мы смотрим и сравниваем. Если опухоль уменьшилась более чем на 30% — это частичный ответ, и нужно продолжать терапию до шести курсов. Если она ушла — это полный регресс, и тоже добавляем четыре курса, чтобы закрепить результат. Если опухоль увеличилась или уменьшилась на 20% — это стабилизация, мы делаем еще два курса и снова смотрим: если ситуация не изменилась, пациент отправляется на химиотерапевтические каникулы до прогрессирования заболевания, а потом схема повторяется.
Но если опухоль на фоне лечения выросла больше чем на 20% — мы имеем дело с прогрессией, вероятнее всего, это говорит нам об агрессивности опухоли. В этом случае я объясняю пациенту, что с ним происходит и почему мы меняем лечение.
— Как уговорить пациента на лечение?
— К каждому нужен индивидуальный подход. Я всегда говорю: «Химия может ухудшить ваше состояние, но бояться этого не стоит — мы попытаемся подобрать оптимальную симптоматическую терапию, которое уменьшит нежелательные явления». Если после этого во время лечения появятся данные о плохой переносимости, мы подумаем об уменьшении дозы цитостатика. Бывают случаи, когда я буквально уговариваю пациента пойти на терапию и объясняю ему, за что мы боремся. И объясняю это вне зависимости от серьезности случая — если при агрессивной опухоли человек настроен бороться до последнего, моя обязанность ему эту возможность дать.
Материалы конгрессов и конференций
III РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
НЕОАДЪЮВАНТНОЕ ЛЕЧЕНИЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ.
Э.К. Возный, Н.Ю. Добровольская, С.Н. Гуров, С.А. Большакова.
Научно-исследовательский центр рентгенорадиологии МЗ РФ, Москва
Более 100 лет тому назад родилась концепция радикализма в лечении опухолевых заболеваний. Впервые об этом упоминает William Holsted, когда описывает метод удаления молочной железы, впоследствии названный его именем. Он считал, что рак молочной железы является локо-региональным заболеванием, поэтому радикальное хирургическое вмешательство может способствовать удалению всех опухолевых клеток и «излечению» больного.
На протяжении всего ХХ века с помощью открытий в области физики, химии, биологии и других фундаментальных наук, мы все больше проникаем в механизмы функционирования опухолевых клеток, их распространения в организме, выявления факторов, влияющих на эти процессы.
При изучении процессов метастазирования было показано, что отдаленные микрометастазы могут присутствовать у 30%-90% пациентов с первичным раком молочной железы (РМЖ), даже на ранних его стадиях.
Все эти открытия способствовали развитию системных методов воздействия на злокачественный процесс с целью элиминации отдаленных опухолевых отсевов и, таким образом, достижения максимального радикализма в лечении. Полученные позитивные результаты позволили рекомендовать химиотерапию как дополнительное лечение после радикальных операций, для профилактики развития отдаленных метастазов и местных рецидивов.
Этому способствовали результаты преклинических исследований доктора B. Fisher и его коллег, которые показали, что удаление первичного очага повышает скорость роста метастазов. Как оказалось это происходит за счет стимуляции влияния сывороточного фактора роста на опухолевые клетки. В это же время в опытах in vivo было продемонстрировано, что введение циклофосфана или тамоксифена предотвращает это воздействие, и чем раньше начата адъювантная терапия, тем лучше результаты лечения.
Совсем недавно вошла в практику неоадъювантная (первичная, индукционная) химиотерапия. Первоначально ее применение ограничивалось местно-распространенными неоперабельными формами РМЖ, но по мере накопления и анализа клинических данных она стала использоваться и при операбельных формах заболевания.
При проведении неоадъювантной химиотерапии мы имеем возможность in vivo оценить ее эффективность и, соответственно, при отсутствии ответа опухоли на проводимую терапию применить альтернативные схемы. Первичная опухоль является неспецифическим индикатором ответа микрометастазов на проведение предоперационного лечения. В некоторых работах получены данные о корреляции ответа первичной опухоли, отдаленных микрометастазов и выживаемости больных.
В данной ситуации мы можем термин адъювантная заменить на «слепая» терапия, так как все видимые проявления заболевания уже убраны и у нас отсутствует возможность оценивать эффективность лечения и, соответственно, изменять его, при необходимости.
Конечно же, исследователей интересуют и факторы прогноза при проведении предоперационной терапии, чтобы основываясь на них строить дальнейшую стратегию лечения.
Нам кажется, что здесь важно упомянуть о значении патоморфоза опухоли. В определенной степени он связан с уровнем объективного ответа и, следовательно, является одним из слагаемых, влияющих на выживаемость пациентов. Степень патоморфоза можно считать индикатором ответа опухоли на лечение, что также помогает врачам в выборе дальнейшей тактики лечения. Так, например, при 0-I степени патоморфоза опухоли, возможно, следует применить какие-то альтернативные схемы химиотерапии при проведении адъювантного лечения.
Работа по оценке значения неоадъювантного лечения проведена в нашем институте. До сих пор еще остается спорным вопрос о количестве курсов предоперационной химиотерапии. Для нас было важным выяснить, какое количество курсов необходимо провести, чтобы получить наибольший эффект и выяснить как влияют полученные результаты на эффективность лекарственной терапии, какова взаимосвязь объективного эффекта и степени лекарственного патоморфоза. В исследование включена группа в количестве 89 человек, получавших неоадъювантную химиотерапию по схеме CAF. Максимальное число курсов было 6, но так как количество больных с каждым разом уменьшалось, то мы оценили только 4 курса. В таблице 1 представлены результаты неоадъювантной химиотерапии в зависимости от количества курсов.
Таблица 1.
Влияние количества курсов неоадъювантной химиотерапии на эффективность лечения.
| Количество курсов | 2 | 3 | 4 |
| Число больных | 89 | 47 | 29 |
| Общий эффект (ПР+ЧР) | 47 (52,8%) | 29 (32,5%) | 14 (15,7%) |
| Полная регрессия | 17 (19,1%) | 9 (10,1%) | 6(6,7%) |
| Частичная регрессия | 30(33,7%) | 20 (22,4%) | 8 (8,9%) |
| Стабилизация | 41(46,0%) | 18 (20,2%) | 15 (16,8%) |
| Прогрессирование | 1 (1,1%) | — | — |
В таблице 2 представлены данные влияния количества проведенных курсов неоадъювантной химиотерапии на общую и безрецидивную выживаемость.
Таблица 2.
Влияние количества курсов на общую и безрецидивную выживаемость.
| Количество курсов | 2 | 3 | 4 |
| Число больных | 89 | 47 | 29 |
| Общая выживаемость: | |||
|---|---|---|---|
| 3 года | 88,6 +/- 8,5% | 89,0 +/- 6,5% | 90,0 +/- 1,7% |
| 5 лет | 51,1 +/- 9,9% | 54,0 +\- 7,3% | 57,7 +/- 7,3% |
| 10 лет | 33,0 +/- 13,0% | 39,6 +/- 9,8% | 37,5 +/- 11,3% |
| Безрецидивная выживаемость | |||
| 3 года | 87,6 +/- 6,2% | 88,0 +/- 6,5% | 90,0 +/- 2,7% |
| 5 лет | 44,2 +/- 6,7% | 45,0 +/- 7,3% | 46,7 +/- 7,3% |
| 10 лет | 25,0 +/- 11,8% | 29,6 +/- 9,8% | 28,5 +/- 1,3% |
При сравнении безрецидивной выживаемости можно также констатировать зависимость ее продолжительности от количества проведенных курсов лекарственной терапии, здесь также получены статистически достоверные результаты (р=0,032).
Из всего вышесказанного можно сделать вывод, что увеличение количества курсов неоадъювантной химиотерапии в группе больных с нарастанием объективного эффекта лечения и, соответственно, степени лекарственного патоморфоза способствует увеличению общей и безрецидивной выживаемости.
Переходя от факторов прогноза к причинам, побудившим ученых начать рандомизированные исследования по изучению роли индукционной химио и гормональной терапии, следует отметить, что в работах на животных, перед хирургическим вмешательством проводилась системная терапия цитостатиками и тамоксифеном. Результатом данной работы стало увеличение общей выживаемости. Предположили, что удлинение продолжительности жизни явилось следствием уменьшения опухолевой диссеминации во время операции. Успех более раннего проведения системной терапии согласуется с гипотезой Goldie-Goldman, которая обосновывает необходимость более раннего воздействия на метастазы, учитывая возможность образования химиорезистентных мутантных клеток.
Интерес представляют данные одного из основополагающих исследований В-18, проведенное по эгидой NSABP (National Surgical Adjuvant Breast and Bowel Project), целью которого было сравнить безрецидивный промежуток и выживаемость в группах с неоадъювантной и адъювантной химиотерапией. Также перед учеными стояла задача определить насколько уменьшение размеров первичной опухоли или пальпируемых лимфатических узлов коррелирует с удлинением безрецидивной и общей выживаемости, а также насколько такой подход к лечению способствует увеличению уровня консервативных хирургических вмешательств.
Оценивая результаты этого исследования можно сказать, что наиболее важными факторами, влияющими на выбор тактики хирургического вмешательства является размер опухоли и статус лимфатических узлов. Чаще всего такой объем операции предполагалось выполнить пациенткам без поражения лимфатических узлов, возраст в данной ситуации не играл роли.
Конечно же, многих интересует вопрос об уровне местных рецидивов. За время наблюдения процент локо-региональных рецидивов составил 5,8% в послеоперационной группе и 7,9% в предоперационной группе. При этом полученные различия недостоверны.
Во Франции, была проведена работа, где в одной группе на первом этапе лечения проводилась химиотерапия и лучевая терапия с последующей туморэктомией (она выполнена 47 пациенткам с остаточной опухолью