Подслизистое образование желудка что это
Доброкачественные опухоли желудка
Доброкачественная опухоль желудка – это новообразование, которое не имеет признаков злокачественного процесса. В некоторых случаях остается небольшой риск перерождения при отсутствии соответствующего лечения. Доброкачественные новообразования желудка составляют до 5% от числа всех опухолевых заболеваний желудка, могут развиваться из эпителия, нервной ткани, жировых структур или сосудистых. Рост может быть быстрый или замедленный. По направлению роста выделяют опухоли, движущиеся в сторону просвета желудка, в сторону органов брюшной полости и новообразования, которые разрастаются внутри стенки. По локализации они с одинаковой частотой возникают в теле желудка, антральном отделе или в других местах.
Разновидности и особенности желудочных опухолей
По происхождению все новообразования, локализованные в области желудка, разделяют на две большие группы: эпителиальные и неэпителиальные.
Среди первой группы встречаются аденомы и полипы (одиночные или группами). Разница в том, что полипы – это выросты в просвет органа, они обычно округлой формы и имеют широкое основание, могут располагаться на ножке. Развитие полипов ассоциировано с возрастными изменениями – чаще встречаются в возрасте после 40 лет, болезнь поражает мужчин чаще, чем женщин. Гистологически полип представляет собой разросшиеся железистые и эпителиальные ткани с соединительнотканными элементами и развитой сетью сосудов.
Аденомы – это истинные доброкачественные новообразования, состоящие преимущественно из железистой ткани. В отличие от полипов, аденома может чаще перерождаться. Но встречаются реже, чем полипы.
Неэпителиальные опухоли встречаются редко. Они формируются в стенке желудка и могут состоять из самых разных тканей.
К неэпителиальным новообразованиям относят:
В отличие от полипов, которые чаще встречаются у мужчин, опухоли неэпителиальной природы чаще диагностируют у женщин. У всех подобных новообразований есть отличительные особенности: как правило, они имеют четкий контур, гладкую поверхность, округлую форму. Могут разрастаться до значительных размеров.
Особо выделяют неэпителиальную опухоль лейомиому – она встречается с более высокой частотой, чем другие новообразования из этой группы. Эта опухоль может вызывать желудочные кровотечения или потенцировать образование язв за счет прорастания в слизистую оболочку желудка. Все неэпителиальные новообразования отличаются достаточно высоким риском онкологического перерождения – малигнизации.
Симптомы
Симптомы опухоли желудка, как правило, слабо выражены. Если новообразование не растет, то практически не проявляется и никак не наблюдается. Очень часто доброкачественные опухоли определяют по косвенным признакам или выявляют случайно при эндоскопическом обследовании.
Клиническая картина включает в себя:
При абсолютно спокойном течении могут наблюдаться боли тупого и ноющего характера, локализованные, как правило, в эпигастрии. Боль нередко возникает после приема пищи. Достаточно часто больные ассоциируют эти симптомы с гастритом.
При опухолях достаточно большого размера могут наблюдаться более выраженные проявления. Появляется тяжесть, возникают приступы тошноты, появляется частая отрыжка. В рвотных массах и стуле больные обнаруживают примеси крови. В лабораторных анализах определяют пониженный гемоглобин. Пациенты испытывают слабость и головокружения. Вне зависимости от сохранности нормального аппетита начинается потеря веса. Всего различают более сотни видов доброкачественных новообразований – с разным течением и клинической картиной. Выраженность симптомов зависит от локализации, размера и скорости роста опухоли. Классической клинической картиной, позволяющей заподозрить опухоль, считается кровотечение, сопровождаемое общими нарушениями работы ЖКТ.
Причины
На сегодняшний день все причины образования доброкачественных опухолей желудка неизвестны. Поэтому правильно говорить о факторах риска – факторах, которые провоцируют патологические процессы, приводящие к появлению новообразований. В их числе наличие других заболеваний ЖКТ.
Наиболее актуальная теория гласит, что полипы появляются в результате нарушений естественной регенерации слизистой желудка. Поэтому полипы часто развиваются на фоне гастрита. Аденомы чаще сопровождаются атрофическим гастритом. При этом отмечено, что более 70% всех новообразований развивается в нижней трети желудка – то есть в зоне с пониженной концентрацией соляной кислоты.
Причиной развития неэпителиальной опухоли могут быть эмбриональные нарушения или наличие хронических заболеваний. Так как конкретных причин выявить не удается, не существует и специфической профилактики доброкачественных опухолей. Нельзя забывать и о наследственной предрасположенности – пациентам, чьи родственники имели новообразования желудка, необходимо даже при отсутствии каких-либо симптомов заболевания желудка выполнять эндоскопическое исследование. В любом случае, при подозрении на наличие полипа или полиповидного образования желудка следует обратиться к хирургу.
Полипы желудка
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
Дальнейшее отношение к выявленному во время видеоэзофагогастродуоденоскопии (ВГДС) полипу зависит от его гистологической верификации, этиологии (причины возникновения), естественной истории (развитие в динамике). После оценки полученных данных решается вопрос о необходимости лечения в данном клиническом случае или о проведении динамического наблюдения.
Классификация полипов желудка
Наиболее рациональным является классифицирование полипов по клиническим, морфологическим и гистологическим признакам. Чаще всего полипы имеют бессимптомное течение. Однако, осложненный вариант может проявляться кровотечением (признаки анемии, кровь в стуле), непроходимостью (тошнота, рвота), гастритоподобным течением (боли в верхних отделах живота) и малигнизацией (снижение массы тела и др. симптомы онкологического заболевания).
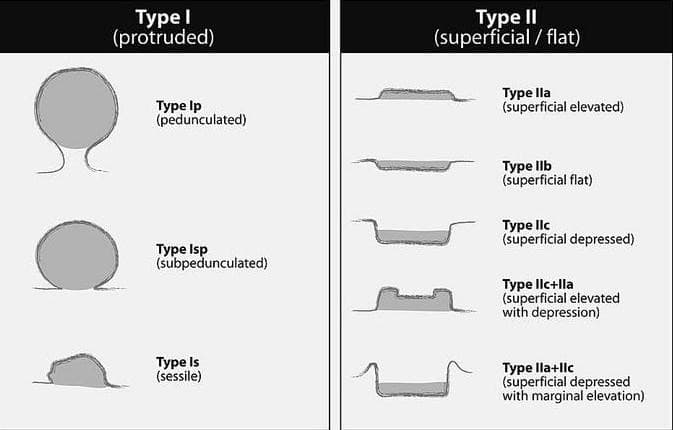
По морфологическим критериям полипы разделяют на солитарные (одиночные) и множественные, мелкие и крупные, мягкие и плотные. Учитывая, что видеогастроскопия является «золотым» стандартом в диагностике данной патологии, во всем мире признанной является Парижская классификация эпителиальных новообразований, согласно которой выделяют выступающие (0-Ip – на узкой ножке, 0-Isp – на зауженном основании, 0-Is – сидячие) и поверхностные (0-IIa – приподнятые, 0-IIb – поверхностные плоские, 0-IIc – слегка углубленные, смешанные варианты).
Ключевым моментом при выполнении эндоскопического исследования является не только правильная интерпретация найденного образования, но и возможность забора материала с последующим гистологическим подтверждением, что главным образом влияет на дальнейшую тактику лечения. В связи с этим представлены четыре группы полипов с их подробными характеристиками.
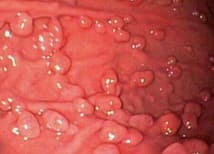
При хромоскопии и узкоспектральной эндоскопии (NBI) поверхность представлена рисунком по типу «пчелиных сот» с густой сосудистой архитектоникой. Изначально фундальные полипы связывали с гамартомами (образованиями, представляющими тканевую аномалию развития), однако, в большом числе исследований подтверждено, что механизмы, подавляющие секрецию соляной кислоты ингибиторами протонной помпы (ИПП), могут также участвовать в патогенезе развития фундальных полипов желудка.
Гистологически фундальные полипы представлены дилятированными (расширенными) кислотопродуцирующими железами, покрытыми плоскими париетальными и слизистыми клетками без признаков дисплазии. Выявление характерных полипов желудка у пациентов, принимающих ИПП, с большой долей вероятности диагностируют как полипы фундальных желез. При первичном осмотре один или более представленных полипов после взятия биопсии подвергают морфологической оценке для подтверждения диагноза. Большие полипы (более 10 мм), эрозированные, расположенные нетипично, например, в антральном отделе желудка, должны быть подвергнуты более агрессивной тактике ведения – эндоскопической полипэктомии.
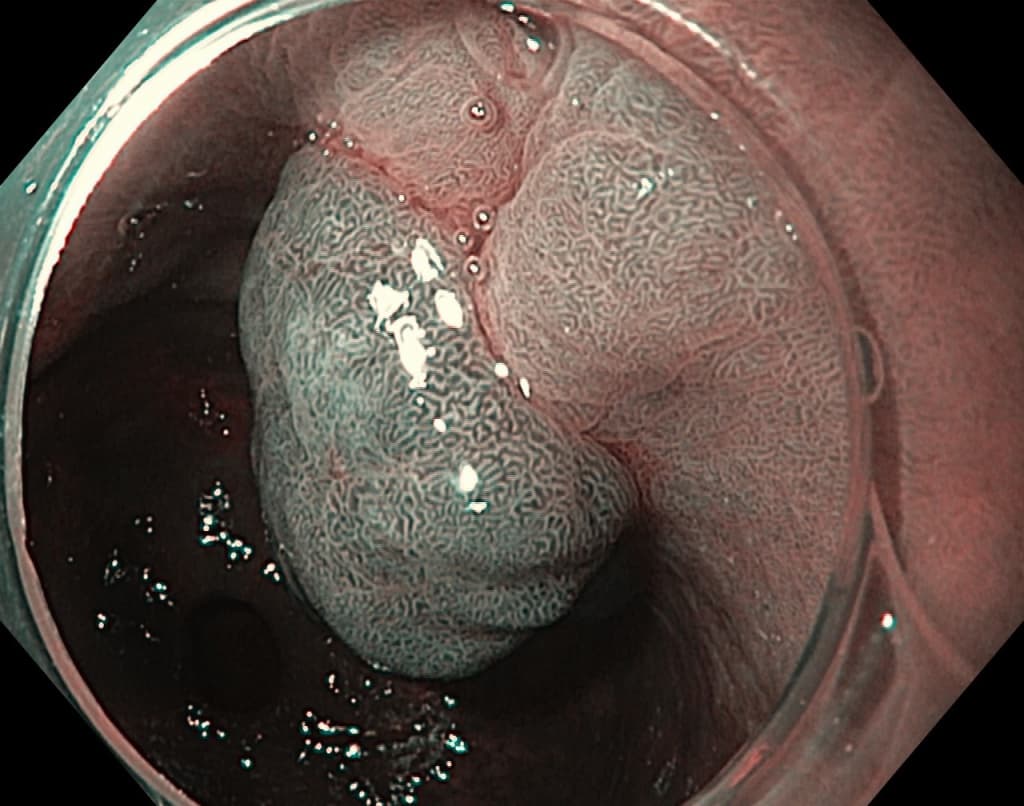
Эндоскопически они представлены солитарным одиночным образованием дольчатой формы с бархатистой поверхностью. Хотя они могут быть найдены в любом отделе, наиболее часто локализуются в антральном отделе желудка.
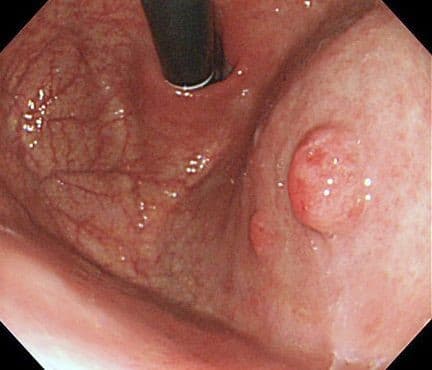
Лечение полипов желудка
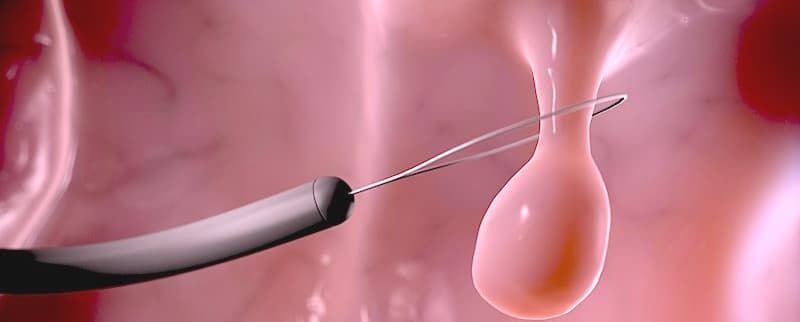
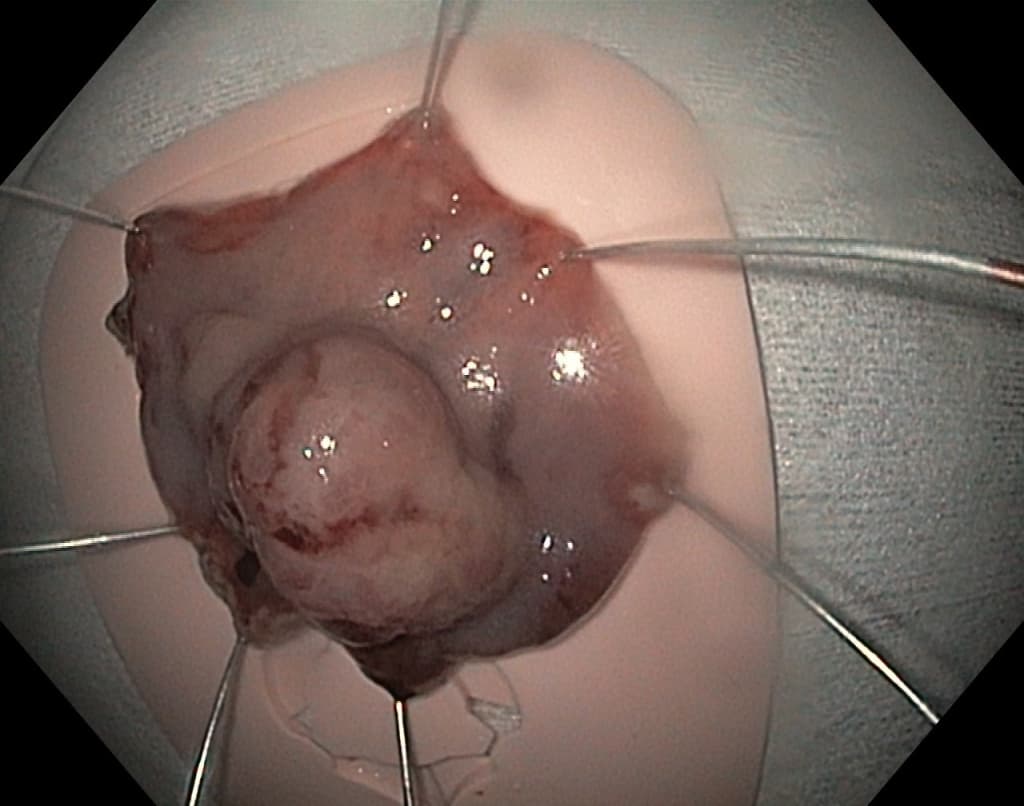
Как говорилось ранее, все аденоматозные и крупные полипы более 10 мм должны быть подвергнуты удалению. Каким же образом выполняется эндоскопическая полипэктомия или резекция слизистой?
Крупные экзофитные (выступающие) полипы на широком основании или плоские образования, которые невозможно удалить эндопетлей, подвергаются технически более сложному варианту эндоскопического удаления – диссекции в подслизистом слое. Данный вид операции направлен на радикальное удаление образования единым блоком: после создания «гидростатической подушки» выполняется циркулярный разрез вокруг образования специальными инструментами, после чего рассекаются соединительнотканные сплетения подслизистого слоя с полной ликвидацией патологического очага.
По современным представлениям, наиболее рациональным является наблюдение за пациентами после проведенной полипэктомии через 1 год. При этом оценивается состояние слизистой оболочки на предмет появления новых образований или рецидива на месте ранее выполненной операции. Если же после резекции образований гистологический ответ подтверждает наличие дисплазии высокой степени или же раннего рака, то контрольная гастроскопия должна проводиться в интервале: 1,5 мес.- 3 мес.- 6 мес. – 1 год и в последующем каждый год.
Профилактика полипов желудка
Целью профилактики является выявление образований желудка на ранних этапах развития. Рекомендуется выполнение эндоскопического исследования лицам старше 45 лет в качестве скрининга даже при отсутствии клинической симптоматики, так как заболевание проявляет себя лишь на поздней стадии, когда уже требуется хирургическое лечение. Следуя принципам онкологической настороженности, пациентам с отягощенным наследственным анамнезом, то есть при наличии онкологических заболеваний со стороны ЖКТ у ближайших родственников, требуется незамедлительный профилактический осмотр желудка и толстой кишки.
Как получить услугу в Клинике
В нашей Клинике проводятся все виды эндоскопических исследований на высококачественном оборудовании как под местной анестезией, так и под наркозом. Все выявленные патологические образования подвергаются гистологической верификации. Также проводится забор материала на наличие инфекции H.pylori и для определения стадии и степени выраженности воспалительных и атрофических изменений слизистой оболочки желудка (класс.OLGA), что свидетельствует, как говорилось ранее, о риске развития онкологического процесса.
Что касается оперативного эндоскопического лечения, то в клинике возможно его выполнение в амбулаторных и стационарных условиях. Решение принимает лечащий врач, опираясь на размеры патологических очагов, их количество, результаты гистологии и сопутствующую патологию.
Подслизистое образование желудка что это
Институт хирургии им. А.В. Вишневского Министерства здравоохранения и социального развития РФ
Институт хирургии им. А.В. Вишневского, Москва
Институт хирургии им. А.В. Вишневского, Москва
Подслизистые новообразования желудочно-кишечного тракта в эндоскопической практике
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2010;(2): 51-59
Старков Ю. Г., Солодинина Е. Н., Новожилова А. В. Подслизистые новообразования желудочно-кишечного тракта в эндоскопической практике. Хирургия. Журнал им. Н.И. Пирогова. 2010;(2):51-59.
Starkov Iu G, Solodinina E N, Novozhilova A V. Submucosal neoplasms of gastrointestinal tract in endoscopic practice. Khirurgiya. 2010;(2):51-59.
Институт хирургии им. А.В. Вишневского Министерства здравоохранения и социального развития РФ
Институт хирургии им. А.В. Вишневского Министерства здравоохранения и социального развития РФ
Институт хирургии им. А.В. Вишневского, Москва
Институт хирургии им. А.В. Вишневского, Москва
Длительное время подслизистые новообразования трактовались хирургами и эндоскопистами как доброкачественные и в большинстве подлежащие динамическому наблюдению. Исключение составляли новообразования больших размеров, которые имели клинические проявления и вынуждали хирургов к оперативному вмешательству. Подслизистые новообразования наиболее часто выявляются при эндоскопическом или при рентгенологическом исследовании желудочно-кишечного тракта. При рентгенологическом исследовании данные образования выглядят как пристеночно расположенные дефекты наполнения округлой или овоидной формы. Однако данное исследование не позволяет провести дифференциальную диагностику между образованием стенки полого органа и экстраорганно расположенным патологическим очагом. Наиболее эффективным методом диагностики подслизистых опухолей до последнего времени оставалось эндоскопическое исследование, при котором визуализируются округлой или овоидной формы образования, деформирующие просвет органа и покрытые в большинстве наблюдений неизмененной слизистой. По косвенным эндоскопическим признакам можно предположить, что данное образование исходит из стенки полого органа, однако четкие критерии, позволяющие провести дифференциальную диагностику между подслизистым образованием и экстраорганной компрессией, отсутствуют. По данным литературы, чувствительность и специфичность рутинного эндоскопического исследования в дифференциальной диагностике между подслизистыми образованиями и экстраорганной компрессией составляют 87 и 29% соответственно [51]. Также визуальное эндоскопическое исследование не дает ответа на вопрос о структуре образования и не позволяет определить, из какого именно слоя стенки полого органа оно происходит. С учетом локализации биопсия по стандартной методике при эндоскопическом исследовании также не дает возможности установить гистологическую природу этих новообразований [8]. Другие неинвазивные лучевые методы диагностики (КТ, УЗИ, МРТ) еще менее чувствительны [40], так как в большинстве наблюдений небольшие подслизистые образования этими методами не выявляются. Возможности диагностики и дифференциальной диагностики неэпителиальных опухолей и неопухолевых образований стенки желудочно-кишечного тракта значительно расширяет эндоскопическая ультрасонография. Этот метод позволяет не только достоверно различать образования стенки и экстраорганные структуры, но и определять слой, из которого происходит новообразование, а оценивая его эхогенную характеристику, четко дифференцировать неэпителиальные опухоли и неопухолевые образования желудочно-кишечного тракта. При морфологическом исследовании становится ясно, что подслизистые образования включают кисты, дистопию ткани поджелудочной железы и целую группу неэпителиальных опухолей мышечного, неврогенного и сосудистого происхождения [48].
В последние годы интерес к неэпителиальным опухолям желудочно-кишечного тракта значительно возрос, активно изучаются визуальные и лучевые характеристики этих новообразований, их гистологическое строение, проводятся исследования результатов хирургического и химиотерапевтического лечения пациентов с различными подслизистыми новообразованиями желудочно-кишечного тракта. Своей задачей в данном обзоре мы видим необходимость дать информацию для эндоскопистов и врачей других специальностей о том, каковы могут быть возможные варианты безобидных с виду подслизистых новообразований, так как только своевременная дифференциальная диагностика служит основой решения тактических вопросов.
Гастроинтестинальные стромальные опухоли являются наиболее распространенными среди неэпителиальных опухолей желудочно-кишечного тракта и составляют до 1% всех злокачественных опухолей этой локализации [7, 12, 18, 38, 51, 53]. Эти новообразования ранее расценивались как лейомиомы, лейомиобластомы и лейомиосаркомы, однако иммуногистохимические исследования показали их особую природу [27].
Еще в 1960 г. J. Martin и соавт. [33] опубликовали сообщение о 6 наблюдениях «интрамуральных мышечных опухолей» желудка и предположили мышечное происхождение этих «странных» опухолей [27]. Двумя годами позже A. Stout [55] ввел термин «лейомиобластома» для описания группы «причудливых» миогенных опухолей желудка. В течение двух десятков лет авторы использовали различные названия для удобства описания веретеноклеточных и эпителиоидных опухолей, встречающихся во всех отделах желудочно-кишечного тракта. Первыми термин «гастроинтестинальная стромальная опухоль» (ГИСО) ввели M. Mazur и H. Clark в 1983 г. как компромиссный для описания опухолей с не вполне понятной дифференцировкой [35]. Для этих опухолей характерной была двойственность их фенотипа: гладкомышечный и нейрогенный.
Наиболее часто встречаются веретеноклеточный (62%), эпителиоидный (17%) и смешанный (21%) гистологические варианты строения ГИСО [1]. Несмотря на различные варианты гистологического строения, все ГИСО считаются потенциально злокачественными [1, 12, 26]. Даже после радикального удаления опухоли (макро- и микроскопически в пределах здоровых тканей) частота рецидивов достигает 30-50%, проявляясь либо метастазами в печень, либо местным рецидивом (метастазы по брюшине). Особенно неблагоприятен прогноз при опухолях тонкой кишки, когда средний уровень выживаемости составляет около 20 мес [41]. Основными путями генерализации гастроинтестинальной стромальной опухоли является метастазирование в печень и распространение по брюшине. Лимфогенное метастазирование для опухоли не характерно [12, 23]. В настоящее время для определения степени злокачественности ГИСО пользуются критериями, предложенными C. Fletcher и соавт. [18] и M. Miettinen и соавт. [38], по которым высокий риск определяется размером опухоли более 5 см, количеством митозов более 5 в 50 полях зрения при увеличении 400 и инвазией опухолью слизистой. Иммуногистохимическим маркером степени злокачественности опухоли является также индекс экспрессии Ki-67, который достоверно возрастает выше 10% в опухолях высокого риска [68].
При эндоскопическом исследовании опухоли могут выявляться в виде образований округлой или овоидной формы; небольшие образования покрыты неизмененной слизистой, однако нередко можно выявить ее изъязвление над опухолью, что служит прогностически неблагоприятным фактором относительно злокачественности образования и может стать источником желудочно-кишечных кровотечений с развитием анемии, в 50% наблюдений это является поводом для обращения пациентов к врачу и причиной выявления ГИСО [21]. При эндосонографическом исследовании ГИСО визуализируется как гипоэхогенное образование, которое в зависимости от степени злокачественности может иметь как гомогенную, так и гетерогенную структуру и исходить из мышечной пластинки слизистой или мышечного слоя стенки органа [25].
В дифференциально-диагностическом ряду с гастроинтестинальными опухолями находятся мезенхимальные опухоли и другие новообразования, локализующиеся в стенке пищеварительной трубки и покрытые неизмененной слизистой. Наиболее часто гастроинтестинальную опухоль приходится дифференцировать с истинными гладкомышечными опухолями, липомой, шванномой, нейроэндокринной опухолью, эктопированной поджелудочной железой. Такие образования, как воспалительная миофибробластическая опухоль, воспалительный фиброзный полип, гранулярно-клеточные опухоли, нейрофиброма, сосудистые опухоли и метастазы в стенке желудочно-кишечного тракта, встречаются крайне редко и имеют небольшое практическое значение в дифференциальной диагностике.
Нейроэндокринные опухоли желудочно-кишечного тракта развиваются в органах, производных от передней кишки эмбриона (пищевод, желудок и двенадцатиперстная кишка), и составляют до 5-8% всех нейроэндокринных опухолей. При локализации в верхних отделах желудочно-кишечного тракта обычно гормонально не активны и выявляются случайно при эндоскопическом исследовании или при оперативных вмешательствах по поводу других заболеваний [19]. Гистологически опухоль представлена в виде гнездных скоплений мелких клеток с круглыми ядрами или в виде тяжей опухолевых клеток, соединенных трабекулами. Образование обычно локализуется во II (мышечной пластинке слизистой) или III (подслизистом) эхо-слое, покрыто неизмененной слизистой, однако иногда покрывающая слизистая может изъязвляться, что также является причиной кровотечений [39]. Нейроэндокринные опухоли обладают определенным злокачественным потенциалом, и чем больше размер опухоли, тем выше риск метастазирования, поэтому при образованиях размером более 2 см рекомендуется их удаление [34].
Другие сосудистые опухоли: гломусная опухоль (гломус-ангиома) состоит из щелевидных сосудов, выстланных эндотелием и окруженных муфтами из эпителиоидных (гломусных) клеток; лимфангиома развивается из лимфатических сосудов, разрастающихся в разных направлениях и образующих узел или диффузное утолщение стенки органа. На разрезе опухоль состоит из полостей разной величины, заполненных лимфой. Эти опухоли имеют доброкачественное течение и при наличии клинической симптоматики могут быть удалены эндоскопически [53].
Эктопированная поджелудочная железа обычно выявляется случайно при эндоскопии, оперативных вмешательствах или на аутопсии. По данным литературы, она встречается у 1 из 500 больных, оперированных по поводу заболеваний верхних отделов желудочно-кишечного тракта. На аутопсии эктопированная поджелудочная железа выявляется в 6-14% случаев [25]. Новообразование имеет строение, характерное для поджелудочной железы, нередко на слизистой, покрывающей образование, можно визуализировать устье выводного протока. В большинстве наблюдений клиническая симптоматика отсутствует, однако возможно развитие осложнений в виде воспаления, кистозной трансформации, изъязвления, кровотечения, обтурации просвета кишки и малигнизации, что оправдывает ее удаление [48].
Обобщая изложенное выше, можно сделать заключение, что современные тенденции в лечении подслизистых новообразований желудочно-кишечного тракта сводятся к следующему алгоритму: при небольших доброкачественных бессимптомных опухолях, таких как лейомиома, шваннома, липома, гранулярно-клеточная опухоль и сосудистые опухоли, проводится динамическое наблюдение, условно доброкачественные и симптоматические доброкачественные опухоли подлежат удалению преимущественно из малоинвазивного эндолюминального доступа [16, 48, 53, 63]. При злокачественных опухолях, к которым относят и солитарные ГИСО, большинство авторов склоняются к необходимости резекции органа из лапаротомного, лапароскопического или лапароскопического трансгастрального доступа [10, 12, 23, 32, 41].
Такой дифференцированный подход к лечебной тактике при подслизистых образованиях предъявляет высокие требования к дооперационной диагностике. Эндосонография открывает новые возможности точной диагностики подслизистых образований. Первым рубежом диагностики является разграничение образований стенки и экстраорганных опухолей, деформирующих просвет полого органа [62]. Наибольшие трудности встречаются при дупликационных кистах, которые часто, особенно при расположении на задней стенке желудка, трактуются диагностами как кистозные опухоли поджелудочной железы [56]. Помимо доказательства связи образования со стенкой органа перед эндосонографией ставится задача установить предположительный диагноз, характер образования и его локализацию относительно слоев стенки полого органа, на основании чего можно косвенно судить о характере поражения (табл. 2) [25].
Совокупность этих данных играет немаловажную роль в определении лечебной тактики и метода удаления опухоли в каждом конкретном наблюдении. Основными характеристиками опухоли, определяемыми при эндосонографии, являются размер образования, эхогенность, внутреннее строение, четкость контура и слой, из которого она исходит [43, 61].
M. Miettinen и соавт. [38] на большом клиническом материале показали, что мелкие, до 2 см, ГИСО не имели метастазов, что позволяет отнести небольшой размер опухоли к прогностически благоприятным факторам. Для удобства оценки риска злокачественности опухоли L. Palazzo и соавт. [45] выделили 3 основных критерия: неровность контура опухоли, наличие в ней анэхогенных зон и увеличение регионарных лимфоузлов (последний критерий не актуален для ГИСО). Авторы отмечают, что чувствительность и специфичность каждого из этих признаков составляет 91 и 88% соответственно, достигая 100% при наличии двух признаков из трех.
В большинстве наблюдений для окончательного определения гистологического характера опухоли необходимо получение ткани опухоли для проведения гистологического и иммуногистохимического исследований. Возможности щипцовой биопсии при подслизистых образованиях значительно ограничены, а выполнение резекции части опухоли для ее гистологического исследования чревато такими осложнениями, как кровотечение из опухоли и диссеминация процесса. Транскутанная биопсия сложна при образованиях небольшого размера и может привести к диссеминации процесса, поэтому ее следует использовать только при крупных, нерезектабельных опухолях для подбора химиотерапии [14]. Тонкоигольная пункция и аспирационная биопсия под контролем эндосонографии открыли новые возможности для морфологического и иммуногистохимического анализа подслизистых новообразований. По мнению P. Chatzipantelis и соавт. [13] и M. Gu и соавт. [24], с внедрением этого метода ГИСО стали диагностировать значительно чаще. Метод позволяет получить материал для гистологического и иммуногистохимического исследований в 60-80% наблюдений [20, 60]. Многие исследователи предпочитают проведение микроскопического исследования непосредственно в операционной для первичной оценки результативности биопсии и при недостаточном количестве материала прибегают к повторной пункции и аспирационной биопсии, что позволяет достигать 100% эффективности манипуляции [8]. По данным P. Chatzipantelis и соавт. [13], гистологическая верификация диагноза при анализе мазка в операционной достигала 82,4%, в 17,6% наблюдений потребовалось проведение иммуногистохимического исследования фиксированного материала. По данным разных авторов, диагностическая точность аспирационной биопсии под контролем эндоскопического УЗИ составляет от 91 до 100% [7, 8, 30].
Подводя итог изложенному, хотелось бы еще раз подчеркнуть, что подслизистые новообразования являются широкой группой заболеваний, которая требует серьезного обследования, дифференциальной диагностики и лечения с использованием современных эндоскопических методов. В связи с выделением потенциально злокачественных гастроинтестинальных стромальных опухолей, которые считаются самыми распространенными неэпителиальными опухолями желудочно-кишечного тракта, и трудностью проведения дифференциальной диагностики их с другими неэпителиальными опухолями подход к ведению и лечению таких пациентов на сегодняшний день изменился. При выявлении во время эндоскопического исследования подслизистых новообразований необходимо дифференцировать их от сдавления органа извне с помощью других уточняющих методов исследования, таких как УЗИ, КТ, МРТ. Однако самым точным методом диагностики, позволяющим определить органную принадлежность опухоли и слой стенки полого органа, из которого она исходит, является эндосонография, данные которой определяют выбор метода лечения подслизистых новообразований желудочно-кишечного тракта.
Мы считаем, что выявленные подслизистые образования необходимо удалять с последующими гистологическим и иммуногистохимическим исследованиями. Исключения составляют диссеминированные формы ГИСО, при которых необходимо проведение комплексного лечения в специализированных стационарах. Вместе с тем при наличии мелких бессимптомных образований, не имеющих признаков злокачественности, особенно исходящих из мышечной оболочки пищевода, возможно динамическое наблюдение. При этом мы руководствуемся тем, что ГИСО для пищевода наименее характерны, а радикальное удаление опухоли, исходящей из мышечного слоя, требует резекции стенки органа, т.е. торакоскопии или торакотомии. Таким образом, имеется несоответствие риска оперативного вмешательства и риска прогрессирования заболевания. При выборе хирургического доступа необходимо руководствоваться размером опухоли, ее распространенностью за пределы органа и наличием признаков злокачественности. Пограничные опухоли или вызывающие те или иные жалобы у пациентов подлежат удалению по возможности из малоинвазивного доступа. Способ удаления следует выбирать, принимая во внимание слой стенки органа, из которой исходит опухоль. При локализации опухоли в мышечной пластинке слизистой или в подслизистом слое предпочтение следует отдавать эндоскопическим методам лечения. Если опухоль исходит из мышечного слоя, необходимо выполнять лапароскопическую резекцию. При наличии признаков злокачественности, выявляемых при эндосонографии, следует производить операцию лапаротомным способом, используя широкую резекцию с лимфаденэктомией.
В заключение хотелось бы сказать, что благодаря появлению такого метода эндоскопического исследования, как эндосонография, подход к диагностике и лечению пациентов с подслизистыми образованиями желудочно-кишечного тракта претерпел значительные изменения. Точность в постановке верного диагноза увеличилась в разы, что обусловливает улучшение исходов лечения данной группы пациентов.