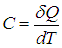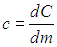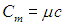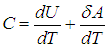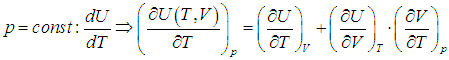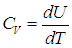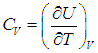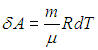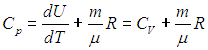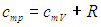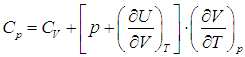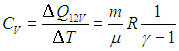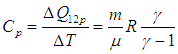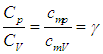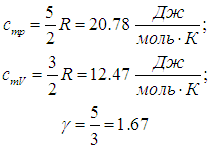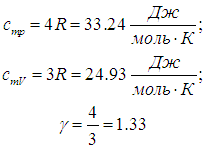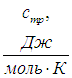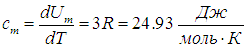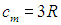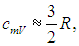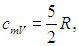Почему теплоемкость при постоянном давлении больше чем теплоемкость при постоянном объеме
Теплоемкость при постоянном объеме и теплоемкость при постоянном давлении



Пусть нагревание происходит в условиях, когда объем остается постоянным (V = const). Соответствующая молярная теплоемкость называется теплоемкостью при постоянном объеме, или изохорической теплоемкостью, и обозначается CV:
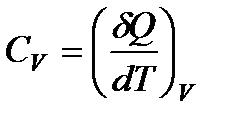
Так как теплота при этом тратится только на изменение внутренней энергии dU, то δQ = dU и
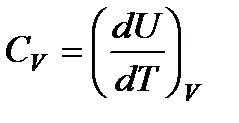
Отсюда dU = CV dT. Уравнение закона сохранения энергии (80) можно теперь переписать в виде
Следовательно, подводимое к телу тепло расходуется на изменение температуры dT (изменение внутренней энергии) и изменение объема dV (с этим связана внешняя механическая работа).
Если при нагревании постоянным остается давление, то теплоемкость называется теплоемкостью при постоянном давлении Ср (ее можно также называть изобарической теплоемкостью):


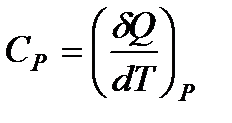
Пользуясь результатами кинетической теории газов, легко вычислить молярные теплоемкости идеального газа.
Для идеального одноатомного газа, как мы видели, внутренняя энергия моля равна U = 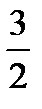
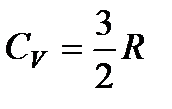
Если разделить это значение молярной теплоемкости на число молекул в грамм-молекуле, т. е на число Авогадро, то получим тот средний вклад, который каждая молекула вносит в теплоемкость газа:
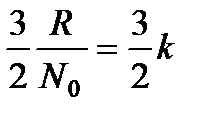
Следовательно, при повышении температуры на 1 К энергия каждой молекулы в среднем возрастает на 
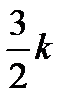
Теплоемкость Cp идеального газа при постоянном давлении больше теплоемкости CV при постоянном объеме на величину работы, которую совершает моль газа, расширяясь при нагревании на 1К. Работа эта равна 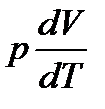
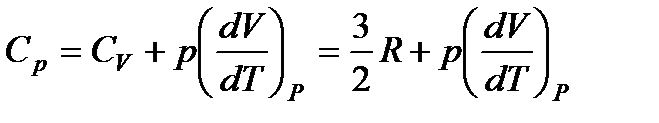
Но для моля идеального газа pV = RT, поэтому 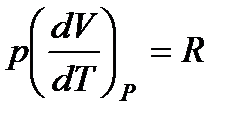
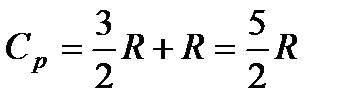
Из формул (85) и (87) видно, что теплоемкость при постоянном давлении превосходит теплоемкость при постоянном объеме на величину R:
Уравнение (88) называется уравнением Роберта Майера. Из него вытекает физический смысл газовой постоянной:
Краткая теория. Отношение удельной теплоемкости при постоянном давлении сp к удельной теплоемкости при постоянном объеме сv
Отношение удельной теплоемкости при постоянном давлении сp к удельной теплоемкости при постоянном объеме сv, называемое показателем адиабаты
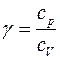
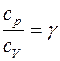
Адиабатным процессом называется процесс, осуществляющийся без теплообмена с внешней средой. Он протекает в системе, окруженной теплоизолирующей оболочкой, но его можно реализовать и при отсутствии такой оболочки. Для этого процесс должен протекать настолько быстро, чтобы за время его осуществления не произошло теплообмена между системой и окружающей средой. В настоящей лабораторной работе адиабатным можно считать быстропротекающий процесс расширения воздуха при открытом кране баллона.
В случае адиабатного процесса 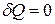
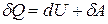
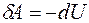
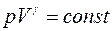
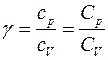
Выражение для γ в (2) следует из связи
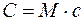
где М — молярная масса газа.
Удельной теплоемкостью с вещества называется физическая величина, численно равная количеству теплоты Q, необходимой для нагревания единицы массы вещества на один кельвин:
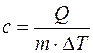
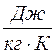
Молярной теплоемкостью С вещества называется физическая величина, численно равная количеству теплоты Q, необходимой для нагревания одного моля вещества на один кельвин:
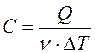

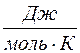
где ν – число молей вещества.
Для вещества в газообразном состоянии величина удельной и молярной теплоёмкостей газа существенно зависит от того, при каких условиях он нагревается: при постоянном объёме или при постоянном давлении. В первом случае сообщенное газу тепло идёт только на увеличение внутренней энергии газа, так как объём газа не изменяется и поэтому не совершается работа расширения. Во втором случае требуется дополнительное количество теплоты, необходимое для совершения работы расширения газа, так как неизменность давления обеспечивается увеличением объёма газа. Поэтому у газа различают две удельные и две молярные теплоёмкости: теплоёмкость при постоянном объёме и теплоемкость при постоянном давлении.
Учитывая, что для ν молей элементарное количество теплоты δQ = νCdT,
первое начало термодинамики 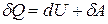
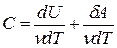
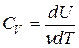
Здесь символ d употребляется для обозначения бесконечно малого приращения функции, а 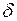
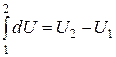
Элементарная работа 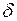
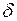
Молярная теплоемкость при постоянном давлении равна
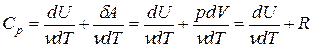
т.к. из уравнения Клапейрона-Менделеева PV = νRT следует, что 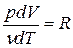
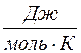
Таким образом, молярная теплоемкость Сp газа при постоянном давлении больше молярной теплоёмкости Cv при постоянном объёме на универсальную газовую постоянную R:
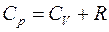
Это означает, что при изобарном процессе газу нужно сообщить кроме тепла, идущего на увеличение внутренней энергии, еще некоторое добавочное количество тепла, эквивалентное произведенной им внешней работе. Соотношение (8) называется уравнением Майера.
Известно, что внутренняя энергия ν молей газа определяется как U= 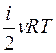
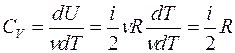
а с учетом уравнения Майера (8) молярная теплоемкость при постоянном давлении равна
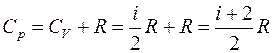
Для показателя адиабаты γ имеем
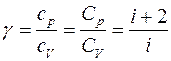
откуда видно, что величина g зависит только от числа степеней свободы молекул, из которых состоит газ.
Численное значение g различно для одно-, двух или многоатомных идеальных газов и зависит от числа i степеней свободы: для одноатомных i = 3, двухатомных
i = 5 и многоатомных i = 6.
Число поступательных степеней свободы iпост равно 3 (в трехмерном пространстве поступательное движение центра масс молекулы можно описать тремя пространственными координатами х, у и z).
Процессы, при которых один из основных параметров состояния p, V, Т сохраняется постоянным, называются изопроцессами.
Изохорным называется процесс, протекающий при постоянном объеме V = =const, поэтому DV = dV = 0. Изохорный процесс описывается законом Гей-Люссака

Элементарная работа в изохорном процессе равна нулю: δA = pdV= 0, следовательно, все подводимое тепло идет на повышение внутренней энергии газа: δQ = δU.
Одним из методов определения показателя адиабаты γ для воздуха является метод Клемана и Дезорма, который также называют методом адиабатного расширения. Экспериментальная установка состоит из стеклянного баллона А (рис. 1), соединен-
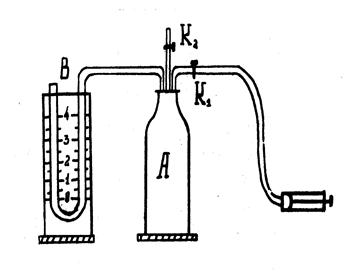 Рис. 1 Рис. 1 | Н | ного с водяным манометром В и насосом Н. Водяной U-образный манометр В измеряет избыточное, по сравнению с атмосферным, давление воздуха в баллоне А. Через кран К1 воздух нагнетается в баллон, а через кран К2 — выпускается. Если кран К2 открыт, баллон сообщается с атмосферным воздухом и давление р внутри него равно атмосферному, разность уровней воды в коленах манометра равна нулю, а температура Т в баллоне равна температуре окружающей среды. |
В процессе работы воздух, заключенный в баллоне, проходит последовательно три состояния.
1. Если закрыть кран К2 и накачать в баллон небольшое количество воздуха, то давление в баллоне станет выше атмосферного, что отмечается возникновением разности уровней воды в коленах манометра. При сжатии (накачке) воздух в баллоне нагревается выше комнатной температуры, после закрытия крана К2 начинается теплообмен с внешней средой через стенки баллона. Это процесс изохорного охлаждения, который прекращается, когда воздух в баллоне примет температуру окружающей среды T1. При этом разность уровней в манометре станет устойчивой и равной ρgh1, где ρ – плотность воды в манометре; g— ускорение свободного падения; h1 – разность уровней воды в коленах манометра. Состояние I воздуха в баллоне характеризуется температурой T1, давлением р1= р0+ ρgh1, где р0 – атмосферное давление, а ρgh1— добавочное давление, избыточное над атмосферным.
2. Если открыть и быстро закрыть кран К2, то часть воздуха выйдет из баллона и давление сравняется с атмосферным р0, а температура газа понизится до Т2
2.3. Теплоемкость системы
Введем теперь очень важную термодинамическую характеристику, называемую теплоемкостью системы (традиционно обозначается буквой С с различными индексами).
Теплоемкость системы — это физическая величина, равная количеству теплоты, которое необходимо передать системе, чтобы увеличить ее температуру на один кельвин (градус):
Теплоемкость — величина аддитивная, она зависит от количества вещества в системе. Поэтому вводят также удельную теплоемкость
Удельная теплоемкость — это теплоемкость единицы массы вещества
и молярную теплоемкость
Молярная теплоемкость — это теплоемкость одного моля вещества
Поскольку количество теплоты не есть функция состояния и зависит от процесса, теплоемкость также будет зависеть от способа подвода тепла к системе. Чтобы понять это, вспомним первое начало термодинамики. Разделив равенство ( 2.4 
Второе слагаемое, как мы убедились, зависит от вида процесса. Отметим, что в общем случае неидеальной системы, взаимодействием частиц которой (молекул, атомов, ионов и т. п.) пренебречь нельзя (см., например, § 2.5 ниже, в котором рассматривается ван–дер–ваальсовский газ), внутренняя энергия зависит не только от температуры, но и от объема системы. Это объясняется тем, что энергия взаимодействия зависит от расстояния между взаимодействующими частицами. При изменении объема системы меняется концентрация частиц, соответственно, меняется среднее расстояние между ними и, как следствие, меняется энергия взаимодействия и вся внутренняя энергия системы. Другими словами, в общем случае неидеальной системы
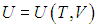
Поэтому, в общем случае первое слагаемое нельзя писать в виде полной производной, полную производную необходимо заменить на частную производную с дополнительным указанием на то, при какой постоянной величине она вычисляется. Например, для изохорного процесса:
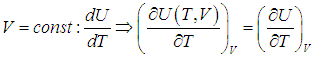
Или для изобарного процесса
Входящая в это выражение частная производная 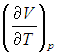
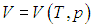

эта производная равна
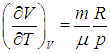
Мы рассмотрим два частных случая, соответствующих процессу подведения теплоты:
В первом случае работа dА = 0 и мы получаем теплоемкость СV идеального газа при постоянном объеме:
С учетом сделанной выше оговорки, для неидеальной системы соотношение (2.19) необходимо записать в следующем общем виде
Заменив в 2.7 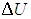
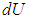
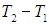
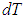
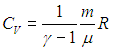
Для вычисления теплоемкости идеального газа Сp при постоянном давлении (dp = 0) мы учтем, что из уравнения ( 2.8 
Разделив это уравнение на число молей вещества в системе, получаем аналогичное соотношение для молярных теплоемкостей при постоянном объеме и давлении, называемое соотношением Майера
Приведем для справки общую формулу — для произвольной системы — связывающую изохорную и изобарную теплоемкости:
Выражения (2.20) и (2.21) получаются из этой формулы путем подстановки в неё выражения для внутренней энергии идеального газа 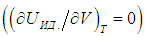
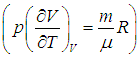
Теплоемкость данной массы вещества при постоянном давлении больше теплоемкости при постоянном объеме, так как часть подведенной энергии тратится на совершение работы и для такого же нагревания требуется подвести больше теплоты. Отметим, что из (2.21) следует физический смысл газовой постоянной:
Газовая постоянная R — это работа, совершаемая молем идеального газа при повышении его температуры на 1 К при постоянном давлении.
Таким образом, теплоемкость оказывается зависящей не только от рода вещества, но и от условий, в которых происходит процесс изменения температуры.
Как мы видим, изохорная и изобарная теплоемкости идеального газа от температуры газа не зависят, для реальных веществ эти теплоемкости зависят, вообще говоря, также и от самой температуры Т.
Изохорную и изобарную теплоемкости идеального газа можно получить и непосредственно из общего определения, если воспользоваться полученными выше формулами ( 2.7 

Для изохорного процесса выражение для СV следует из ( 2.7 
Для изобарного процесса выражение для Ср вытекает из ( 2.10 
Для молярных теплоемкостей отсюда получаются следующие выражения
Отношение теплоемкостей равно показателю адиабаты:
На термодинамическом уровне нельзя предсказать численное значение g; нам удалось это сделать лишь при рассмотрении микроскопических свойств системы (см. выражение ( 1.19 
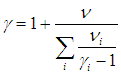

Одноатомные газы (i = 3):
Двухатомные газы (i = 5):
Многоатомные газы (i = 6):
Экспериментальные данные для различных веществ приведены в таблице 1.
Таблица 1
Видно, что простая модель идеальных газов в целом неплохо описывает свойства реальных газов. Обращаем внимание, что совпадение было получено без учета колебательных степеней свободы молекул газа.
Мы привели также значения молярной теплоемкости некоторых металлов при комнатной температуре. Если представить кристаллическую решетку металла как упорядоченный набор твердых шариков, соединенных пружинками с соседними шариками, то каждая частица может только колебаться в трех направлениях (iкол = 3), и с каждой такой степенью свободы связаны кинетическая kВТ/2 и такая же потенциальная энергия. Поэтому на частицу кристалла приходится внутренняя (колебательная) энергия kВТ. Умножая на число Авогадро, получим внутреннюю энергию одного моля
откуда вытекает значение молярной теплоемкости
(Вследствие малого коэффициента теплового расширения твердых тел для них не различают ср и cv). Приведенное соотношение для молярной теплоемкости твердых тел называется законом Дюлонга и Пти, и из таблицы видно хорошее совпадение расчетного значения
Говоря о неплохом соответствии приведенных соотношений и данных опытов, следует отметить, что оно наблюдается лишь в определенном диапазоне температур. Иначе говоря, теплоемкость системы зависит от температуры, и формулы (2.24) имеют ограниченную область применения. Рассмотрим сначала рис. 2.10, на котором изображена экспериментальная зависимость теплоемкости стV газообразного водорода от абсолютной температуры Т.
Рис. 2.10. Молярная теплоемкость газообразного водорода Н2 при постоям ном объеме как функция температуры (экспериментальные данные)
Ниже, для краткости, говорится об отсутствии у молекул тех или иных степеней свободы в определенных температурных интервалах. Еще раз напомним, что речь в действительности идет о следующем. По квантовым причинам, относительный вклад во внутреннюю энергию газа отдельных видов движения действительно зависит от температуры и в определенных температурных интервалах может быть мал настолько, что в эксперименте — всегда выполняемом с конечной точностью — он незаметен. Результат эксперимента выглядит так, как будто этих видов движения нет, нет и соответствующих степеней свободы. Число и характер степеней свободы определяются структурой молекулы и трехмерностью нашего пространства — от температуры они зависеть не могут.
Вклад во внутреннюю энергию от температуры зависит и может быть мал.
При температурах ниже 100 К теплоемкость
что указывает на отсутствие у молекулы как вращательных, так и колебательных степеней свободы. Далее с ростом температуры теплоемкость быстро возрастает до классического значения
характерного для двухатомной молекулы с жесткой связью, в которой нет колебательных степеней свободы. При температурах свыше 2 000 К теплоемкость обнаруживает новый скачок до значения
Этот результат свидетельствует о появлении еще и колебательных степеней свободы. Но все это пока выглядит необъяснимым. Почему молекула не может вращаться при низких температурах? И почему колебания в молекуле возникают лишь при очень высоких температурах? В предыдущей главе дано краткое качественное рассмотрение квантовых причин подобного поведения. А сейчас можно лишь повторить, что все дело сводится к специфически квантовым явлениям, не объяснимым с позиций классической физики. Эти явления подробно рассмотрены в последующих разделах курса.
http://www.plib.ru/library/book/14222.html — Яворский Б.М., Детлаф А.А. Справочник по физике, Наука, 1977 г. — стр. 236 — таблица характеристических температур «включения» колебательных и вращательных степеней свободы молекул для некоторых конкретных газов;
Обратимся теперь к рис. 2.11, представляющему зависимость молярных теплоемкостей трех химических элементов (кристаллов) от температуры. При высоких температурах все три кривые стремятся к одному и тому же значению
соответствующему закону Дюлонга и Пти. Свинец (Рb) и железо (Fe) практически имеют это предельное значение теплоемкости уже при комнатной температуре.
Для алмаза же (С) такая температура еще не достаточно высока. А при низких температурах все три кривые демонстрируют значительное отклонение от закона Дюлонга и Пти. Это еще одно проявление квантовых свойств материи. Классическая физика оказывается бессильной объяснить многие наблюдаемые при низких температурах закономерности.