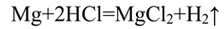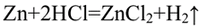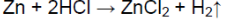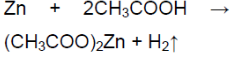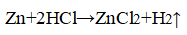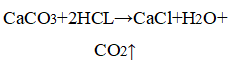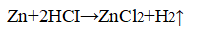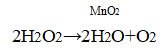Почему реакция цинка с соляной кислотой быстрее чем с уксусной кислотой
Вопросы к параграфу 4 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
§ 4. Практическая работа №1.
Изучение влияния условий проведения химической реакции на её скорость
1. Влияние природы реагирующих веществ. 1) В три пробирки налейте соляную кислоту. В первую пробирку положите кусочек магния, во вторую — кусочек цинка, в третью — кусочек меди. Что наблюдаете? Какая из реакций протекает быстрее? 2) Налейте в одну пробирку соляной кислоты, в другую — такое же количество уксусной кислоты (концентрация кислот должна быть одинаковой). Опустите в каждую пробирку по две гранулы цинка. Определите, какая реакция протекает быстрее.
Уравнение химической реакции
Интенсивное выделение газа
Скорость химической реакции между металлом и кислотой увеличивается, когда применяют более активный металл.
Образование пузырьков газа
Ничего не происходит
Уравнение химической реакции
Скорость химической реакции между цинком и кислотой увеличивается, когда применяют более сильную кислоту.
Образование пузырьков газа
2. Влияние концентрации реагирующих веществ. В две пробирки поместите по одной грануле цинка. В одну пробирку прилейте 1 мл 30%-ной соляной кислоты, в другую — 1 мл 10%-ной соляной кислоты. Где более интенсивно проходит реакция? Почему?
Уравнение химической реакции
Скорость реакции тем выше, чем выше концентрация кислоты.
Образование пузырьков газа
3. Влияние поверхности соприкосновения реагентов. В одну пробирку опустите кусочек мела, в другую насыпьте немного порошка мела. Налейте в пробирки по 1,5 мл соляной кислоты одинаковой концентрации. Есть ли разница в скорости выделения газа?
Уравнение химической реакции
Образование пузырьков газа
Если вещество находится в измельчённом виде, газ выделяется интенсивнее, так как увеличивается площадь поверхности соприкосновения веществ.
4. Влияние температуры. В две пробирки опустите по одной грануле цинка. Налейте в каждую пробирку по 1 мл соляной кислоты одинаковой концентрации. Одну пробирку опустите в стакан с горячей водой. Сравните интенсивность выделения пузырьков водорода в пробирках и сделайте вывод о влиянии температуры на скорость химической реакции.
Уравнение химической реакции
При возрастании температуры среды (при нагревании пробирки с помощью горячей воды) реакция идёт интенсивнее.
Образование пузырьков газа
5. Влияние катализатора. В пробирку налейте 1 мл пероксида водорода и внесите тлеющую лучинку. не прикасаясь к жидкости. Что наблюдаете? Добавьте к пероксиду водорода несколько кристалликов оксида марганца(IV) МnO2, и снова внесите тлеющую лучинку. Что наблюдаете? Какую роль играет МnO2?
Уравнение химической реакции
Изменений не наблюдается
При помещении тлеющей лучинки в пробирку с перекисью водорода изменений не наблюдается, потому что кислорода слишком мало. В присутствии MnO2 в качестве катализатора, разложение перекиси водорода ускоряется, кислород выделяется быстрее, лучинка загорается.
Тлеющая лучинка вспыхивает
6. Отчет о работе составьте в произвольной форме и сделайте общий вывод.
На скорость взаимодействия веществ влияют такие факторы, как: природа химических веществ, их концентрация, площадь поверхности контакта, температура и наличие/отсутствие катализатора. Скорость химической реакции увеличивают такие факторы, как: высокая активность взаимодействующих веществ, их высокая концентрация, большая площадь соприкосновения, высокая температура и присутствие катализатора.
Практическая работа №2. Влияние различных факторов на скорость химической реакции. Химия 11 класс
Практическая работа №2
Влияние различных факторов на скорость химической реакции.
Цель: рассмотреть влияние различных факторов на скорость химической реакции.
Оборудование и реактивы: пробирки, спиртовка, спички, держатель, штатив для пробирок, лучинка, цинк, магний, медь: гранулы и порошок, растворы соляной кислоты (1:3, 1:10), уксусная кислота, мел, стакан с горячей водой, пероксид водорода, оксид марганца ( IV ).
Оформить работу в виде таблицы:
Рассматриваемый фактор, влияющий на скорость химической реакции
Наблюдения, позволяющие судить о скорости реакции
1. Влияние природы реагирующих веществ
В первой пробирке (магния) наблюдается активное выделение газа (водорода)
Во второй пробирке (где цинк) медленно выделяются пузырьки газа (водорода)
В третей пробирке (где медь) ничего не наблюдается
Cu + HCl ↛ реакция не идет
С цинком быстрее протекает реакция с соляной кислотой, чем с уксусной кислотой
2. Влияние концентрации реагирующих веществ
Где более интенсивно проходит реакция? Почему?
Там, где концентрация кислоты больше (1:3), там реакция идет быстрее, чем где концентрация кислоты составляет 1:10.
В двух пробирках идет одна и та же реакция:
Zn + 2HCl → ZnCl 2 + H 2 ↑
Чем выше концентрация реагирующих веществ, тем чаще столкновения их частиц и тем выше скорость химической реакции
3. Влияние поверхности соприкосновения реагентов
В одну пробирку опустите кусочек мела, в другую насыпьте порошок мела. Налейте в пробирку по 1,5 мл соляной кислоты одинаковой концентрации. Есть ли разница в скорости выделения газа?
Наиболее интенсивно газ выделяется, там где был порошок мела, нежели кусочек мела
В двух пробирках идет одна и та же реакция:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 ↑
При увеличении степени измельчения твердых веществ, увеличивается поверхность соприкосновения реагирующих веществ, т. е. растет число столкновений между молекулами и или атомами поэтому, чем выше степень измельчения веществ, тем быстрее протекает скорость реакции
4. Влияние температуры
В две пробирки опустите по одной грануле цинка. Налейте по 1 мл соляной кислоты одинаковой концентрации в каждую пробирку. Одну пробирку опустите в стакан с горячей водой. По интенсивности выделения пузырьков водорода сделайте вывод о влиянии температуры на скорость химической реакции
Быстрее реакция идет там, где пробирка опущена в стакан с горячей водой
В двух пробирках идет одна и та же реакция:
Zn + 2HCl → ZnCl 2 + H 2 ↑
При столкновении молекул и/или атомов реагируют только те молекулы и/или атомы, которые обладают достаточной кинетической энергией для осуществления реакции. При повышении температуры доля таких молекул и/или атомов возрастает, поэтому в пробирке, которая опущена в стакан с горячей водой, реакция идет более интенсивно
5. Влияние катализатора
В пробирку налейте 1 мл пероксида водорода и внесите тлеющую лучинку, не прикасаясь к жидкости. Что наблюдаете? Добавьте к пероксиду водорода несколько кристалликов оксида марганца
Под действием катализаторов вещества становятся реакционно способными при более низкой температуре
Вывод: Скорость химической реакции зависит от условий: от природы реагирующих веществ, от площади соприкосновения, от концентрации, от температуры, от присутствия катализаторов.
Правила техники безопасности при выполнении химического эксперимента
Многие вещества при попадании на кожу могут вызвать ожоги. Никогда не берите вещества руками.
Некоторые вещества имеют неприятный запах, а их пары могут вызвать отравление. Не подносите близко к лицу открытую склянку.
В химической лаборатории не пробуют на вкус даже известные вещества, они могут содержать примеси, ядовитые для человека.
Кислоты – едкие вещества. Разрушают и раздражают кожу, слизистые оболочки.
Если кислота или щёлочь попала на кожу, её надо немедленно промыть большим количеством проточной воды.
7. Зажигать спиртовку только спичками, гасить крышкой или колпачком, накрывая сверху.
8. Запрещается передавать зажжённую спиртовку и зажигать одну спиртовку от другой.
9. При нагревании вещества в пробирке её необходимо сначала прогреть, отверстие пробирки во время нагревания должно быть направлено от себя и соседа.
10. Стекло – хрупкий материал, имеющий малое сопротивление при ударе и незначительную прочность при изгибе. Категорически запрещается использовать посуду, имеющую трещины и отбитые края.
11. Пробирку закрепляют в держателе так, чтобы от горлышка пробирки до держателя было расстояние 1 – 1, 5 см.
12. Опыты проводить с таким количеством веществ, которые указаны в методическом руководстве по проведению каждого опыта.
13. Без разрешения учителя, ничего на столах не трогать.
14. Во время проведения эксперимента или оформлении отчёта соблюдайте тишину.
15. После работы приведи порядок на рабочем месте.
Почему реакция соляной кислоты с кусочком цинка или железа идёт намного быстрее, чем реакция уксусной кислоты такой же концентра
Ca + 2HCl → CaCl2 + H2
Ca + 4HNO3(конц.) → Ca(NO3)2 + 2NO2↑ + 2H2O
KOH + NH4Cl → KCl + NH3↑ + H2O
6KOH + P2O5 → 2K3PO4 + 3H2O
2KOH + CrO3 → K2CrO4 + H2O
SO2 + 2NaOH → Na2SO3 + H2O
ZnS + 2NaOH → Zn(OH)2↓ + Na2S
ZnS + H2O → ZnO + H2S
ZnS + O2(недост.) → Zn + SO2
2ZnS + 3O2(изб.) → 2ZnO + 2SO2
C6H12O6=без доступа кислорода=>2CH3-CH(OH)COOH (молочная кислота). Такая реакция происходит в мышцах при занятии спортом из-за кислородного голодания, именно от этой кислоты такое неприятное ощущение.
Это действительно определение с точки зрения ТЭД, но свойствами я бы это не назвала.
К химическим свойствам кислот относятся:
1. при взаимодействии кислоты и основания образуется соль и вода
По другому можно записать так:
К-та+ гидроксид= соль+вода (р-ия называется реакциией нейтролизации)
(дальше я напишу в такой форме, я думаю, разберетесь)
2.К-та +оксид Металла= соль+вода
3. К-та +металл= соль + водород (напомню это H2)
4.К-та +соль = другая к-та + другая соль
Я бы вам посоветовала еще выучить условия протекания этих реакций.
Почему реакция цинка с соляной кислотой быстрее чем с уксусной кислотой
С наибольшей скоростью при комнатной температуре протекает реакция между
1) медью и кислородом
2) растворами карбоната натрия и хлорида кальция
4) магнием и соляной кислотой
С наибольшей скоростью при комнатной температуре протекает реакция между водородом и
С наибольшей скоростью соляная кислота взаимодействует с
1) металлическим цинком
2) раствором гидроксида бария
3) металлическим железом
4) карбонатом магния
С наибольшей скоростью при комнатной температуре происходит взаимодействие
1) растворов нитрата серебра и хлорида калия
3) меди с кислородом
4) цинка с разбавленной серной кислотой
Магний медленнее всего растворяется в
1) 1%-й уксусной кислоте
2) 5%-й уксусной кислоте
3) 1%-й соляной кислоте
4) 5%-й соляной кислоте
Цинк быстрее всего растворяется в
1) 1%-й уксусной кислоте
2) 5%-й уксусной кислоте
3) 1%-й серной кислоте
4) 5%-й серной кислоте
С наименьшей скоростью соляная кислота взаимодействует с
10%-ная соляная кислота быстрее всего реагирует с
4) раствором щёлочи
10%-раствор быстрее всего реагирует с
1) соляной кислотой
В каких условиях горение углерода протекает медленнее всего?
1) воздух, температура 20 °С
2) воздух, температура 50 °С
3) кислород, температура 20 °С
4) кислород, температура 50 °С
В каких условиях горение фосфора протекает быстрее всего?
Почему реакция цинка с соляной кислотой быстрее чем с уксусной кислотой
Из предложенного перечня веществ выберите все вещества, между которыми реакция протекает с наибольшей скоростью при одинаковых условиях.
1)
2)
3)
4)
5)
Запишите номера выбранных ответов.
Факторы, влияющие на скорость реакции:
− температура (с увеличением температуры увеличивается скорость реакции);
− концентрация реагентов (с увеличением концентрации реагентов увеличивается скорость реакции);
− площадь соприкосновения реагентов (для гетерогенных реакций);
− давление (при наличии газообразных реагентов повышение давления повышает концентрацию газообразных веществ);
− катализатор (увеличивает скорость реакции).
С наибольшей скоростью будет протекать реакция между растворами соляной кислоты и гидроксида кальция, так как исходные вещества растворены в воде и диссоциированы на ионы, процесс протекает во всем объёме, в отличие от других вариантов, где процесс протекает на поверхности или реакция не идёт.
С наибольшей скоростью при комнатной температуре протекает реакция
1)
2)
3)
4)
С наибольшей скоростью при комнатной температуре протекает реакция . Исходные вещества хорошо растворимы в воде и взаимодействие происходит по всему объему, в отличие от других процессов, где реакция протекает на границе между твердой и жидкой фазой.
С наибольшей скоростью бромоводородная кислота взаимодействует с
1) оксидом железа (III)
2) металлическим цинком
3) металлическим никелем
4) раствором гидроксида бария
С наибольшей скоростью бромоводородная кислота взаимодействует с раствором гидроксида бария, так как исходные вещества являются электролитами и они диссоциируют в растворах на ионы, поэтому реакция протекает во всем объеме раствора. В других вариантах реакция протекает на поверхности.
При комнатной температуре с наибольшей скоростью с водой реагирует
здравствуйте! разве для таких щелочных Ме, как К и Na не требуется нагревание, для взаимодействия с водой?
а Са с водой реагирует без нагревания, несмотря на то, что он не щелочной.
или именно этот пункт играет важную роль?
Реагируют без всякого нагревания, сам видел. Видео тоже можно найти.
С наибольшей скоростью водород реагирует с
Скорость реакции зависит от природы реагирующих веществ. Наиболее активный элемент, входящий в простые вещества неметаллы, это фтор, значит, реакция с водородом пойдет с большей скоростью
С наибольшей скоростью при комнатной температуре протекает реакция между водородом и
Факторы влияющие на скорость реакции
— температура (с увеличением температуры увеличивается скорость реакции);
— концентрация реагентов (с увеличением концентрации реагентов увеличивается скорость реакции);
— площадь соприкосновения реагентов (для гетерогенных реакций);
— катализатор (увеличивает скорость реакции).
Гомогенные реакции практически всегда протекают быстрее чем гетерогенные.
С наибольшей скоростью при комнатной температуре взаимодействуют
1) цинк (гранулы) и кислород
2) цинк (гранулы) и соляная кислота
3) цинк (порошок) и кислород
4) цинк (порошок) и соляная кислота
Скорость гетерогенной реакции рассчитывается на единицу площади поверхности, поэтому не зависит от степени измельченности реагента
С наибольшей скоростью при обычных условиях происходит взаимодействие воды с
3) оксидом кремния (IV)
С алюминием и оксидом кремния (IV) вода не реагирует.С железом реагирует при нагревании. Остается ответ№1
«С алюминием и оксидом кремния (IV) вода не реагирует.»
Методическая ошибка. Не объяснена причина, почему алюминий не реагирует с водой. Алюминий металл активней железа и без пояснения, что на поверхности алюминия образуется оксидная пленка, у учащихся может сформироваться ошибочное знание.
Да и по поводу диоксида кремния, тоже не мешало бы пояснить.
Для этого и существуют учебники (бумажные, электронные. ). А этот сайт учебником не является, это, скорее, задачник.
C наибольшей скоростью протекает реакция между
1)
2)
3)
4)
С наибольшей скоростью будет протекать реакция между , так как исходные вещества растворены в воде и диссоциированы на ионы, процесс протекает во всем объеме, в отличие от других вариантов, где процесс протекает на поверхности.
С наибольшей скоростью гидроксид натрия взаимодействует с
1) металлическим цинком
2) сульфатом меди (II)
3) азотной кислотой
4) сульфидом железа (II)
С наибольшей скоростью при комнатной температуре протекает реакция
1)
2)
3)
4)
но ведь надо, реакцию с наименьшей скоростью найти.
Егор, читайте условие внимательно.
«С наибольшей скоростью при комнатной температуре протекает реакция. «
Ну, вот такой я глупый.
А этот Ваш вопрос следует считать «нормальным»?
С наибольшей скоростью соляная кислота взаимодействует с
1) металлическим цинком
2) раствором гидроксида натрия
3) металлическим железом
4) твёрдым карбонатом железа (II)
С наибольшей скоростью при комнатной температуре взаимодействуют
2) соляная кислота и раствор карбоната натрия
3) натриевая щелочь и алюминий
4) оксид кальция и вода
Взаимодействие двух растворимых веществ в воде будет протекать быстрее чем приведенные гетерогенные реакции.
С наибольшей скоростью при комнатной температуре протекает реакция между
1) медью и кислородом
2) растворами карбоната натрия и хлорида кальция
4) магнием и соляной кислотой
Гомогенные реакции чаще всего протекают быстрее чем гетерогенные.
С наибольшей скоростью при комнатной температуре взаимодействуют
1) и
2) и
3) и
4) и