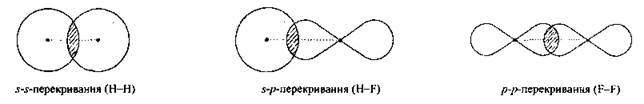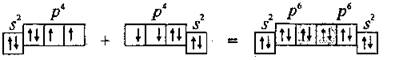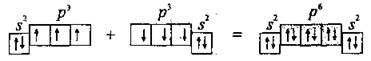Почему пи связь менее прочная чем сигма связь
В чём различие между σ-связью и π-связью?
Обсуждение вопроса:
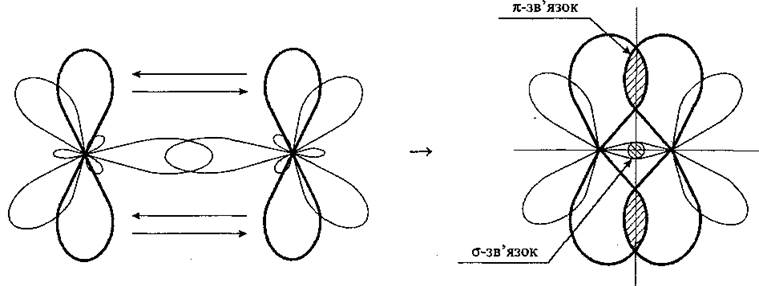
Пи-связь (π-связь) — ковалентная связь, образующаяся перекрыванием атомных p-орбиталей. В отличие от сигма-связи, осуществляемой перекрыванием s-орбиталей вдоль линии соединения атомов, пи-связи возникают при перекрывании p-орбиталей по обе стороны от линии соединения атомов. Считается, что пи-связь реализуется в кратных связях — двойная связь состоит из одной сигма- и одной пи-связи, тройная — из одной сигма- и двух ортогональных пи-связей.
Концепцию сигма- и пи-связей разработал Лайнус Полинг в 30-х годах прошлого века.
σ-связь (сигма-связь) — ковалентная связь, образующаяся перекрыванием электронных облаков «по осевой линии», соединяющей ядра атомов. Характеризуется осевой симметрией.
Концепцию Сигма- и Пи- связей сформулировал дважды лауреат Нобелевской премии Лайнус Полинг в 30-х годах прошлого века. Идея включала гибридизацию атомных орбиталей, рассчитанную с помощью простых алгебраических действий.
Считалось, что сигма-связь образуется за счёт перекрывания вытянутых гибридных орбиталей, а Пи-связь образуется за счёт перекрывания p-орбиталей.
Однако сам Л.Полинг не был удовлетворён описанием сигма- и пи-связей. На симпозиуме по теоретической органической химии, посвящённом памяти А.Кекуле (Лондон, сентябрь 1958 г.), он раскритиковал и отказался от σ, π — описаний и предложил теорию изогнутой химической связи. Последняя теория чётко учитывала физический смысл ковалентной химической связи.
Сигма-связь более прочная, чем пи-связь. На пи-МО электроны более подвижны, поэтому поляризуемость пи-связи намного выше, чем сигма-связи.
Вокруг сигма-связи может происходить свободное внутримолекулярное вращение, в то время как вращение по двойной пи-связи не возможно без её разрыва.
Сигма и пи связи
Ковалентные связи. Пи- и сигма- связи
Основные объекты биохимии.
Объектами изучения биоорганической химии являются белки и пептиды, нуклеиновые кислоты, углеводы, липиды, биополимеры, алкалоиды, терпеноиды, витамины, антибиотики, гормоны, токсины, а также синтетические регуляторы биологических процессов: лекарственные препараты, пестициды и др.
Изомерия органических соединений, ее виды. Характеристика видов изомерии, примеры.
Различают два вида изомерии: структурную и пространственную (т.е. стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле, стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Например: молекулярной формуле С4Н10 соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода С5Н12 возможны три изомера: пентан, изо-пентан и неопентан. С4Н10 соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода С5Н12 возможны три изомера: пентан, изо-пентан и неопентан.
Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы
Межклассовая изомерия- изомерия веществ, принадлежащих к разным классам органических соединений.
Современная классификация и номенклатура органических соединений.
В настоящее время широко используется систематическая номенклатура- IUPAC- международная единая химическая номенклатура. Правила ИЮПАК основываются на несколько систем:
1) радикально-функциональная ( в основе названия лежит название функц-й группы),
2) соединительная (названия составляют из нескольких равноправных частей),
3) заместительная (основой названия служит углеводородный фрагмент).
Ковалентные связи. Пи- и сигма- связи.
Ковалентная связь являетсся основным типом связи в органических соединениях.
Это связь, образованная перекрытием пары валентных электронных облаков.
Пи-связь- это ковалентная связь, образующаяся путем перекрывания р-атомных орбиталей.
Сигма-связь- это ковалентная связь, образующаяся при перекрывании s-атомных орбиталей.
Если между атомами в молекуле образуются как s-, так и р-связи, то образуется кратная (двойная или тройная) связь.
6. Современные представления о структуре органических соединений. Понятие «химическое строение», «конфигурация», «конформация», их определение. Роль структуры в проявлении биологической активности.
В 1861 году А.М. Бутлеровым была предложена теория химического строения органических соединений, лежащая в основе современных представлений о структуре орг. соединений,которая состоит из следующих основных положений:
1.В молекулах веществ существует строгая последовательность химического связывания атомов, которая называется химическим строением.
2.Химические свойства вещества определяются природой элементарных составных частей, их количеством и химическим строением.
3.Если у веществ с одинаковым составом и молекулярной массой различное строение, то возникает явление изомерии.
4.Так как в конкретных реакциях изменяются только некоторые части молекулы, то исследование строения продукта помогает определить строение исходной молекулы.
5.Химическая природа (реакционная способность) отдельных атомов в молекуле меняется в зависимости от окружения, т.е. от того, с какими атомами других элементов они соединены.
Понятие «химическое строение» включает представление об определенном порядке соединения атомов в молекуле и об их химическом взаимодействии, изменяющем свойства атомов.
Конфигурация — относительное пространственное расположение атомов или групп атомов в молекуле химического соединения.
Конформация — пространственное расположение атомов в молекуле определенной конфигурации, обусловленное поворотом вокруг одной или нескольких одинарных сигма-связей
Сигма связь-ковалентная связь образованная при перекрывании атомных s-электронных облаков, происходит вблизи прямой, соединяющей ядра взаимодействующих атомов (т.е. вблизи оси связи)
В образовании сигма-связи могут принимать участие p-электронные облака, ориентированные вдоль оси связи. в молекуле HF ковалентная сигма-связь возникает вследствие перекрывание 1s-электронного облака атома водорода и 2p-электронного облака атома фтора.
Химическая связь в молекуле F2 тоже сигма связь, она образована 2p-элект. облаками двух атомов фтора.
Пи-связь — ковалентная связь, при взаимодействии p-электронных облаков, ориентированных перпендикулярно оси связи, образуются не одна, а две области перекрывания, расположенные по обе стороны от этой связи.
Примеры:
в молекуле N2 атомы азота связаны в молекуле тремя ковалентными связями, но связи неравноценны одна из них сигма, две другие пи-связи.
вывод о неравноценности связей в молекуле подтверждается тем, что энергия их разрыва различна; пи-связь является непрочной
Общая химия
3. Химическая связь
3.5. Сигма — и пи-связь
Пространственно различают два типа связи — сигма — и пи-связь.
1. Сигма-связь (σ-связь) — простой (одинарный) ковалентная связь, образующаяся перекрыванием электронных облаков по линии, соединяющей атомы.
Связь характеризуется осевой симметрией:
В образовании σ-связи могут принимать участие как обычные, так и гібридизовані орбитали.
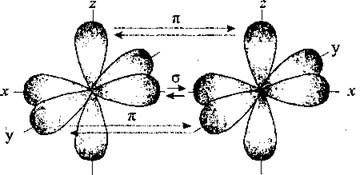
Пи-связь (π-связь). Если у атома после образования σ-связи остались неспаренные электроны, он может использовать их на образование второго типа связи, который называют π-связью. Рассмотрим его механизм на примере образования молекулы кислородаO2.
Два неспаренные р-электроны в атоме Кислорода могут образовать две совместные ковалентные пары с электронами второго атома Кислорода:
Одна пара идет на образование σ-связи:
Другая, перпендикулярная к ней, — на образование π-связи:
Еще однаp-орбиталь (рв), как иs-орбиталь, на которой находятся по две спаренные электроны, участия в связи не берут и не обобществляются.
Аналогичным образом при образовании органических соединений (алкенов и алкадієнів) послеsp2-гибридизации у каждого из двух атомов Углерода (между которыми образуется связь) остается по одной негібридизованій р-орбитали.
которые размещаются в плоскости, которая является перпендикулярной к оси соединения атомов Карбона:
В сумме σ — и π-связи дают двойную связь.
Тройная связь образуется аналогично и состоит из одной σ-связи (рх) и двух я-связей, которые образованы двумя взаимноперпендикулярными парамиp-орбиталей (ру,pz):
Пример: образование молекулы азотаN2.
Электронная формула атома Азота-7N 1s22s22p3или
В результате образования трех общих электронных парN≡Nкаждый атом Азота приобретает устойчивую электронную конфигурацию инертного элемента 2s22p6(октет электронов).
Тройная связь возникает и при образовании алкінів (в органической химии).
В результатеsг-гибридизации внешней электронной оболочки атома Углерода образуется двеsр-орбитали, расположенные по оси 0Х. Одна из них идет на формирование в-связи с другим атомом Углерода (вторая — на формирование σ-связи с атомом Водорода). А две не гібридизовані р-орбитали (ру,pz) размещаются перпендикулярно друг к другу и к оси соединения атомов (0Х).
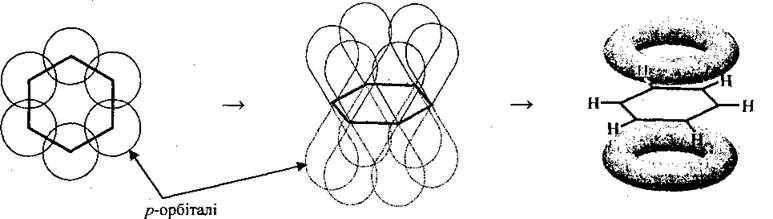
С помощью π-связи формируется молекула бензену и других аренов.
Длина связи (ароматического, «полуторного», сказывается
Все шесть атомов Углерода имеют общую π-электронное облако, плотность которой локализована над и под плоскостью ароматического ядра и равномерно распределена (делокалізована) между всеми атомами Углерода. По современным представлениям она имеет форму тороида:
Под длиной связи понимают расстояние между центрами ядер атомов Углерода, участвующих в связи.
π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи).
π-Связь слабее σ-связи из-за менее полного перекрывания р-АО.
Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
Типы связей в молекулах органических веществ
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
С–С, С–Н, С–О
С=С, С=О
С≡С, С≡N
Таким образом, число сигма-связей ( σ-связей) в молекуле метана равно четырем:
В молекуле этилена число сигма-связей равно пяти, а также есть одна пи-связь (между атомами углерода):
В молекуле ацетилена всего три сигма-связи и две пи-связи:
H–C≡C–H
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Сигма-связь
σ-связь(сигма-связь) — ковалентная связь, образующаяся перекрыванием электронных облаков «по осевой линии». Характеризуется осевой симметрией. Связь, образующаяся при перекрывании гибридных орбиталей вдоль линии, соединяющей ядра атома.
Считалось, что сигма-связь образуется за счёт перекрывания вытянутых гибридных орбиталей (рис.1), а Пи-связь образуется за счёт перекрывания p-орбиталей (рис.2).
В настоящее время разработаны Анимированные изображения гибридизации атомных орбиталей.
Основная характеристика сигма-связи (длина и прочность) зависит от электронной конфигурации атомов, образующих сигма-связь. Характеристика сигма-связи [3]
| Молекула | Электронная конфигурация атома | Орбитальный радиус атома, Å | Длина связи, Å | Энергия разрыва связи, кДж/моль |
|---|---|---|---|---|
| H2 | —— 1S 1 | 0,53 | 0,74 | 436 |
| Li2 | [He] 2S 1 | 1,57 | 2,67 | 102 |
| Na2 | [Ne] 3S 1 | 1,715 | 3,08 | 73 |
| K2 | [Ar] 4S 1 | 2,09 | 3,92 | 57 |
| Rb2 | [Kr] 5S 1 | 2,22 | 4,10 | 49 |
| Cs2 | [Xe] 6S 1 | 2,35 | 4,30 | 42 |
Чем больше электронное экранирование ядра атома, тем удалённее от ядра единственный валентный электрон электронной оболочки атома, тем больше длина сигма-связи и меньше её прочность.
какая связь прочнее сигма или пи
Типы связей в молекулах органических веществ
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
С–С, С–Н, С–О
С=С, С=О
С≡С, С≡N
Таким образом, число сигма-связей ( σ-связей) в молекуле метана равно четырем:
В молекуле этилена число сигма-связей равно пяти, а также есть одна пи-связь (между атомами углерода):
В молекуле ацетилена всего три сигма-связи и две пи-связи:
H–C≡C–H
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
В чём различие между σ-связью и π-связью?
Обсуждение вопроса:
Пи-связь (π-связь) — ковалентная связь, образующаяся перекрыванием атомных p-орбиталей. В отличие от сигма-связи, осуществляемой перекрыванием s-орбиталей вдоль линии соединения атомов, пи-связи возникают при перекрывании p-орбиталей по обе стороны от линии соединения атомов. Считается, что пи-связь реализуется в кратных связях — двойная связь состоит из одной сигма- и одной пи-связи, тройная — из одной сигма- и двух ортогональных пи-связей.
Концепцию сигма- и пи-связей разработал Лайнус Полинг в 30-х годах прошлого века.
σ-связь (сигма-связь) — ковалентная связь, образующаяся перекрыванием электронных облаков «по осевой линии», соединяющей ядра атомов. Характеризуется осевой симметрией.
Концепцию Сигма- и Пи- связей сформулировал дважды лауреат Нобелевской премии Лайнус Полинг в 30-х годах прошлого века. Идея включала гибридизацию атомных орбиталей, рассчитанную с помощью простых алгебраических действий.
Считалось, что сигма-связь образуется за счёт перекрывания вытянутых гибридных орбиталей, а Пи-связь образуется за счёт перекрывания p-орбиталей.
Однако сам Л.Полинг не был удовлетворён описанием сигма- и пи-связей. На симпозиуме по теоретической органической химии, посвящённом памяти А.Кекуле (Лондон, сентябрь 1958 г.), он раскритиковал и отказался от σ, π — описаний и предложил теорию изогнутой химической связи. Последняя теория чётко учитывала физический смысл ковалентной химической связи.
Сигма-связь более прочная, чем пи-связь. На пи-МО электроны более подвижны, поэтому поляризуемость пи-связи намного выше, чем сигма-связи.
Вокруг сигма-связи может происходить свободное внутримолекулярное вращение, в то время как вращение по двойной пи-связи не возможно без её разрыва.
Какая связь прочнее сигма или пи
РАЗДЕЛ И. ОБЩАЯ ХИМИЯ
В образовании σ-связи могут принимать участие как обычные, так и гібридизовані орбитали.
Два неспаренные р-электроны в атоме Кислорода могут образовать две совместные ковалентные пары с электронами второго атома Кислорода:
Одна пара идет на образование σ-связи:
которые размещаются в плоскости, которая является перпендикулярной к оси соединения атомов Карбона:
В результате образования трех общих электронных пар N≡N каждый атом Азота приобретает устойчивую электронную конфигурацию инертного элемента 2 s 2 2 p 6 (октет электронов).
С помощью π-связи формируется молекула бензену и других аренов. Длина связи (ароматического, «полуторного», сказывается 
1 Под длиной связи понимают расстояние между центрами ядер атомов Углерода, участвующих в связи.
Сигма-связь
Концепцию Сигма- и Пи- связей сформулировал дважды лауреат Нобелевской премии Лайнус Полинг в 30-х годах прошлого века. Идея включала гибридизацию атомных орбиталей, рассчитанную с помощью простых алгебраических действий.
Считалось, что сигма-связь образуется за счёт перекрывания вытянутых гибридных орбиталей (рис.1), а Пи-связь образуется за счёт перекрывания p-орбиталей (рис.2).
Однако сам Л.Полинг не был удовлетворён описанием сигма- и пи-связей. На симпозиуме по теоретической органической химии, посвящённом памяти А.Кекуле (Лондон, сентябрь 1958 г.), он раскритиковал и отказался от σ, π — описаний и предложил теорию изогнутой химической связи. Последняя теория чётко учитывала физический смысл ковалентной химической связи.
Основная характеристика сигма-связи (длина и прочность) зависит от электронной конфигурации атомов, образующих сигма-связь.
Чем больше электронное экранирование ядра атома, тем удалённее от ядра единственный валентный электрон электронной оболочки атома, тем больше длина сигма-связи и меньше её прочность.
Связанные понятия
Термин внутримолекулярный в химии описывает процесс или характеристику, свойства или явления, ограниченные в структуре одной молекулы.
Мультиферроиками (или сегнетомагнетиками в советской литературе) называют материалы, в которых сосуществуют одновременно два и более типов «ферро» упорядочения: ферромагнитное (англ. ferromagnetic), сегнетоэлектрическое (англ. ferroelectric) и сегнетоэластичность (англ. ferroelastic).
В физике полупроводников под термином сверхрешётка принято понимать твердотельную структуру, в которой помимо периодического потенциала кристаллической решётки имеется дополнительный потенциал, период которого существенно превышает постоянную решётки.
Химиия 9-11 классы. У каких органических веществ присутствует и Сигма и Пи связи?
Сигма (σ)-, пи (π)-связи — приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании π-связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. Для примера возьмем этилен, ацетилен и бензол.
В молекуле этилена С2Н4 имеется двойная связь СН2=СН2, его электронная формула: Н: С:: С: Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвертого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют π-связью.
В линейной молекуле ацетилена
имеются σ-связи между атомами углерода и водорода, одна σ-связь между двумя атомами углерода и две π-связи между этими же атомами углерода. Две π-связи расположены над сферой действия σ-связи в двух взаимно перпендикулярных плоскостях.
Все шесть атомов углерода циклической молекулы бензола С6H6 лежат в одной плоскости. Между атомами углерода в плоскости кольца действуют σ-связи; такие же связи имеются у каждого атома углерода с атомами водорода. На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвертых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные π-связи, а единая π-электронная система из шести электронов, общая для всех атомов углерода. Связи между атомами углерода в молекуле бензола совершенно одинаковые.