Почему органических веществ больше чем неорганических веществ
Разнообразие веществ. Простые и сложные, неорганические и органические вещества
Веществ существует очень много. Если химических элементов более ста, то веществ — более 10000000! Чтобы облегчить изучение и использование веществ, их разделяют на группы (классифицируют).
Какие вещества относятся к простым?
Вещества разделяют на простые и сложные. Рассмотрим примеры таких веществ: углерод, железо, кислород. Углерод образован атомами углерода. Из него изготавливают графитовые стержни карандашей. Железо, из которого сделано гвоздь, состоит из атомов железа. Эти тела, а следовательно, и вещества, из которых они образованы, вы видели не раз. Кислород мы не видим, но его недостаток чувствуем сразу. Это вещество состоит из молекул кислорода, образованных атомами кислорода.
Каждое из рассмотренных веществ образовано атомами одного химического элемента. Графит образуют атомы углерода, железо — атомы железа, кислород — атомы кислорода. Такие вещества называют простыми.
Молекулы некоторых простых веществ состоят из нескольких атомов. Например, молекула водорода состоит из двух атомов водорода, молекула кислорода — из двух атомов кислорода. Но несмотря на это, они остаются простыми веществами, так как их молекулы образовали атомы одного химического элемента.
Сложные вещества
Вещества, образованные из атомов двух и более химических элементов, называют сложными. Например, каждая молекула воды содержит два атома водорода и один атом кислорода. Ее состав обозначают записью H2O, который читается «аш-два-о».
Другим примером сложных веществ является углекислый газ. Его выдыхают все живые организмы, а растениям он нужен для питания. Молекула углекислого газа образована одним атомом углерода и двумя атомами кислорода. Этот состав молекулы отражают записью СО2, который читается «це о два».
Почему сложных веществ больше, чем простых?
Ученые доказали, что атомы различных химических элементов способны соединяться друг с другом в разном количестве и последовательности. Подобно тому, как в языке сочетанием букв образуется разнообразие слов, сочетанием различных атомов и в разном количестве образовалось более 10000000 веществ. Так что неудивительно, что сложных веществ существует гораздо больше, чем простых.
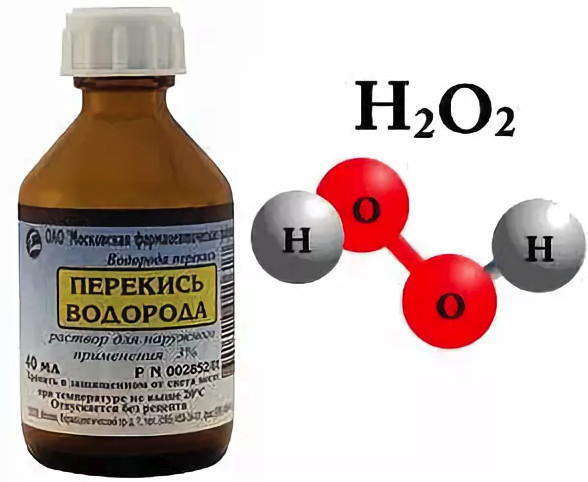
Рассмотрим еще раз рисунок и увидим, что молекула воды состоит из двух атомов водорода и одного атома кислорода. Из таких же атомов состоит и вещество водород пероксида, однако она имеет совсем другие свойства, чем вода. Например, водород пероксида имеет температуру кипения выше на 50°С, обладает обеззараживающими свойствами. Ни одна аптечка не обходится без него, ведь раствором этого вещества под названием «перекись водорода» обрабатывают раны, чтобы они быстрее заживали. Такие отличные от воды свойства перекиси водорода обусловленные различиями в строении его молекулы. Ведь молекула этого вещества состоит из двух атомов водорода и двух атомов кислорода.
Органические и неорганические вещества
Вещества разделяют также на органические и неорганические. В состав всех органических веществ входят атомы углерода и, чаще всего, водорода. Так, из них образованы природный газ, вещества в составе нефти. В составе многих органических веществ содержатся еще и атомы кислорода. Это жиры, крахмал, сахар, уксус и другие. В состав важных для живых существ белков, кроме упомянутых элементов, обязательно входит азот.
Откуда такое название — органические вещества? Все очень просто. Первые из этих веществ ученые обнаружили в организмах — телах живой природы.
Есть и исключения. Некоторые вещества, содержащие атомы углерода, относят к неорганическим. Примерами являются углекислый газ, сода и еще несколько веществ.
Все тела природы, за исключением горных пород, воздуха и воды, состоят из органических веществ. Среди них больше всего углеводов (например, глюкозы и сахарозы), жиров (например, масла), белков (например, белок куриного яйца).
Многие органические вещества человек создал сам, например пластмассы, резину, полиэтилен. Они широко используются в машино- и самолетостроении, при сооружении зданий и мостов, а также в быту.
Без атомов углерода не существует никакой органического вещества. Так, атомы углерода вместе с атомами водорода и кислорода входят в состав органического вещества сахара, или сахарозы. Причем 1 молекула сахарозы состоит из 45 атомов. Среди них 12 атомов углерода, 22 атома водорода и 11 атомов кислорода. В том, что в составе сахара содержатся атомы углерода, убеждает черный цвет при сгорания кусочка сахара. Картофель или мясо, под действием высоких температур также обугливаются, приобретая черный цвет. Это является доказательством наличия углерода в составе органических веществ продуктов питания.
Заключение
Вещества разделяют на простые и сложные. Простые вещества образуются из атомов одного химического элемента. Сложные вещества образуются из атомов различных химических элементов.
Одной из классификаций веществ является разделение их на органические и неорганические. Органические вещества обязательно содержат атомы углерода.
Белки, жиры, углеводы — жизненно необходимые человеку органические вещества.
§ 10. Классификация неорганических веществ и её относительность
Классификация природных химических веществ. Философская истина «Всё в нашем мире относительно» — справедлива и для классификации веществ и их свойств. Великое многообразие веществ во Вселенной и на нашей планете состоит всего лишь из 90 химических элементов. В природе встречаются вещества, построенные элементами с порядковыми номерами с 1-го по 91-й включительно. Элемент 43-й — технеций — в настоящее время на Земле в природе не обнаружен, так как не имеет стабильных изотопов. Он был получен искусственно в результате ядерной реакции. Отсюда и название элемента: от греческого technetos — «искусственный».
Все земные природные химические вещества, построенные из 90 элементов, можно разделить на два больших типа — неорганические и органические.
Органическими веществами называют соединения углерода, за исключением простейших — оксидов углерода, карбидов металлов, угольной кислоты и её солей; все остальные вещества относятся к неорганическим.
Органических веществ насчитывается более 27 млн — гораздо больше, чем неорганических, число которых, по самым оптимистическим подсчётам, не превышает 400 тыс. О причинах многообразия органических соединений мы поговорим чуть позже, а пока отметим, что резкой границы между двумя этими группами веществ не существует. Например, соль изоцианат аммония NH2NCO считается неорганическим соединением, мочевина (NH2)2CO, имеющая точно такой же элементный состав N2H4CO, — вещество органическое.
Вещества, имеющие одинаковую молекулярную формулу, но разное химическое строение, а потому и разные свойства, называются изомерами.
Например, формулу C2H6O имеют два химических вещества — ди-метиловый эфир и этиловый спирт.
Классификация неорганических веществ. Неорганические вещества принято делить на два подтипа — простые и сложные. Как вы уже знаете, простыми называют вещества, состоящие из атомов одного химического элемента, а сложные — из двух и более химических элементов.
Казалось бы, число простых веществ должно совпадать с числом химических элементов. Однако это не так. Дело в том, что атомы одного и того же химического элемента могут образовывать не одно, а несколько различных простых веществ. Такое явление, как вы уже знаете, называют аллотропией. Причинами аллотропии может быть разное число атомов в молекуле (например, аллотропные модификации элемента кислорода — кислород O2 и озон O3), а также различное строение кристаллической решётки твёрдого вещества (например, уже знакомые вам аллотропные видоизменения углерода — алмаз и графит).
В подтипе простых веществ выделяют металлы, неметаллы и благородные газы, причём последние часто относят к неметаллам. В основе такой классификации лежат физические свойства простых веществ, обусловленные строением атомов химических элементов, из которых эти вещества образованы, и типом кристаллической решётки. Вам известно, что металлы обладают хорошей электро- и теплопроводностью, пластичны, имеют металлический блеск. Неметаллы, как правило, такими свойствами не обладают. Наша оговорка «как правило» не случайна, она ещё раз подчёркивает относительность классификации простых веществ. Некоторые металлы по свойствам напоминают неметаллы (например, аллотропная модификация олова — серое олово является комкообразным или порошкообразным веществом серого цвета, не проводит электрический ток, лишено блеска и пластичности; рис. 42). Тогда как белое олово, другая аллотропная модификация, — типичный металл. Напротив, неметалл графит, аллотропная модификация углерода, обладает хорошей электропроводностью, характерным металлическим блеском.
Рис. 42. Олово: а — белое олово; б — алло тропная модификация — серое олово
Самая общая классификация сложных неорганических веществ хорошо вам знакома из курса химии основной школы. Здесь выделяют четыре класса соединений: оксиды, основания, кислоты и соли.
Деление неорганических веществ на классы проводят на основании их состава, который, в свою очередь, отражается на свойствах соединений.
Основания — сложные вещества, состоящие из атома металла и одной или нескольких гидроксогрупп (например, NaOH, Ca(OH)2).
Кислоты — сложные вещества, состоящие из атомов водорода и кислотного остатка (например, HCl, HNO3, H2SO4, H3PO4).
Соли — сложные вещества, состоящие из атомов металла и кислотных остатков (например, NaNO3, K2SO4, AlCl3).
Вот так на схеме выглядит классификация неорганических веществ.
Но подобная классификация и определения также весьма относительны.
Во-первых, роль металла в основаниях и солях могут выполнять сложные частицы наподобие знакомого вам катиона аммония NH4+, построенные элементами-неметаллами.
Во-вторых, существует достаточно многочисленная группа веществ, которые по формальным признакам (по составу) являются основаниями, а по свойствам относятся к амфотерным гидроксидам, т. е. сочетают свойства оснований и кислот. Например, гидроксид алюминия Al(OH)3 при взаимодействии с кислотой ведёт себя как основание:
а при сплавлении с щелочами проявляет свойства кислоты:
В-третьих, в приведённую выше классификацию сложных неорганических веществ не попадёт большое число соединений, которые нельзя отнести ни к одному из перечисленных классов. Это, например, соединения, образованные двумя или более элементами-неметаллами (хлорид фосфора (V) PCl5, сульфид углерода CS2, фосген COCl2).
Как классифицируют органические вещества, будет рассказано в следующем параграфе.
Теперь вы знаете
Теперь вы можете
Выполните задания
Видишь мрамор? Это просто кальций.
Химия. Породистый кристалл.
Но коснулись этой глыбы пальцы,
И Венерой вышла красота.
Какую неточность с точки зрения химии допустил поэт?
Разница между органической и неорганической пищей
Органические и неорганические продукты питания Органические и неорганические продукты питания долгое время были предметом споров, особенно среди диетологов и медицинских работников. Органические прод
Содержание:
Органические и неорганические продукты питания
Органические и неорганические продукты питания долгое время были предметом споров, особенно среди диетологов и медицинских работников. Органические продукты питания и органические продукты почему-то становятся все более популярными в наши дни. Люди каким-то образом стали более заботиться о своем здоровье и начали покупать экологически чистые продукты и продукты.
Органическая еда
Неорганическая еда
С другой стороны, неорганические продукты питания потребляются более чем 50% населения. Неорганические фермы используют традиционные методы ведения сельского хозяйства и химикаты в качестве удобрений и пестицидов. Боязнь людей, заботящихся о своем здоровье, заключается в том, что употребление неорганических продуктов питания может привести к употреблению потенциально опасных химикатов. С точки зрения стоимости, неорганические продукты питания связаны с множеством скрытых расходов, таких как налоги и любые затраты, которые могли бы понести фермеры.
Разница между органической и неорганической пищей
Вкус как органических, так и неорганических продуктов является спорным, поскольку нет двух людей, обладающих одинаковым вкусом. Однако выбор между ними будет полностью зависеть от того, насколько человек заботится о своем здоровье. Агентства пытались регулировать химические вещества, используемые в неорганических продуктах питания, чтобы сделать их безопасными для потребления человеком.
Вкратце:
• На органической ферме не используются гормоны для птицы, в отличие от неорганической.
3.1. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах.
Органическая химия — раздел химии, в котором изучают соединения углерода, их строение, свойства, взаимопревращения.
Само название дисциплины — «органическая химия» — возникло достаточно давно. Причина его кроется в том, что большинство соединений углерода, с которыми сталкивались исследователи на начальном этапе становления химической науки, имели растительное или животное происхождение. Тем не менее, в порядке исключения, отдельные соединения углерода относят к неорганическим. Так, например, неорганическими веществами принято считать оксиды углерода, угольную кислоту, карбонаты, гидрокарбонаты, циановодород и некоторые другие.
В настоящее время известно чуть менее 30-ти миллионов разнообразных органических веществ и этот список непрерывно пополняется. Такое огромное число органических соединений связано, прежде всего, со следующими специфическими свойствами углерода:
1) атомы углерода могут соединяться друг с другом в цепи произвольной длины;
2) возможно не только последовательное (линейное) соединение атомов углерода между собой, но также разветвленное и даже циклическое;
3) возможны разные виды связей между атомами углерода, а именно одинарные, двойные и тройные. При этом валентность углерода в органических соединениях всегда равна четырем.
Помимо этого, большому разнообразию органических соединений способствует также и то, что атомы углерода способны образовывать связи и с атомами многих других химических элементов, например, водородом, кислородом, азотом, фосфором, серой, галогенами. При этом водород, кислород и азот встречаются наиболее часто.
Следует отметить, что довольно долго органическая химия представляла для ученых «темный лес». Какое-то время в науке даже была популярна теория витализма, согласно которой органические вещества не могут быть получены «искусственным» способом, т.е. вне живой материи. Однако теория витализма просуществовала не очень долго, ввиду того что одно за одним обнаруживались вещества, синтез которых возможен вне живых организмов.
У исследователей вызывало недоумение то, что многие органические вещества имеют одинаковый качественный и количественный состав, однако часто обладают совершенно непохожими друг на друга физическими и химическими свойствами. Так, например, диметиловый эфир и этиловый спирт имеют абсолютно одинаковый элементный состав, однако диметиловый эфир в обычных условиях представляет собой газ, а этиловый спирт – жидкость. Кроме того, диметиловый эфир с натрием не реагирует, а этиловый спирт взаимодействует с ним, выделяя газообразный водород.
Исследователями XIX века было выдвинуто множество предположений касательно того, как все-таки устроены органические вещества. Существенно важные предположения были выдвинуты немецким ученым Ф.А.Кекуле, который первый высказал идею о том, что атомы разных химических элементов имеют конкретные значения валентностей, а атомы углерода в органических соединениях четырехвалентны и способны объединяться друг с другом, образуя цепи. Позднее, отталкиваясь от предположений Кекуле, российский ученый Александр Михайлович Бутлеров разработал теорию строения органических соединений, которая не потеряла свою актуальность и в наше время. Рассмотрим основные положения этой теории:
1) все атомы в молекулах органических веществ соединены друг с другом в определенной последовательности в соответствии с их валентностью. Атомы углерода имеют постоянную валентность, равную четырем, и могут образовывать друг с другом цепи различного строения;
2) физические и химические свойства любого органического вещества зависят не только от состава его молекул, но также и от порядка соединения атомов в этой молекуле между собой;
3) отдельные атомы, а также группы атомов в молекуле оказывают влияние друг на друга. Такое взаимное влияние отражается в физических и химических свойствах соединений;
4) исследуя физические и химические свойства органического соединения можно установить его строение. Верно также обратное – зная строение молекулы того или иного вещества, можно спрогнозировать его свойства.
Аналогично тому, как периодический закон Д.И.Менделева стал научным фундаментом неорганической химии, теория строения органических веществ А.М. Бутлерова фактически стала отправной точкой в становлении органической химии как науки. Следует отметить, что после создания теории строения Бутлерова органическая химия начала свое развитие очень быстрыми темпами.
Изомерия и гомология
Согласно второму положению теории Бутлерова, свойства органических веществ зависят не только от качественного и количественного состава молекул, но и от порядка соединения атомов в этих молекулах между собой.
В связи с этим, среди органических веществ широко распространено такое явление как изомерия.
Изомерия – явление, когда разные вещества имеют абсолютно одинаковый состав молекул, т.е. одинаковую молекулярную формулу.
Очень часто изомеры сильно отличаются по физическим и химическим свойствам. Например:
Типы изомерии
Структурная изомерия
а) Изомерия углеродного скелета
б) Изомерия положения:
в) Межклассовая изомерия:
Межклассовая изомерия имеет место, когда соединения, являющиеся изомерами, относятся к разным классам органических соединений.
Пространственная изомерия
Пространственная изомерия — явление, когда разные вещества при одинаковом порядке присоединения атомов друг к другу отличаются друг от друга фиксировано-различным положением атомов или групп атомов в пространстве.
Существует два типа пространственной изомерии – геометрическая и оптическая. Задания на оптическую изомерию на ЕГЭ не встречаются, поэтому рассмотрим только геометрическую.
Если в молекуле какого-либо соединения есть двойная C=C связь или цикл, иногда в таких случаях возможно явление геометрической или цис-транс-изомерии.
Например, такой вид изомерии возможен для бутена-2. Смысл ее заключается в том, что двойная связь между атомами углерода фактически имеет плоское строение, а заместители при этих атомах углерода могут фиксированно располагаться либо над, либо под этой плоскостью:
Когда одинаковые заместители находятся по одну сторону плоскости говорят, что это цис-изомер, а когда по разные — транс-изомер.
На в виде структурных формул цис- и транс-изомеры (на примере бутена-2) изображают следующим образом:
Отметим, что геометрическая изомерия невозможна в случае, если хотя бы у одного атома углерода при двойной связи будет два одинаковых заместителя. Так, например, цис-транс-изомерия невозможна для пропена:

Как можно видеть из иллюстрации выше, если поменять местами метильный радикал и атом водорода, находящиеся при втором углеродном атоме, по разные стороны плоскости, мы получим ту же самую молекулу, на которую просто посмотрели с другой стороны.
Влияние атомов и групп атомов друг на друга в молекулах органических соединений
Понятие о химической структуре как о последовательности связанных друг с другом атомов было существенно расширено с появлением электронной теории. С позиций данной теории можно объяснить, каким образом атомы и группы атомов в молекуле оказывают влияние друг на друга.
Различают два возможных способа влияния одних участков молекулы на другие:
1) Индуктивный эффект
2) Мезомерный эффект
Индуктивный эффект
Для демонстрации данного явления возьмем для примера молекулу 1-хлорпропана (CH3CH2CH2Cl). Связь между атомами углерода и хлора является полярной, поскольку хлор имеет намного более высокую электроотрицательность по сравнению с углеродом. В результате смещения электронной плотности от атома углерода к атому хлора на атоме углерода формируется частичный положительный заряд (δ+), а на атоме хлора — частичный отрицательный (δ-):
Смещение электронной плотности от одного атома к другому часто обозначают стрелкой, направленной к более электроотрицательному атому:
Однако, интересным является такой момент, что, кроме смещения электронной плотности от первого атома углерода к атому хлора, также имеет место смещение, но в несколько меньшей степени от второго атома углерода к первому, а также от третьего ко второму:
Такое смещение электронной плотности по цепи σ-связей называют индуктивным эффектом (I). Данный эффект затухает по мере удаления от влияющей группы и уже практически не проявляется после 3 σ-связей.
В случае, когда атом или группа атомов обладают большей электроотрицательностью по сравнению с атомами углерода, говорят, что такие заместители обладают отрицательным индуктивным эффектом (-I). Таким образом, в рассмотренном выше примере отрицательным индуктивным эффектом обладает атом хлора. Кроме хлора, отрицательным индуктивным эффектом обладают следующие заместители:
Если электроотрицательность атома или группы атомов меньше электроотрицательности атома углерода, фактически происходит передача электронной плотности от таких заместителей к углеродным атомам. В таком случае говорят, что заместитель обладает положительным индуктивным эффектом (+I) (является электронодонорным).
Так, заместителями с +I-эффектом являются предельные углеводородные радикалы. При этом выраженность +I-эффекта возрастает с удлинением углеводородного радикала:
Мезомерный эффект (М), или эффект сопряжения, — влияние заместителя, передаваемое по системе сопряженных π-связей.
Отрицательным мезомерным эффектом (–М) обладают заместители, оттягивающие электронную плотность от сопряженной системы, при этом электронная плотность в системе уменьшается.
Отрицательным мезомерным эффектом обладают группы:
За счет перераспределения электронной плотности за счет мезомерного и индуктивного эффектов в молекуле на некоторых атомах появляются частичные положительные или отрицательные заряды, что имеет отражение в химических свойствах вещества.
Графически мезомерный эффект показывают изогнутой стрелкой, которая начинается в центре электронной плотности и завершается там, куда смещается электронная плотность. Так, например, в молекуле хлористого винила мезомерный эффект возникает при сопряжении неподеленной электронной пары атома хлора, с электронами π-связи между углеродными атомами. Таким образом, в результате этого на атоме хлора появляется частичный положительный заряд, а обладающее подвижностью π-электронное облако под воздействием электронной пары смещается в сторону крайнего атома углерода, на котором возникает вследствие этого частичный отрицательный заряд:
Если в молекуле имеются чередующиеся одинарные и двойные связи, то говорят, что молекула содержит сопряженную π-электронную систему. Интересным свойством такой системы является то, что мезомерный эффект в ней не затухает.