Операция гартмана на сигмовидной кишке
Операция гартмана на сигмовидной кишке
Операция гартмана на сигмовидной кишке
Показания, этапы и техника операции Гартмана с наложением сигмостомы
а) Показания для операции Гартмана с сигмостомией:
— Плановые: после ампутации или обструктивной резекции прямой кишки.
— Альтернативные операции: реанастомоз после резекции в области дистального сегмента толстой кишки и отводящая петлевая трансверзостомия.
б) Предоперационная подготовка:
— Предоперационные исследования: зависят от заболевания: исключите дополнительные патологические образования в проксимальном сегменте толстой кишки или, при злокачественной опухоли, ее внекишечное распространение; эндоскопия с биопсией, ультразвуковое исследование, компьютерная томография, возможна внутривенная пиелография.
— Подготовка пациента: выполните ортоградный лаваж толстой кишки после исключения выраженного стеноза, отметьте место стомы и согласуйте его с пациентом в положении стоя и лежа на спине; объясните, что такое стома (возможно направление к врачу-энтеростомисту); проведите периоперационную антибиотикотерапию.
в) Специфические риски, сформированное согласие пациента:
— Зависят от основного заболевания, особое внимание должно быть уделено стоме
— Пролапс (5-15% случаев)
— Ишемия (5-15% случаев)
— Стеноз (2-10% случаев) и втяжение стомы
— Кровотечение из области стомы (менее 10% случаев)
— Парастомальная грыжа (5-15% случаев)
— Повреждение кожи вокруг стомы (10-40% случаев)
г) Обезболивание. Общее обезболивание (интубация).
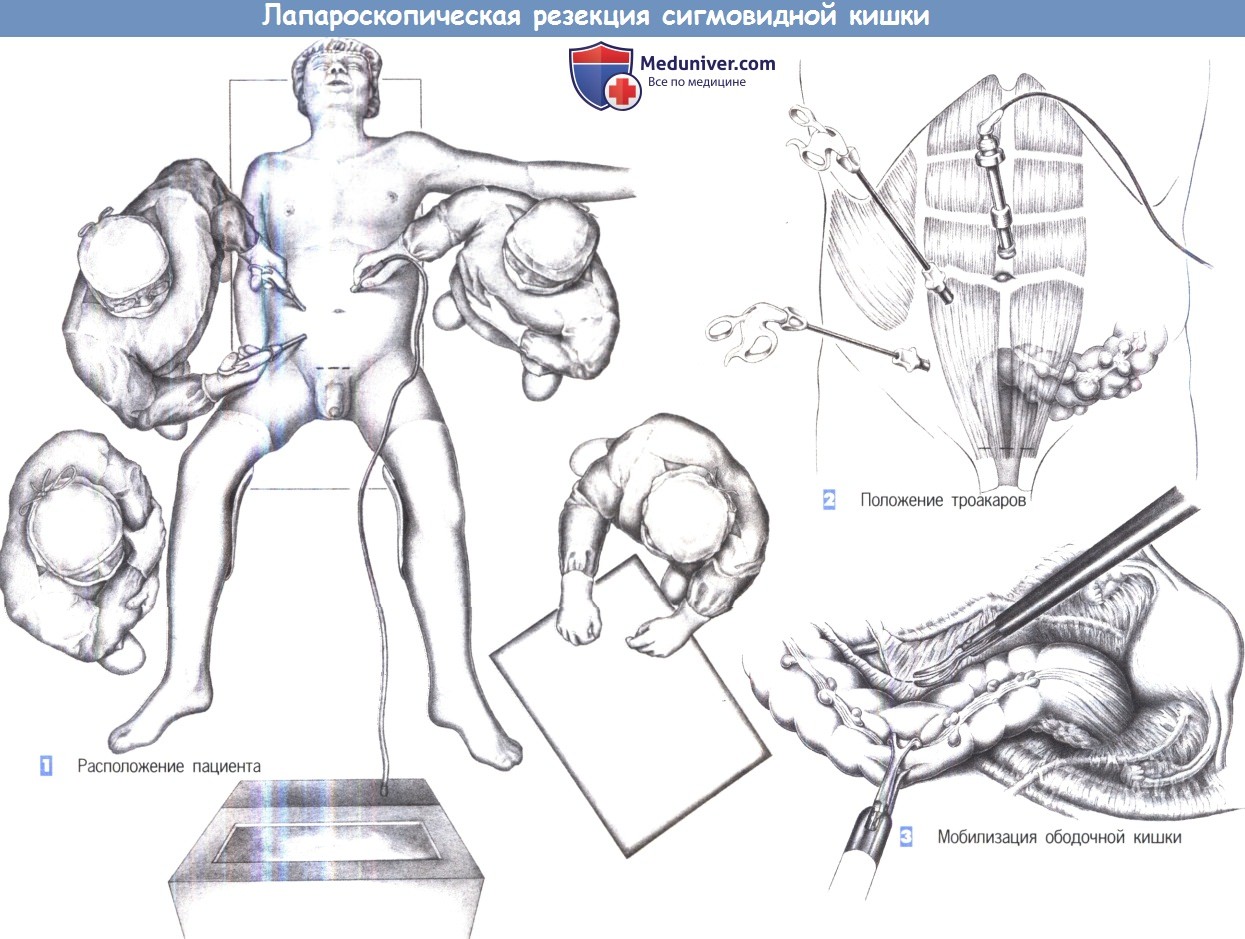
д) Положение пациента. Лежа на спине, литотомическое положение.
е) Оперативный доступ при операции Гартмана с сигмостомией. Срединная лапаротомия, возможно косое продолжение разреза выше пупка к левому подреберному краю. Возможна лапароскопическая операция из трех-четырех троакаров.
з) Анатомические особенности, серьезные риски, оперативные приемы:
— Отверстие для стомы в области прямой мышцы живота должно быть достаточно широким, чтобы вместить сигмовидную кишку вместе с необходимой порцией брыжейки ободочной кишки.
Предупреждение: избегайте перекрута сигмовидной кишки при ее выведении через брюшную стенку.
— Стома не должна иметь натяжения на уровне кожи; оставьте некоторый «запас длины», чтобы избежать отрыва стомы вследствие растяжения брюшной стенки.
и) Меры при специфических осложнениях. Осложнения стомы: оптимизируйте уход за стомой, при показаниях выполните повторную операцию и рассмотрите возможность реимплантации стомы или ее перемещения в другое место.
л) Этапы и техника операции Гартмана с сигмостомией:
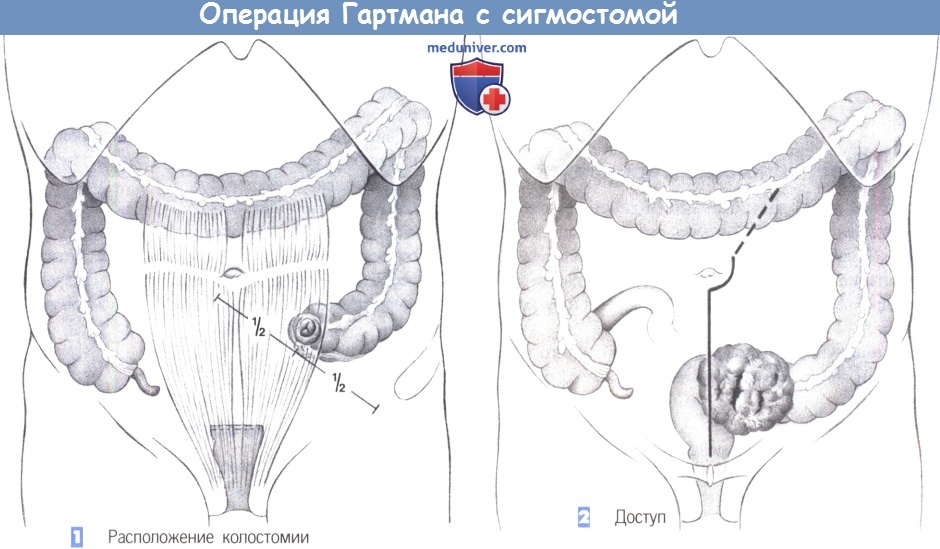
1. Расположение колостомии
2. Доступ
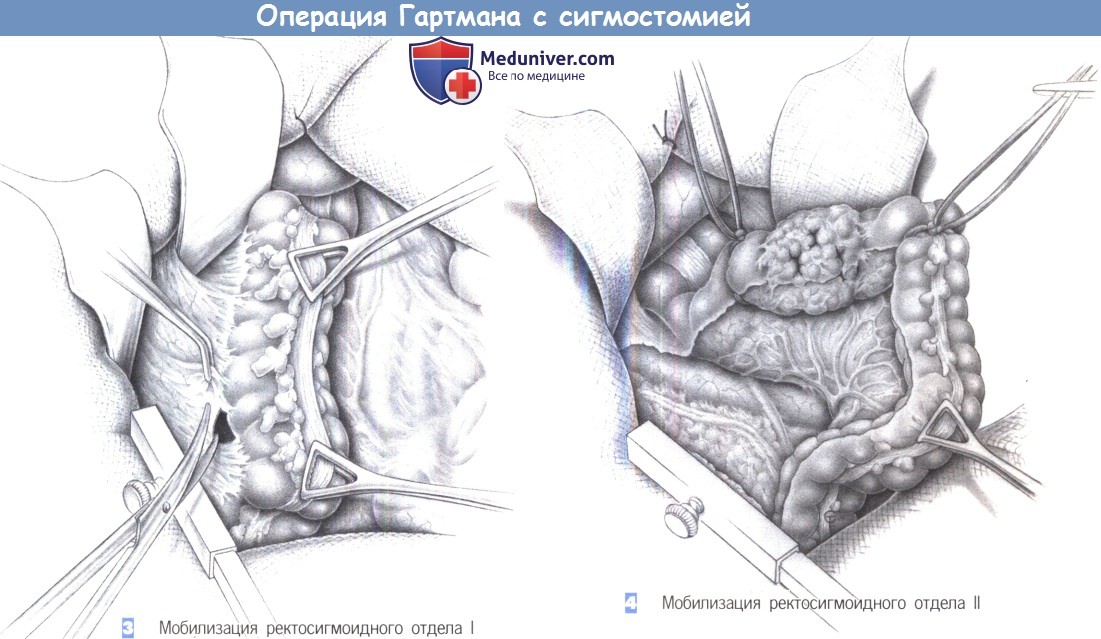
3. Мобилизация ректосигмоидного отдела I
4. Мобилизация ректосигмоидного отдела II
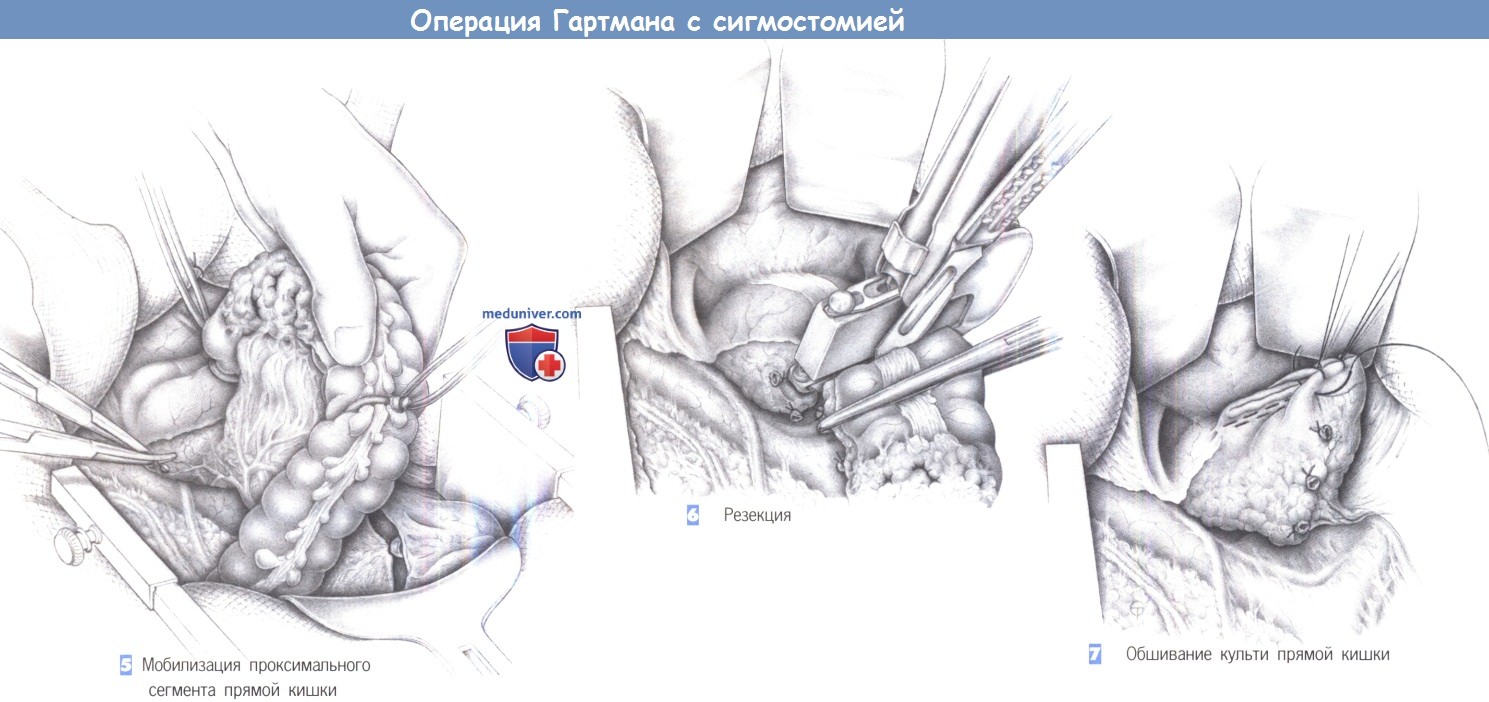
5. Мобилизация проксимального сегмента прямой кишки
6. Резекция
7. Обшивание культи прямой кишки
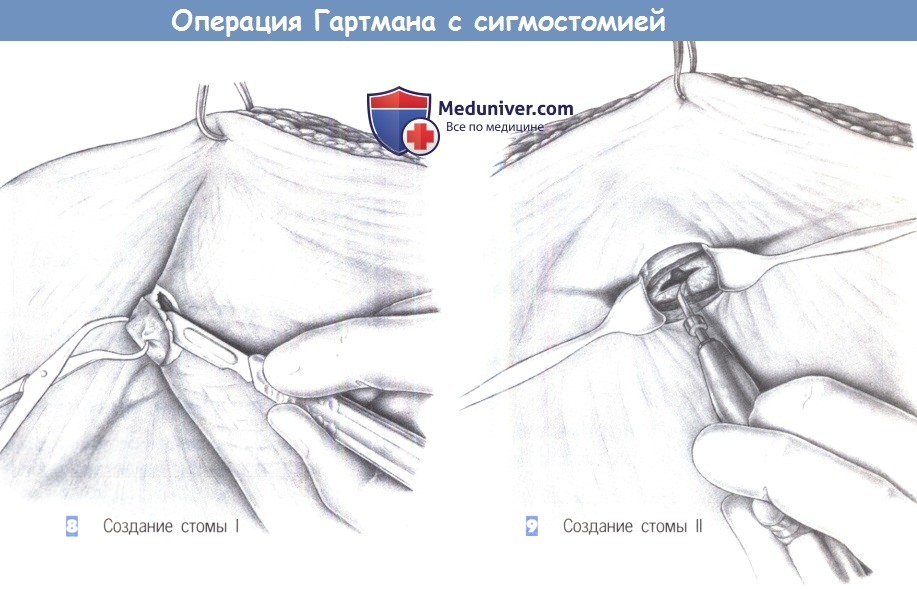
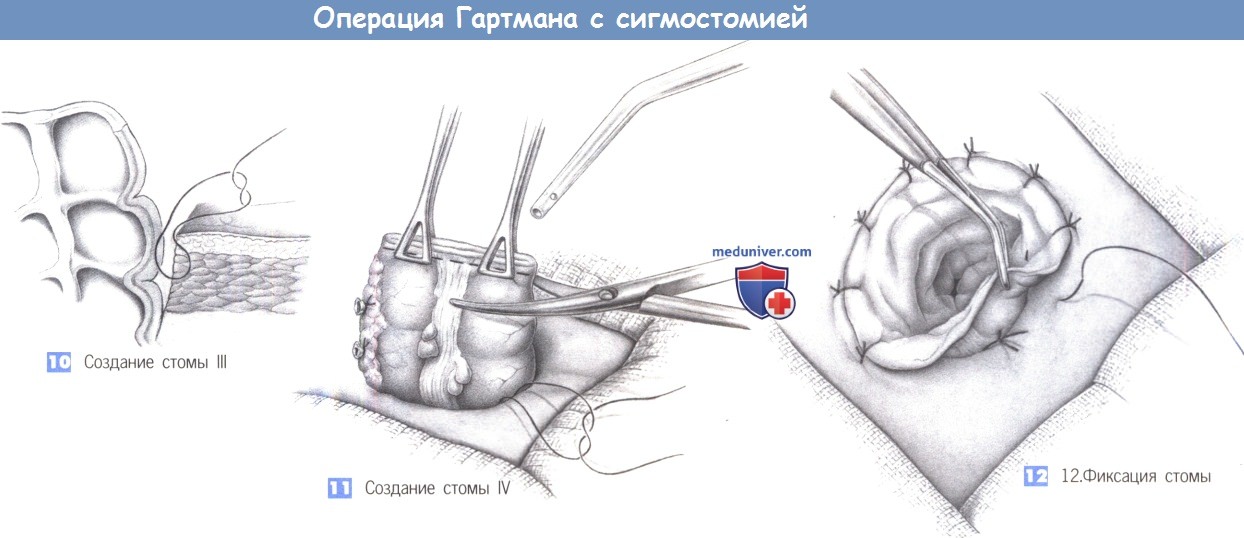
8. Создание стомы I
9. Создание стомы II
10. Создание стомы III
11. Создание стомы IV
12. Фиксация стомы
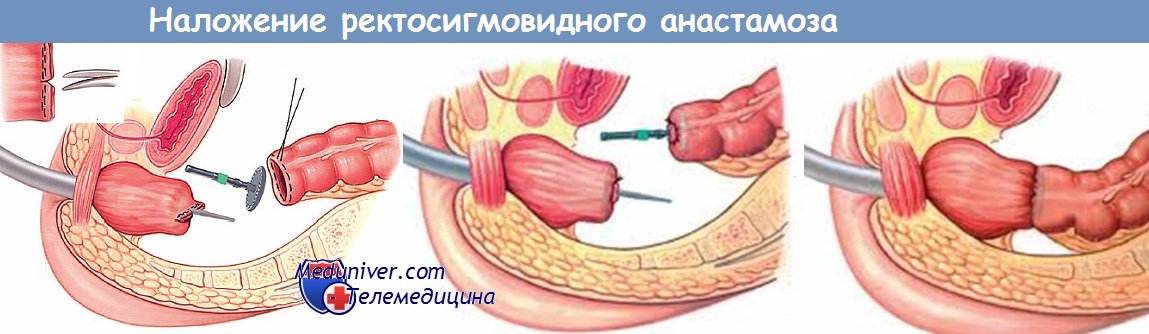
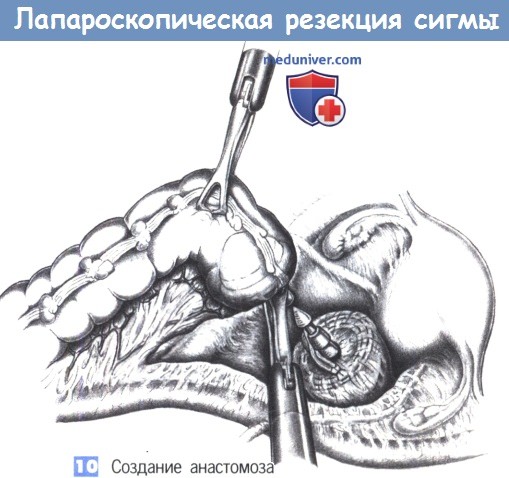
1. Расположение колостомии. Резекция толстой кишки по Гартману без последующего восстановления ее непрерывности показана при опухолях сигмовидной и прямой кишки. Это вмешательство выполняется как предварительная операция при воспалительных заболеваниях и опухолях, а также в качестве окончательной меры при нерезектабельных опухолях, расположенных в полости малого таза. Принцип операции состоит в создании концевой сигмостомии и слепом ушивании культи прямой кишки.
Даже если операция Гартмана является временной мерой, стому необходимо сформировать должным образом. Сигмостомия всегда должна создаваться трансмускулярно, в области наружной части прямой мышцы живота. Наилучшее расположение стомы лучше всего определяется в положении пациента стоя. В принципе, это место находится на средней трети линии, соединяющей пупок с передневерхней остью подвздошной кости.
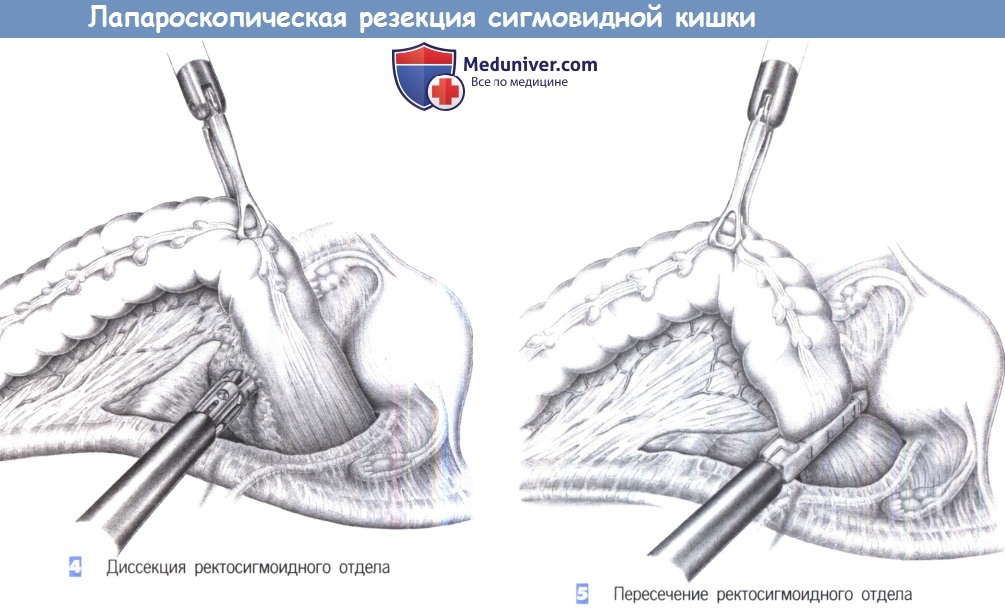
3. Мобилизация ректосигмоидного отдела I. После вскрытия брюшной полости и введения крючков, сигмовидная кишка освобождается от ее боковых прикреплений. Эффективна осторожная тракция сигмовидной ободочной кишки при помощи зажимов Дюваля или даже вручную. Чтобы избежать повреждения мочеточника, диссекция должна проводиться непосредственно у стенки кишки. Для гарантии безопасности левого мочеточника необходима его идентифицикация.
4. Мобилизация ректосигмоидного отдела II. Полная мобилизация сигмовидной кишки требует отделения воспалительного инфильтрата или опухоли от боковой стенки живота. Если возможно, кишку следует обойти петлей непосредственно проксимальнее опухоли. Разделение боковых прикреплений продолжается, пока не будет достигнута свободная часть проксимального сегмента прямой кишки. Мочеточник можно обнаружить там, где он забрюшинно пересекает подвздошные сосуды вместе с семенными/яичниковыми сосудами.
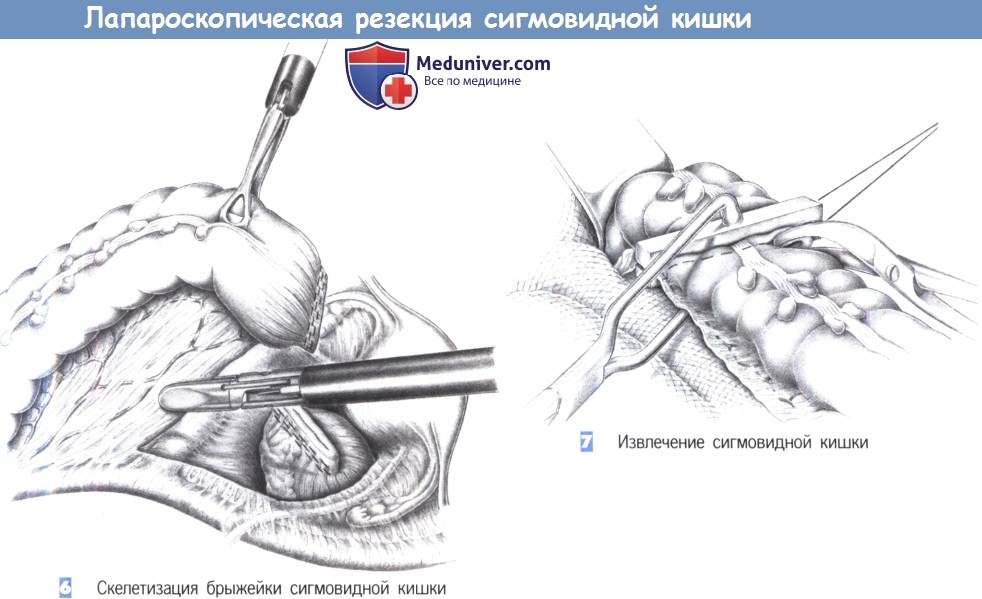
5. Мобилизация проксимального сегмента прямой кишки. Мобилизацию часто необходимо продолжить вниз в полость таза, чтобы адекватно освободить прямую кишку от ее забрюшинных сращений. Этим можно достичь достаточной длины кишки для ее безопасного закрытия в здоровом сегменте. Мезоректум пересекается между зажимами Оверхольта и перевязывается с прошиванием (3-0 PGA).
6. Резекция. После мобилизации прямой кишки и скелетирования мезоректум кишка пересекается. Это можно сделать открытым способом между швами-держалками с закрытием кишки отдельными швами. Мы предпочитаем резекцию с использованием сшивающего аппарата ТА-55. Он используется дважды: первый раз в области проксимального, а затем, как показано на рисунке, в области дистального края резекции. Просвет резецируемой кишки закрывается с обеих сторон с зажимами Кохера.
7. Обшивание культи прямой кишки. Линия скобок на слепо закрытой культе прямой кишки обшивается через край отдельными швами (3-0 PGA). Область мезоректум еще раз проверяется на гемостаз. Затем таким же образом, как при ампутации прямой кишки формируется концевая сигмостомия.
8. Создание стомы I. После натягивания брюшной стенки зажимом для операционного белья, удерживающим край раны, в размеченном до операции месте выполняется круговой разрез. Здесь также полезно использовать зажим для операционного белья. Подкожная ткань разделяется режущей диатермией и выделяется передний листок апоневроза прямой мышцы.
9. Создание стомы II. Апоневроз рассекается крестовидно, мышца тупо раздвигается и разводится крючками. В глубине обнаруживается брюшина, которая также рассекается крестовидно. Отверстие должно свободно вмещать не менее двух пальцев.
10. Создание стомы III. Конец кишки, который был закрыт скобками, проводится через отверстие для стомы и может быть предварительно зафиксирован на уровне кожи отдельным швом, чтобы предотвратить его втяжение в брюшную полость. Чтобы избежать формирования внутренней грыжи, отверстие между латеральной брюшиной и кишкой закрывается изнутри живота кисетным швом.
11. Создание стомы IV. Резекция линии скобок открывает просвет кишки, который очищается тампоном, смоченным поливидон йодином. Кишечное отделяемое немедленно аспирируется.
12. Фиксация стомы. Стома фиксируется отдельными кожно-слизистыми швами (3-0 PGA). Она не должна кровоточить, но должна сохранять жизнеспособность (то есть, слизистая оболочка должна иметь розовую окраску). Мертвенно бледное изменение цвета неизбежно требует дальнейшей резекции кишки до здоровой ткани и реконструкции стомы. Операция заканчивается наложением калоприемника.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Резекция сигмовидной кишки
Резекция сигмовидной кишки (сигмоидэктомия) – это радикальное оперативное вмешательство, которое предполагает удаление части или всей сигмовидной кишки. Объем удаления определяется тяжестью патологии, являющейся показанием к операции. Если поражение сигмовидной кишки носит доброкачественный характер и в патологический процесс вовлечен довольно ограниченный участок, то представляется возможным сохранить большую часть органа. В таком случае ход операции предполагает иссечение небольшого фрагмента кишечной трубки.
Показания
Существует целый ряд патологий, для лечения которых возникает необходимость проведения этого оперативного вмешательства:
Противопоказания
Противопоказания для проведения сигмоидэктомии:
Подготовка
Правильное проведение подготовки к операции значительно уменьшает риск развития осложнений и сокращает сроки реабилитации:
Техника проведения
Резекция может быть выполнена разными способами:
Существует несколько различных способов восстановления пассажа кишечного содержимого:
Вид, методику и объем оперативного вмешательства определяет лечащий врач, учитывая тип патологии, её объем и степень поражения кишечника. Также от способа операции будет зависеть цена за предоставление данной услуги.
Этапы оперативного вмешательства:
Если резекция проводилась по поводу злокачественного заболевания, то операция дополняется химиотерапией и лучевыми методами лечения.
Реабилитационный период
Темпы восстановления после операции зависят от объема произведенного вмешательства и общего состояния организма. Также на сроки реабилитации влияет соблюдение пациентом лечебно-охранительного режима.
Первые сутки послеоперационного периода пациент находится в палате интенсивной терапии. Проводится антибактериальная, противовоспалительная и анальгезирующая медикаментозная терапия. По показаниям могут вводиться химиотерапевтические препараты.
Диета после резекции:
Для ускорения реабилитации пациентам рекомендуются занятия лечебной физической культурой. Объем и вид упражнений врач-физиотерапевт подбирает индивидуально для каждого пациента.
Возможные осложнения
Сигмоидэктомия – серьезное оперативное вмешательство. Однако при правильном выполнении операции квалифицированными хирургами и соблюдении пациентом всех рекомендаций возможно достижение хорошего качества жизни больного после резекции.
Операция гартмана на сигмовидной кишке
Методика резекции сигмовидной кишки
а) Место проведения. Стационар, операционная.
б) Альтернатива:
• Лапароскопический доступ.
• Интраоперационный лаваж кишки с первичным анастомозом.
• Эндоскопическая установка стента при подготовке к плановой операции.
в) Показания:
• Рак, дивертикулит, заворот сигмовидной кишки, выпадение прямой кишки.
• Толстокишечная непроходимость.
г) Подготовка:
• Полное обследование толстой кишки во всех плановых случаях, желательна маркировка (татуаж) мелких новообразований.
• Механическая подготовка кишки (традиционно) или без подготовки (развивающаяся концепция).
• Установка мочеточниковых стентов в случаях повторных операций или выраженных анатомических изменений (например, при воспалении).
• Маркировка места наложения стомы.
• Антибиотикопрофилактика.
д) Этапы операции резекции сигмовидной кишки:
1. Положение пациента: модифицированное положение для промежностного камнесечения.
2. Лапаротомия: нижнесрединная, поперечная надлобковая (с пересечением прямых мышц), по Пфанненштилю (поперечное рассечение кожи и апоневроза с разведением прямых мышц живота).
3. Установка абдоминального ранорасширителя для экспозиции левых отделов ободочной кишки.
4. Ревизия брюшной полости: местная резектабельность, вторичные изменения (печень/желчный пузырь, тонкая/толстая кишка, женские половые органы).
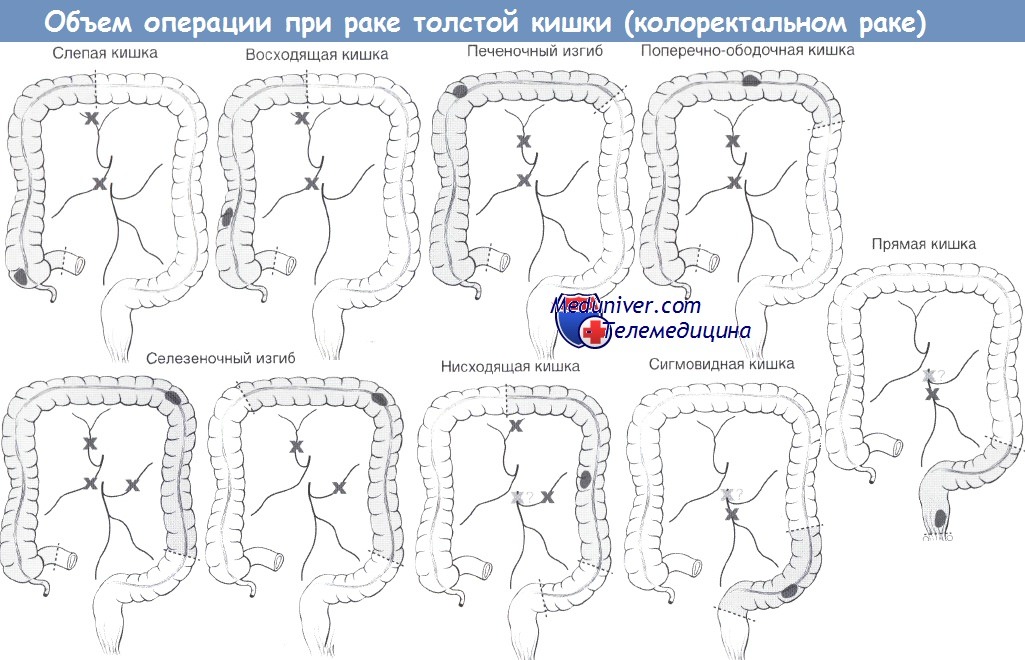
5. Определение границ резекции:
а. Дистальная: по меньшей мере, верхнеампулярный отдел прямой кишки (слияние тений).
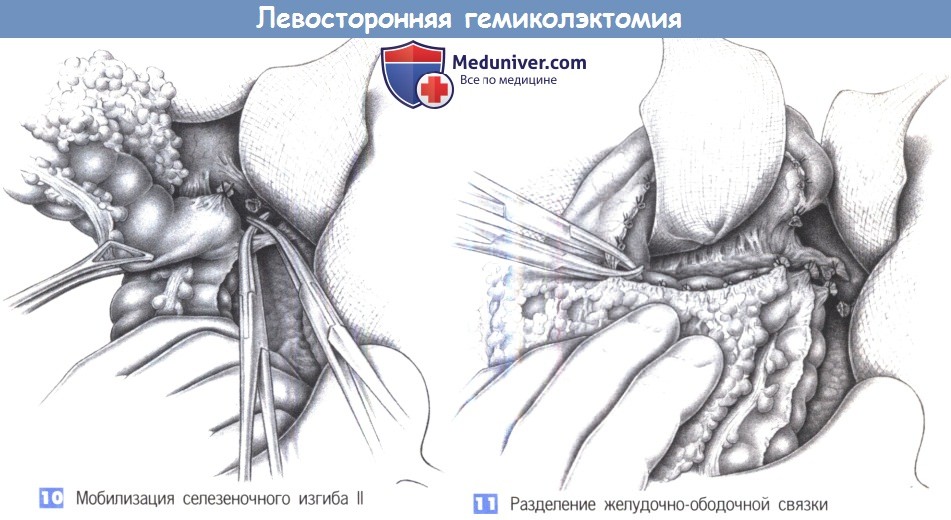
б. Проксимальная: онкологическая граница, неизмененная стенка кишки (не обязательно свободная от дивертикулов).
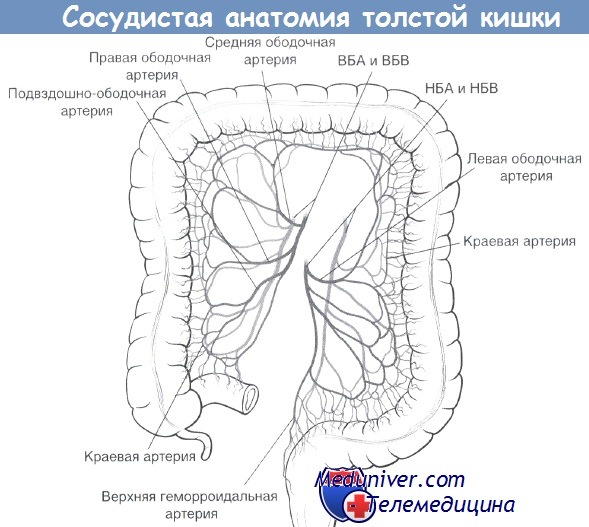
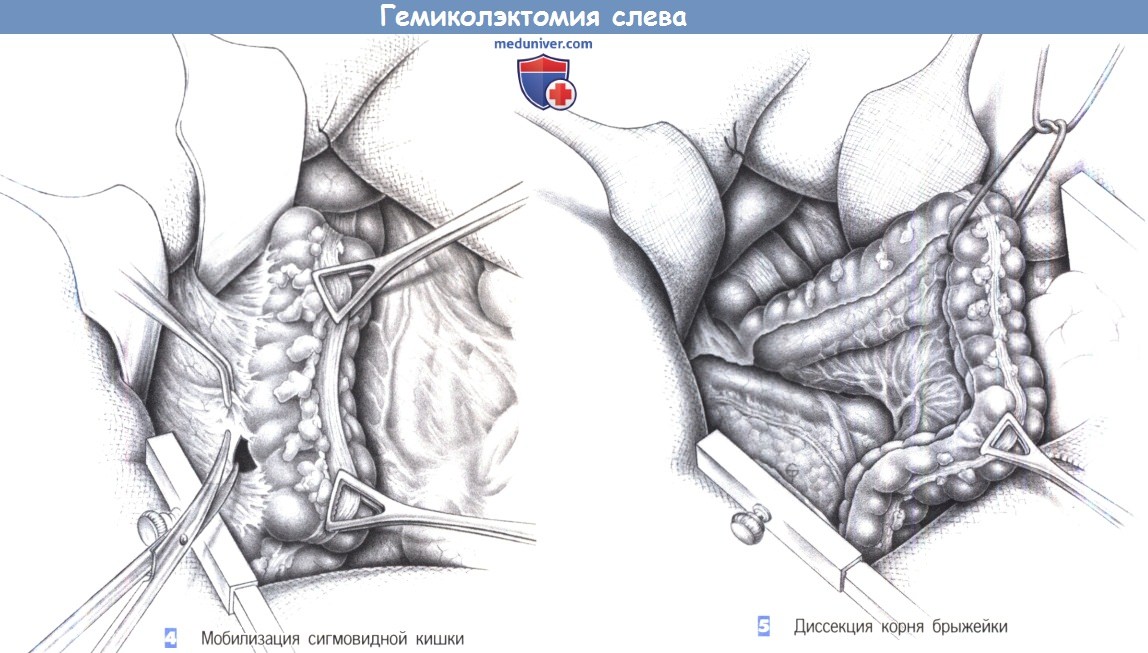
6. Ретроградная диссекция от сигмовидной кишки к селезеночному изгибу вдоль белой линии Тольдта. Вход в забрюшинное пространство, выполненное рыхлой соединительной тканью. Тупое отделение брыжейки сигмовидной кишки от забрюшинных тканей, идентификация левого мочеточника. Разрез брюшины продолжается на таз.
7. Определение нижнебрыжеечных сосудов. Формирование окна в брыжейке позади сосудистой ножки. Идентификация гипогастрального нерва и его сохранение путем оттеснения кзади. Диссекция жировой ткани, окружающей сосудистую ножку, под контролем зрения.
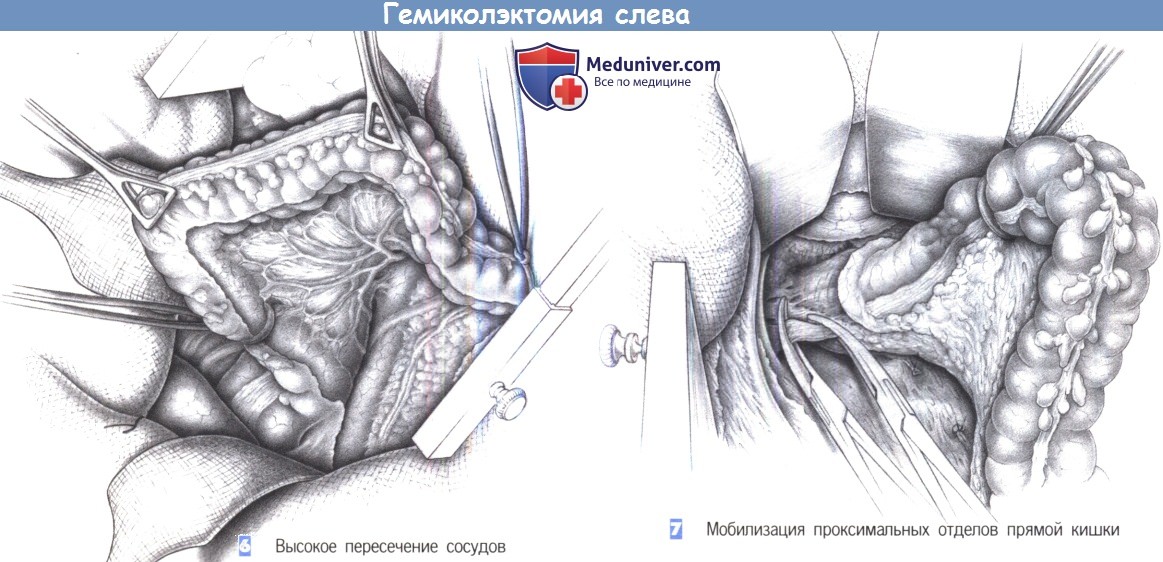
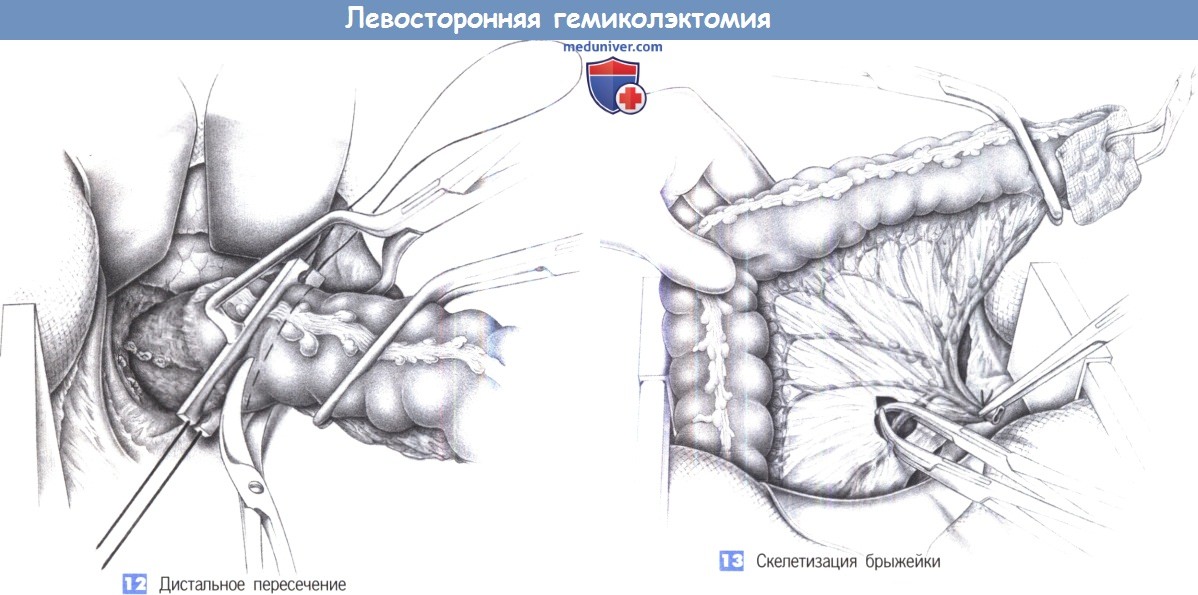
9. Поэтапное пересечение брыжейки между зажимами с перевязкой до проксимальной границы резекции.
10. Тупое выделение позади сосудистой ножки (аваскулярный слой) до входа в малый таз. В случаях выпадения прямой кишки: полная мобилизация по задней полуокружности вдоль фасции Вальдеера до тазового дна.
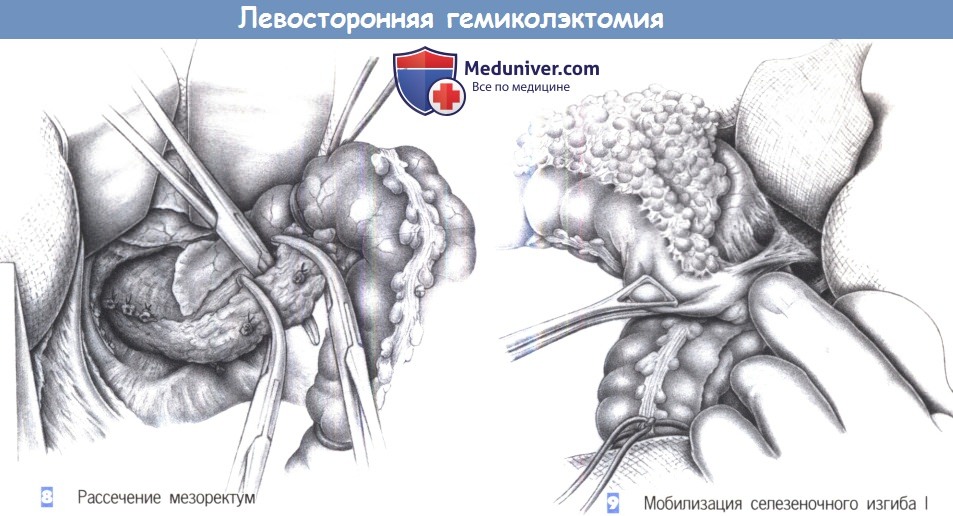
11. Формирование окна в мезоректум у дистальной точки резекции (см. выше). Пересечение кишки с помощью линейных степлеров. Пересечение и перевязка мезоректум между зажимами.
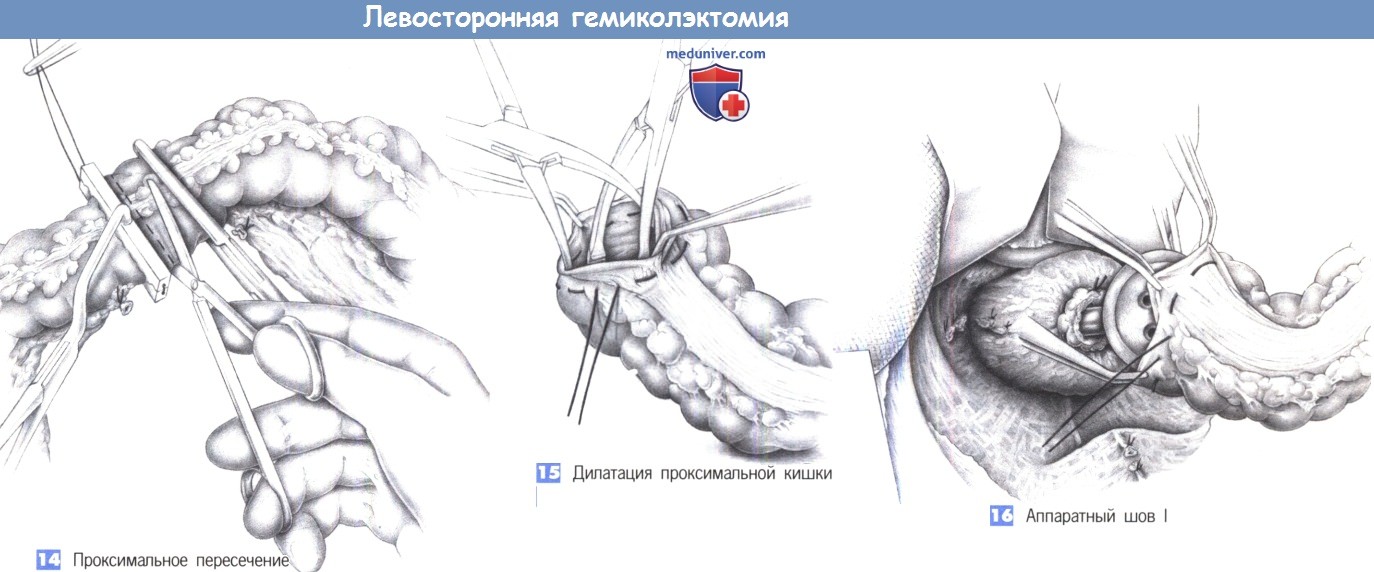
12. Пересечение кишки с помощью линейных степлеров.
13. Удаление препарата и макроскопическое исследование патоморфологом и/или хирургом.
А) Реконструкция с формированием первичного анастомоза:
а. Анастомоз:
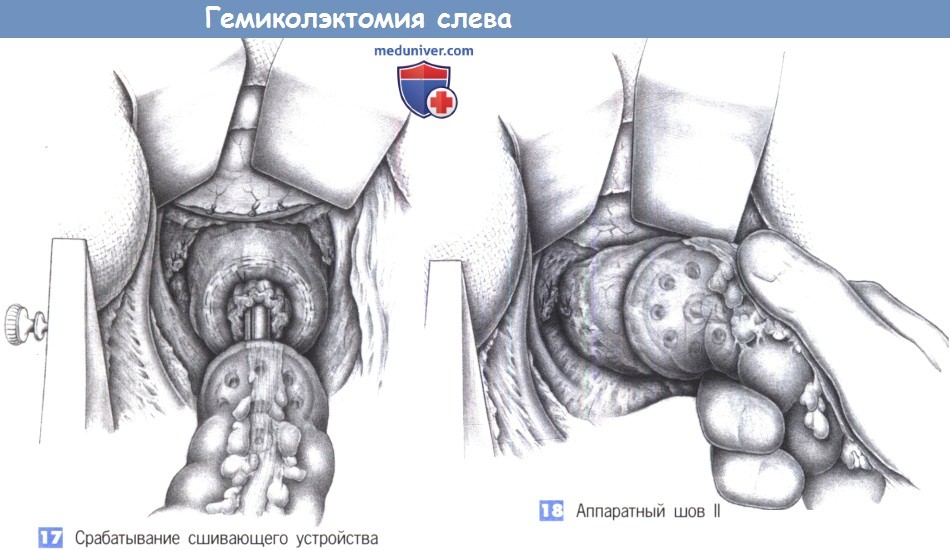
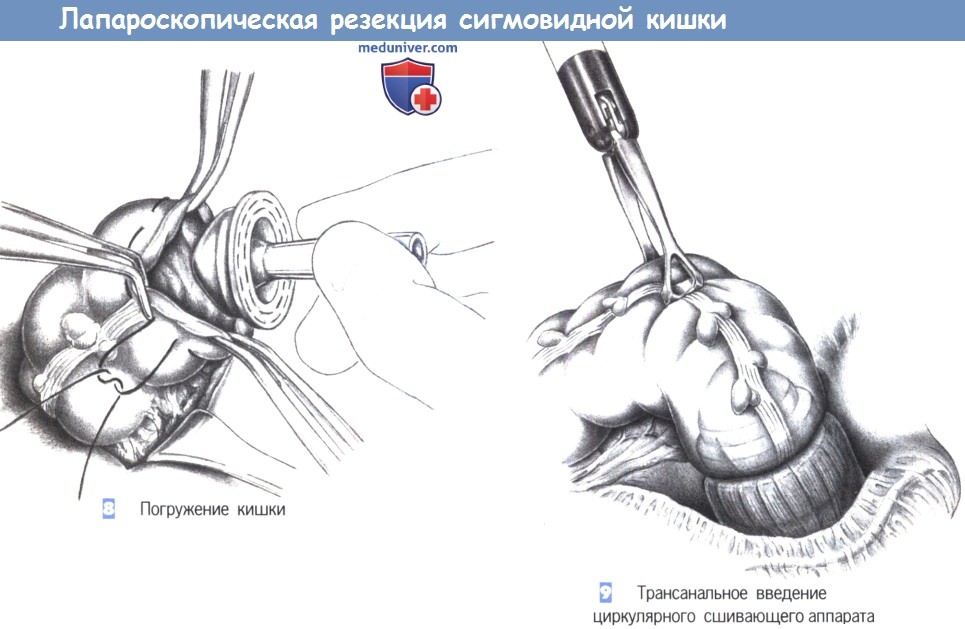
— Механический: кисетный шов на проксимальный конец кишки завязывается на введенной в просвет головке степлера, введение степлера в прямую кишку и формирование анастомоза без натяжения.
— Ручной анастомоз: однорядный или двухрядный.
б. Проверка анастомоза: погружение в воду, перекрытие кишки пальцами проксимальнее анастомоза и инсуффляция воздуха в прямую кишку.
Б) Операция Гартмана: формирование концевой колостомы:
в. Формирование концевой колостомы: выбрать место, наиболее удобное для пациента, предпочтительно до операции; окончательное формирование стомы выполняется только после ушивания послеоперационной раны.
г. Ушивание латерального окна между кишкой, выведенной в качестве стомы, и брюшной стенкой (чтобы избежать перекрутя петель тонкой кишки вокруг этого сегмента).
14. Дренирование в соответствии с предпочтениями хирурга. Необходимость в НГЗ отсутствует.
15. Ушивание раны.
16. Формирование стомы (при операции Гартмана).
е) Анатомические структуры, подверженные риску повреждения. Левый мочеточник, яичковые/яичниковые сосуды, гипогастральные нервы.
ж) Послеоперационный период:
• Ведение больных «fast-track»: прием жидкостей на первый послеоперационный день (при отсутствии тошноты и рвоты) и быстрое расширение диеты по мере переносимости.
• При операции Гартмана: планирование реконструкции после восстановления.
з) Осложнения резекции сигмовидной кишки:
• Кровотечение (связанное с хирургическим вмешательством): пресакральные вены, неадекватное лигирование сосудистой ножки, яичковые/яичниковые сосуды.
• Несостоятельность анастомоза (2%): технические ошибки, натяжение, неадекватное кровоснабжение.
• Повреждение мочеточника (0,1-0,2%).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Операци Гартмана
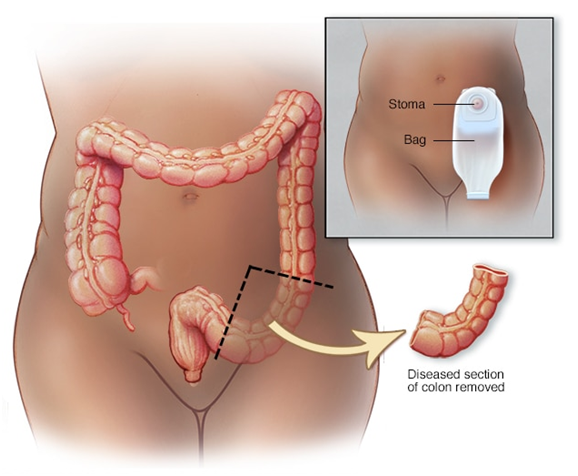
Операция Гартмана (Хартмана) – хирургическое вмешательство, во время которого удаляют часть толстой кишки и накладывают колостому – отверстие, соединяющее верхний оставшийся конец кишечника с поверхностью кожи, для отхождения стула. Основным показанием к данной операции являются злокачественные опухоли ободочной, прямой и сигмовидной кишки, когда нет возможности просто удалить пораженную часть кишечника и сразу наложить анастомоз.
Показания
Изначально операция по методу Гартмана была разработана для лечения рака кишечника, но к настоящему времени показания к ее применению расширились. На данный момент самым частым поводом для проведения данного хирургического вмешательства является осложненный дивертикулит. Дивертикулы представляют собой небольшие (0,5-1 см) выпячивания в виде мешочков на стенке толстой кишки. Воспаление дивертикула называется дивертикулитом. Хирургическое лечение при этой патологии показано в 20–30% случаев.
Выбирая тактику хирургического лечения осложненного дивертикулита, врачи ориентируются на классификацию Хинчи. В соответствии с ней, выделяют четыре стадии заболевания:
Операция Гартмана считается предпочтительным методом лечения при III и IV стадиях осложненного дивертикулита.
Вторым наиболее распространенным показанием являются злокачественные опухоли нижнего отдела ободочной, сигмовидной кишки и прямой кишки. При кишечной непроходимости, перфорации стенки кишечника (образовании сквозного отверстия) и сильном кровотечении операцию Гартмана выполняют в экстренном порядке. Когда показано плановое хирургическое лечение, методике Хартмана при раке кишечника отдают предпочтение в следующих случаях:
Также операция по методу Гартмана может быть показана при ряде других заболеваний:
Подготовка к операции
Если хирургическое вмешательство проводится в экстренном порядке, то на подготовку к нему отводится минимум времени. Проводят быстрый осмотр, минимальное обследование, чтобы оценить состояние пациента, и его сразу доставляют в операционную.
Подготовка к плановому хирургическому вмешательству начинается с предварительной консультации врача. Во время нее пациент должен рассказать доктору о том, какими он страдает сопутствующими заболеваниями, какие принимает лекарства, не было ли у него аллергических реакций на введение каких-либо препаратов. Проводят обследование, которое помогает уточнить диагноз, оценить характер, локализацию и степень распространенности патологического процесса, правильно спланировать хирургическое лечение.
Также нужно пройти стандартное предоперационное обследование, которое обычно включает следующие процедуры:
В течение нескольких дней перед хирургическим вмешательством нужно придерживаться легкой диеты, направленной на разгрузку кишечника и предотвращение запоров. Рацион должен быть полноценным и содержать мясо, фрукты, овощи. Накануне и в день проведения вмешательства кишечник очищают с помощью слабительных, клизм. Вмешательство проводят под наркозом, поэтому за 8–10 часов до него нельзя принимать пищу и пить.
Как проводится хирургическое вмешательство?
Хирургическое вмешательство может быть выполнено лапароскопически – через несколько проколов в брюшной стенке. Преимущества лапароскопических вмешательств в том, что они менее травматичны, по сравнению с открытыми, после них более короткий период восстановления, реже развиваются осложнения. Однако, некоторых пациентов приходится оперировать через разрез. В экстренных случаях чаще всего прибегают к лапаротомии.
Хирургическое вмешательство состоит из трех этапов:
В некоторых случаях, когда произойдет полное заживление тканей, можно закрыть колостому и восстановить толстую кишку. У некоторых пациентов колостома остается постоянно.
Преимущества операции Хартмана
Хирургическое вмешательство получило свое название по фамилии французского хирурга Анри Альберта Гартмана, который впервые описал данную методику на 30-м Конгрессе Французской хирургической ассоциации в 1921 году. Гартман описал клинические случаи двух пациентов с обструктивным (заблокировавшем просвет кишечника) раком сигмовидной кишки. У этих больных был удален участок сигмовидной кишки, наложена колостома и наглухо ушит конец прямой кишки.
В целом можно выделить следующие основные преимущества операции Гартмана в лечении рака кишечника:
Риски и возможные осложнения
Как и любое хирургическое вмешательство, операции Хартмана сопровождаются определенными рисками. Возможные осложнения:
Большинство пациентов переносят операцию Гартмана без серьезных осложнений. Риски повышены у пожилых больных, людей, имеющих сахарный диабет, сердечно-сосудистые и другие серьезные сопутствующие заболевания, избыточный вес, ожирение, у курильщиков.
В международной клинике Медика24 обеспечены все условия, чтобы свести риск осложнений к минимуму. У нас работают ведущие хирурги, каждый пациент перед хирургическим лечением проходит тщательное обследование. Для обсуждения сложных клинических случаев мы собираем врачебные консилиумы.
Восстановительный период
В послеоперационном периоде проводят следующие мероприятия:
Пациента выписывают домой, как правило, через 5 дней. Сроки выписки зависят от того, как быстро произойдет заживление, нормализуется состояние пациента, и восстановится работа его кишечника. Стул теперь будет отходить через колостому – на ней закрепляют специальный мешок-калоприемник. Перед выпиской врач инструктирует пациента, как правильно ухаживать за колостомой, менять калоприемники.
Операция гартмана на сигмовидной кишке
В экстренной хирургии резекция левой половины толстой кишки представляет собой сложную задачу, так как восстановить ее непрерывность после операции практически невозможно [1, 2]. Нельзя соединить концы толстой кишки после резекции по поводу опухолевой непроходимости или заворота сигмы с некрозом, перфорации или ранения, а также ряда воспалительных заболеваний, приводящих к развитию калового перитонита [3–5]. Первичный анастомоз в этих условиях обречен на несостоятельность швов, поэтому хирурги либо выводят оба конца кишки на переднюю брюшную стенку, либо выполняют оперативное вмешательство типа операции Гартмана с целью впоследствии восстановить ее непрерывность. Эти операции, как отмечают некоторые авторы [6–8], с одной стороны, приводят к снижению уровня тяжелых послеоперационных осложнений, являясь единственным верным способом завершения оперативного лечения в тактическом плане, а с другой стороны, создают дополнительные сложности, которые приводят к инвалидизации пациентов, длительным моральным и физическим страданиям, замкнутости и самоизоляции. Естественно, вышеперечисленное откладывает негативный отпечаток на поведение больного, значительно ухудшает качество его жизни как в социальном, так и в трудовом плане. К сожалению, эта проблема, по данным ВОЗ, за последние десятилетия обостряется во всех странах мира. Наблюдается тенденция к увеличению количества стомированных больных по разным причинам, а у многих из них такой объем операции остается пожизненно [3, 8, 9].
Следовательно, наилучшим фактором возвращения больных к нормальной жизни является восстановление непрерывности кишечного тракта – проведение реконструктивно-восстановительной операции. Как отмечают многие специалисты [5, 10, 11], все восстановительные операции относятся к разряду сложных оперативных вмешательств. И эта сложность обусловлена целым рядом факторов: нет четкого интервала времени на ее выполнение после первой операции, вида оперативного доступа и способа наложения анастомоза между резецированными участками толстой кишки. Существуют проблемы с профилактикой возможных осложнений, а также, что немаловажно, с оснащением медицинским оборудованием и опытом хирурга. Все эти вопросы очень важны и заслуживают особого внимания. Об этом свидетельствует статистика: несостоятельность швов анастомоза после реконструктивно-восстановительной операции составляет от 18–20 % случаев, разного рода гнойно-воспалительные осложнения – 22–26 %, а в 3–7 % случаях после операции наступает летальный исход [7, 12, 13]. Если еще учесть психологический фактор после первой операции и ее осложнения, наличие сопутствующих хронических заболеваний, то все эти опасения весьма тревожны и опасны.
Цель нашего сообщения – выявление наиболее оптимальных сроков для выполнения реконструктивно-восстановительных операций у больных после операции типа Гартмана в зависимости от основного заболевания; определение оперативного доступа, вида анастомоза и возможных осложнений с учетом клинико-анатомических условий.
Материалы и методы исследования
Работа основана на материале лечения 92 пациентов, которым были выполнены реконструктивно-восстановительные операции на толстой кишке по восстановлению ее непрерывности. Пациенты находились на лечении в общехирургических стационарах Республиканской больницы № 1 г. Кызыла (Республика Тыва) и 3-го хирургического отделения КГБУЗ КМКБСМП имени Н.С. Карповича, г. Красноярска в период с 2008 по 2019 г. Характеристика больных: мужчин было 58, женщин – 34; возраст – от 23 до 74 лет. Все пациенты перенесли обструктивную резекцию левой половины толстой кишки с наложением колостомы.
Причины, которые привели к резекции левой половины толстой кишки, были самые разнообразные: 42 пациента оперированы по поводу толстокишечной опухолевой непроходимости; у 16 – были осложнения дивертикулярной болезни с перфорацией, кровотечением, формированием инфильтратов, абсцессов – с явлениями перитонита; у 14 – заворот сигмовидной кишки при долихосигме с нарушением кровоснабжения, некрозом; у 6 – перфорация кишки с образованием абсцессов при язвенном колите и у 3 пациентов – перфорация инородными телами (рыбьей костью – в 2 случаях и зубным протезом в 1 случае) с образованием неспецифической опухоли (гранулемы); узлообразование и ущемление сигмовидной кишки в грыже – соответственно по 2 случая; травма дистальных отделов толстой кишки и промежности – у 7 (автодорожная травма – в 4 случаях, бытовая – в 2 и спортивная (борьба) – в 1 случае). Все больные поступали в отделения в разные сроки с момента заболевания: от 6 до 24 и более часов. Большинство первичных операций были выполнены в других стационарах в условиях осложненной патологии. Следует отметить, что многие больные с колостомами (17) имели ряд сопутствующих заболеваний и осложнений после первой операции. Сахарный диабет, болезни сердца, легких, желудочно-кишечного тракта, у 3 больных были осложнения в виде выпадения и ретракции колостомы, у 2 — грыжи, лигатурные свищи, также имело место их сочетание.
Подготовка больных к восстановительной операции требовала выполнения мероприятий, направленных на улучшение результатов лечения данной патологии и подготовку проксимального и дистального отделов толстой кишки для анастомозирования с целью восстановления ее непрерывности. Всем пациентам проводились исследования: рентгенография толстого кишечника; осмотр прямой кишки; определение диастаза между концами резецированного кишечника. Большое значение имеет пальцевое исследование через колостому с целью выявления метастазов. Предоперационная подготовка включала коррекцию водно-электролитного, белкового обменов, особенно у онкологических и пожилых пациентов, промывание прямой кишки фурациллином, ее массаж. Решающее значение в подготовке к повторной восстановительной операции имела патология, при которой производилась резекция с наложением колостомы. В среднем на предоперационную подготовку отводилось от 7 до 14 дней.
Результаты исследования и их обсуждение
Определяя сроки выполнения реконструктивно-восстановительных операций, мы разделили пациентов на 2 группы. Первая группа (50 человек) – это больные, которые были оперированы по поводу травм и доброкачественных заболеваний левой половины толстой кишки. Вторая группа (42 пациента) – со злокачественными опухолями сигмовидной и прямой кишки.
Больные из 1-й группы были, в свою очередь, разделены на пациентов, которым первая операция (типа Гартмана) выполнена в ранние сроки, без явлений перитонита – 28 пациентов, у 22 пациентов – в более поздние сроки, с явлениями перитонита.
Так, больным, не имевшим осложнений, из 28 пациентов в 23 случаях реконструктивно-восстановительные операции выполнены в сроки от 2,5 до 3 месяцев без каких-либо осложнений. Трем пациентам – в сроки 3–4 месяца от начала первой операции и двум – до 5 месяцев. Это были больные пожилого возраста. Основные причины задержки операции – их неинформированность и бытовые условия.
Осложнения отмечены в виде пареза кишечника, которые разрешились консервативно – 3 случая; и нагноения швов в области колостомической раны – 2 случая.
Пациентам из группы (22), у которых были осложнения после первой операции, восстановление непрерывности толстой кишки выполнено в интервале 4–5 месяцев. Мы исходили из того, что эти сроки, по мнению некоторых специалистов [5, 9, 10], являются оптимальными из-за нарушения микрофлоры, выраженности изменений в виде рубцово-спаечных процессов, наличия диверсионного колита и воспалительных изменений кожи вокруг колостомы. Осложнения отмечены у восьми больных: в двух случаях – несостоятельность швов анастомоза с развитием перитонита и летальным исходом; в пяти случаях – нагноение мягких тканей после закрытия колостомы, и в одном случае открылся тонкокишечный свищ (выздоровление). Причиной возникновения осложнений можно считать выраженный спаечный процесс, множественные десерозации петель тонкой кишки (со вскрытием просвета в одном случае), а также возраст пациентов старше 60 лет, наличие сопутствующих заболеваний (сахарный диабет, кардиальная патология) и, возможно, психологическая подавленность.
Немаловажное значение имеет оперативный доступ и вид наложения анастомоза. Рубцово-спаечный процесс является одной из основных проблем, обуславливающих дальнейшую тактику. Срединную лапаротомию мы применили у 90 пациентов, и только у 2 – косой окаймляющий разрез, но с последующей конверсией из-за невозможности наложения анастомоза. Срединная лапаротомия гарантированно давала возможность определить наличие рецидива опухоли или метастазов, избежать возможных осложнений при ревизии брюшной полости, проведении адгезиолизиса. При раке левой половины ободочной кишки (42 случая) реконструктивно-восстановительную операцию выполнили в сроки от 8 месяцев до 1,5 лет, а именно: 8–9 месяцев – 23 пациентам, до 1 года – 14 пациентам и около 1,5 лет – 5 пациентам. Как правило, по истечении этого срока уже была четкая уверенность в отсутствии рецидивов опухоли, либо метастазов.
Относительно наложения анастомозов мы пользовались в основном двумя видами: «конец в конец» и «конец в бок» – терминолатеральный. В двух случаях при короткой культе (менее 10 см) использовали аппарат АКА-2. Эта методика весьма перспективна, но вопрос о способе восстановления непрерывности толстой кишки должен решаться индивидуально в зависимости от длины культи прямой кишки, диастаза, технических возможностей и опыта хирурга. Анастомоз «конец в конец» накладывался в тех случаях, где не было натяжения. Анастомоз формировался двухрядными узловыми швами.
Осложненное послеоперационное течение отмечено у 18 пациентов из этой группы, из которых 5 человек умерли от перитонита (несостоятельность швов анастомоза). Все они были старше 60 лет и страдали сопутствующими заболеваниями. Среди других осложнений следует отметить образование инфильтрата в области анастомоза у 2 больных, у 1 из них инфильтрат регрессировал, в другом случае образовался каловый свищ, который удалось заживить без оперативного пособия (выздоровление). Нагноение операционной раны наблюдалось у 7 пациентов, раны зажили на 16-е сутки, больные выписаны на амбулаторное лечение. Ранняя спаечная кишечная непроходимость имела место в одном случае. У этого же больного впоследствии возникли эвентрация, пневмония.
Заключение
Таким образом, восстановление кишечной непрерывности после операции типа Гартмана является необходимым с целью трудовой и социальной реабилитации больных, но сложным в техническом отношении оперативным вмешательством. Вопрос о сроках и методе восстановления непрерывности толстой кишки, как правило, должен решаться в зависимости от причины заболевания, сроках наложения стомы. Он может колебаться, как в сторону уменьшения срока, так и увеличения. Оптимальными мы считаем сроки от 2,5 до 3 месяцев при неопухолевых заболеваниях, от 3 до 5 месяцев при неблагоприятных условиях наложения стомы (перитонит). У больных с онкозаболеваниями при опухолевой непроходимости эти сроки могут колебаться от 8–9 месяцев до 1,5 года. При выборе способа восстановления непрерывности толстой кишки предпочтение отдается анастомозу «конец в бок» – терминолатеральному из срединного, как наиболее обоснованного доступа при короткой культе прямой кишки, выраженности рубцово-спаечного процесса. Второй вид анастомоза «конец в конец» лучше использовать при длинной культе прямой кишки, минимальном спаечном процессе и без осложнений после первой операции. Только восстановление непрерывности кишечника обеспечивает психологическую, медико-социальную реабилитацию этих больных.
Операция Гартмана
Удаление опухоли с формированием концевой колостомиы с формированием резервуара (кармана) Гартмана. Данную операцию называют также обтруктивной резекцией прямой (или сигмовидной) кишки.
Физиологические изменения
Операция позволяет отвести фекальный поток от прямой кишки и ануса. По сравнению с поперечной колостомой концевая сигмовидная колостомия дает дополнительную длину толстой кишки, где успевает абсорбироваться излишняя жидкость из каловых масс. Таким образом, фекалии, эвакуируемые через колостому, прибретают более плотную консистенцию. Это позволяет регулировать отделение кала лучше, чем при поперечных колостомах. Стома позволяет мешку для каловых масс прилегать более плотно, что снижает контакт с кожей и её раздражение.
Что требует внимания
Для выявления, мобилизации и открытия брыжейки сигмовидной кишки необходим соответствующий разрез. Он должен быть выбран в соответствии с потребностями конкретного больного, обеспечивая надлежащее размещение колостомы на коже. Стому не следует помещать в талию пациента, где одежда будет мешать ей и никогда не должна быть помещена на нижнюю часть живота у пациентов с ожирением.
Приведенное видео техники операции Гартмана на английском языке содержит качественные подключаемые субтитры, которые помогут разобраться в нюансах приводимого материала.
РЕЗЕКЦИЯ СИГМОВИДНОЙ КИШКИ. ОПЕРАЦИЯ ГАРТМАНА
Операция Гартмана представляет собой хирургическое вмешательство, в ходе которого производится одномоментная резекция вовлеченного в патологический процесс участка сигмовидной кишки, фрагмента прямой кишки и вывод одноствольной кишечной стомы. Операция разработана французским врачом-хирургом в 20-х годах прошлого века.
ОПЕРАЦИЯ ГАРТМАНА: ПОКАЗАНИЯ
Данный вид хирургического лечения показан в следующих случаях: [1]
Операция Гартмана на толстой кишке назначается ослабленным пациентам пожилого возраста. Процедура противопоказана больным в тяжелом состоянии, требующем определенной предоперационной подготовки. [2]
ПОДГОТОВИТЕЛЬНЫЙ ЭТАП
Подготовка к операции включает следующие обследования:
При диагностике у пациента непроходимости кишечника необходимо проведение мероприятий по стабилизации водно-электролитного баланса. Кроме того, для предупреждения вероятных инфекционных осложнений, показана антибиотикотерапия. За три дня до назначенной операции пациент переводится на диету, включающую высококалорийные, богатые клетчаткой продукты.
Накануне процедуры пациент не должен принимать пищу, ему необходимо очистить кишечник с помощью клизмы и слабительных препаратов. [3]
ОПЕРАЦИЯ ГАРТМАНА: ЭТАПЫ
Вмешательство проводится под общей анестезией, непосредственно перед ее началом пациенту устанавливается желудочный зонд и мочевой катетер.
Операция делится на следующие этапы:
ПОСЛЕОПЕРАЦИОННЫЙ ПЕРИОД
После окончания операции пациента перевозят в палату интенсивной терапии. На протяжении двух суток больной самостоятельно не ест, находясь на внутривенном питании, на следующий после операции день ему разрешается пить. Употреблять малые порции жидкой пищи разрешается через три-четыре дня. [5]
Для предотвращения инфекционных воспалений проводится антибиотикотерапия, для профилактики анемии применяются препараты на основе железа, витамины группы В и другие средства.
При хорошем самочувствии пациента и отсутствии осложнений на четвертый-пятый день после вмешательства удаляется дренаж, а через 7-10 дней снимаются швы.
Пациент должен научиться ухаживать за колостомой, которую, при благоприятном протекании заболевания, примерно через полгода можно закрыть и восстановить нормальное функционирование кишечника.
ОПЕРАЦИЯ ГАРТМАНА: ОСЛОЖНЕНИЯ
Среди наиболее распространенных осложнений выделяют:
Для уменьшения вероятности развития осложнений операция по Гартману требует соблюдения пациентом в послеоперационный период ряда правил:
В Украине разрешено применение протоколов лечения, утвержденных Европейской ассоциацией онкологов ESMO и Американской Национальной онкологической сетью NCCN.
Стандартной схемы лечения, эффективной для каждого пациента с этим диагнозом, не существует. Методы и режим проведения терапии, длительность лечения подбираются индивидуально, в зависимости от стадии заболевания, возраста и общего состояния пациента, наличия у него противопоказаний.
Разобраться в ситуации и составить индивидуальный план обследований и лечения сможет только квалифицированный врач онколог.
Операция Гартмана
Операция Гартмана – хирургическое вмешательство, заключающееся в резекции дистального отдела сигмовидной кишки и верхнеампулярного отдела прямой кишки с выведением одноствольной сигмостомы. Показаниями к оперативному вмешательству являются новообразования сигмовидной кишки или ректосигмоидного перехода, осложненные непроходимостью, перфорацией толстого кишечника. Цель вмешательства – обеспечить отхождение каловых масс через сформированное противоестественное заднепроходное отверстие. При операции Гартмана сигмовидную и часть прямой кишки резецируют, культю прямой кишки ушивают, а проксимальный участок сигмы выводят на переднюю брюшную стенку в виде концевой сигмостомы. Операция Гартмана технически несложна, однако вызывает снижение качества жизни пациента и чревата различными осложнениями в послеоперационном периоде.
Операция Гартмана – хирургическое вмешательство, заключающееся в резекции дистального отдела сигмовидной кишки и верхнеампулярного отдела прямой кишки с выведением одноствольной сигмостомы. Показаниями к оперативному вмешательству являются новообразования сигмовидной кишки или ректосигмоидного перехода, осложненные непроходимостью, перфорацией толстого кишечника. Цель вмешательства – обеспечить отхождение каловых масс через сформированное противоестественное заднепроходное отверстие. При операции Гартмана сигмовидную и часть прямой кишки резецируют, культю прямой кишки ушивают, а проксимальный участок сигмы выводят на переднюю брюшную стенку в виде концевой сигмостомы. Операция Гартмана технически несложна, однако вызывает снижение качества жизни пациента и чревата различными осложнениями в послеоперационном периоде.
Операция Гартмана изначально нашла применение в проктологии при злокачественных новообразованиях толстого кишечника, осложненных обтурационной кишечной непроходимостью. Она разработана и апробирована французским хирургом Г. Гартманом, методика и результаты операции были представлены медицинскому сообществу в 1921 году. В России подобное вмешательство впервые выполнено в 1929 г. Н.Н. Петровым по поводу рака толстой кишки.
В отличие от двухмоментного вмешательства, предложенного Микуличем, операция Гартмана позволяет одномоментно удалить новообразование, что является несомненным преимуществом у ослабленных больных. Одномоментное удаление злокачественной опухоли прекращает поступление продуктов распада в кровь и снижает интоксикацию, а сохранение дистального отдела нисходящей ободочной кишки дает возможность восстанавливать целостность кишечной трубки, когда позволит состояние больного. К недостаткам операции Гартмана следует отнести длительное наличие у пациента колостомы, ухудшающей качество жизни.
Летальность от колоректального рака занимает 3-е место после рака легких и желудка, по данным разных источников, его распространенность составляет 32–78% всех локализаций в ЖКТ. Поэтому применение операции Гартмана при злокачественных образованиях до сих пор актуально, несмотря на почти вековую историю метода. За это время техника проведения операции Гартмана была усовершенствована, появилось несколько модификаций наложения колостомы, разработаны специальные сшивающие аппараты, что позволило снизить количество осложнений. Цены на операцию Гартмана в Москве зависят от уровня клиники, ее оснащенности, квалификации хирургов, степени сложности клинической ситуации.
Показания
В 80% случаев операция Гартмана выполняется по экстренным показаниям, вызванным осложнениями роста и развития злокачественного новообразования сигмовидной или прямой кишки. Больные поступают в хирургические отделения с острой кишечной непроходимостью вследствие обтурации кишечника опухолью. Среди осложнений также встречается перфорация толстой кишки, каловый перитонит. Реже наблюдаются кишечные кровотечения при изъязвлении образования. Показанием к проведению операции Гартмана также может служить долихосигма, осложняющаяся заворотом кишки, дивертикулез и другие болезни толстого кишечника. В плановом порядке вмешательство проводится пациентам со злокачественными и доброкачественными опухолями в области сигмовидной или верхнего отдела прямой кишки, неспецифическим язвенным колитом с рецидивирующими кровотечениями.
Противопоказания
Абсолютные противопоказания к операции Гартмана отсутствуют. В экстренных случаях вмешательство выполняется даже пациентам в тяжелом состоянии. Интенсивная терапия осуществляется в предоперационном периоде и параллельно с оперативным вмешательством. Относительным противопоказанием к плановой операции Гартмана может служить тяжелое состояние пациента, требующее предварительной подготовки в виде инфузионной терапии.
Подготовка к операции
Подготовка к операции Гартмана при экстренном поступлении пациента в связи с острой кишечной непроходимостью, кровотечением или перфорацией минимальна. После осмотра пациента хирургом или проктологом назначается ряд анализов, в частности, общий анализ крови с гематокритом, биохимические тесты крови. Обзорная рентгенография ОБП позволяет выявить воздух и жидкость в брюшной полости при перфорации или чаши Клойбера при кишечной непроходимости. При плановой операции Гартмана диагностика включает колоноскопию, во время которой производят забор биоматериала для гистологического исследования. Также на подготовительном этапе применяется ирригоскопия – рентгенологическое исследование толстого кишечника с введением бариевой смеси.
За 3–5 дней до плановой операции Гартмана пациенту рекомендуется высококалорийная диета с повышенным содержанием клетчатки, ежедневные очистительные клизмы и прием слабительного. Очищение кишечника перед операцией Гартмана можно провести и с помощью лаваж-раствора. С целью снижения риска осложнений назначается предоперационная антибиотикотерапия. В день оперативного вмешательства запрещается принимать пищу. Премедикацию проводят в палате или непосредственно в операционном блоке.
Методика проведения
Прямокишечную, левую ободочную и верхнюю сигмовидную артерии по возможности сохраняют. Корень брыжейки рассекают между зажимами. Дистальный и проксимальный сегменты пораженного кишечника поочередно прошивают с помощью аппарата или вручную. После прошивания пораженный участок удаляют. Культю прямой кишки погружают в малый таз. Через промежностный разрез устанавливают дренажные трубки, их фиксируют к коже с помощью лигатур. Брюшину над культей ушивают.
После операции Гартмана
После вмешательства больного переводят в послеоперационную палату или реанимационное отделение, где осуществляется контроль основных показателей (АД, ЧД, пульс, отделяемое по дренажам и др.). Чтобы обеспечить поступление в организм достаточного количества жидкости, назначается инфузионная терапия. Поскольку в первые дни возможно нарушение функции мочевого пузыря, мочу выпускают с помощью катетера.
Важную роль после операции Гартмана играет быстрое восстановление перистальтики, которая обычно отсутствует в течение 2–3 дней. Для опорожнения желудочно-кишечного тракта вводят назогастральный зонд, это позволяет разгрузить кишечник до восстановления перистальтики. Назначаются средства для стимуляции кишечника. После появления перистальтической активности больному разрешается жидкая пища, чай, минеральная вода без газа. Колостому при операции Гартмана вскрывают через двое суток. После устойчивого возобновления перистальтики и отхождения кала назогастральный зонд удаляют.
В послеоперационном периоде производится промывание культи прямой кишки асептическими растворами через дренажи, что снижает риск образования параректальных абсцессов. В течение 7-10 дней проводится антибиотикотерапия. Дренажные трубки убирают на 7–8 день, швы снимают на 9–10 сутки. Если отсутствуют осложнения, больного выписывают на 12–15 день после операции Гартмана, дав рекомендации по уходу за колостомой и диетическому питанию. Для полного восстановления после операции Гартмана требуется 1,5–2 месяца, через 3-6 месяцев можно проводить реконструктивное вмешательство – закрытие колостомы и восстановление непрерывности толстого кишечника.
Осложнения
Потенциальные осложнения после операции Гартмана разнообразны, они могут быть связаны с экстренностью операции, исходно тяжелым состоянием пациента, агрессивностью кишечной флоры. К ранним осложнениям относят внутрибрюшное кровотечение из крупных сосудов и несостоятельность швов с развитием калового перитонита. Применение желудочно-кишечных аппаратов при операции Гартмана позволило уменьшить риск развития инфекционных осложнений, но иногда инфицирование происходит в дооперационном периоде, например, при перфорации кишки. Поэтому после операции Гартмана встречается образование межпетельных, параректальных абсцессов, инфильтратов в брюшной полости.
Другим осложнением операции Гартмана является ранняя кишечная непроходимость, возникающая на фоне образования спаек. Спаечная болезнь также приводит к нарушению пассажа калового содержимого и мешает нормальному функционированию противоестественного заднепроходного отверстия. Избежать этого помогает ранняя активизация больного, частое дробное питание с достаточным содержанием клетчатки и молочнокислых продуктов.
Стоимость операции Гартмана в Москве
Цена вмешательства колеблется в зависимости от нескольких факторов. При проведении в государственном медицинском учреждении операция обычно обходится дешевле, нежели в частной клинике. Экстренность может способствовать удорожанию методики. При значительном объеме предоперационной подготовки цена операции Гартмана в Москве повышается. Также на стоимость данной хирургической техники может повлиять квалификация оперирующего хирурга, продолжительность пребывания в стационаре, наличие осложнений и увеличение количества лечебных мероприятий в послеоперационном периоде.
Хирургическое лечение онкологии толстой кишки
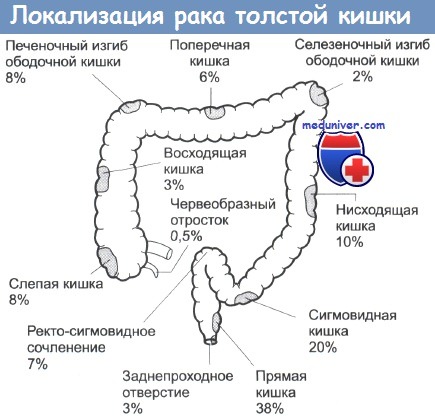
Рак кишечника занимает 2 место по распространенности среди онкологических патологий у людей в возрасте после 50 лет. Он поражает преимущественно мужчин. И именно рак толстого кишечника встречается чаще всего. Развитие заболевания начинается с полипа (аденомы), который постепенно растет в просвет кишки и перерождается в злокачественную опухоль. На поздних этапах опухоль распространяется по кровеносным и лимфатическим сосудам, давая метастазы в различные участки организма.
Важно помнить, что при своевременном выявлении онкологию толстого кишечника можно вылечить в 90% случаев. Если появились подозрения, незамедлительно обращайтесь к специалистам клиники АЦМД!
Причины и симптомы рака толстого кишечника
По мнению исследователей, онкологию толстой кишки могут провоцировать следующие факторы (зачастую в совокупности):
Заподозрить онкологию толстой кишки на ранних стадиях сложно. Особенно с тем учетом, что мужчины редко обращают внимание на первые симптомы.
К начальным проявлениям онкологии кишечника относятся:
Онкология толстой кишки на поздних стадиях плохо поддается лечению и часто оказывается фатальной. Для профилактики и своевременного выявления заболевания мужчинам после 50 лет нужно регулярно проходить осмотры у проктолога.
Лечение рака толстого кишечника
Лечение кишечной онкологии может быть хирургической, медикаментозной и комбинированной. Способы лечения подбираются индивидуально. Пациентам назначаются:
Но самым эффективным способом лечения рака толстого кишечника является операция, в ходе которой удаляются пораженные ткани. После хирургического лечения для профилактики рецидивов заболевания пациент первые 2 года должен находиться на диспансерном наблюдении.
Существует множество хирургических техник для иссечения злокачественных новообразований в области толстого кишечника. Методики подбираются исходя из места расположения опухоли, стадии рака и здоровья пациента (в целом). Чаще всего для лечения онкологии толстой кишки применяются гемиколэктомия и операция Гартмана.
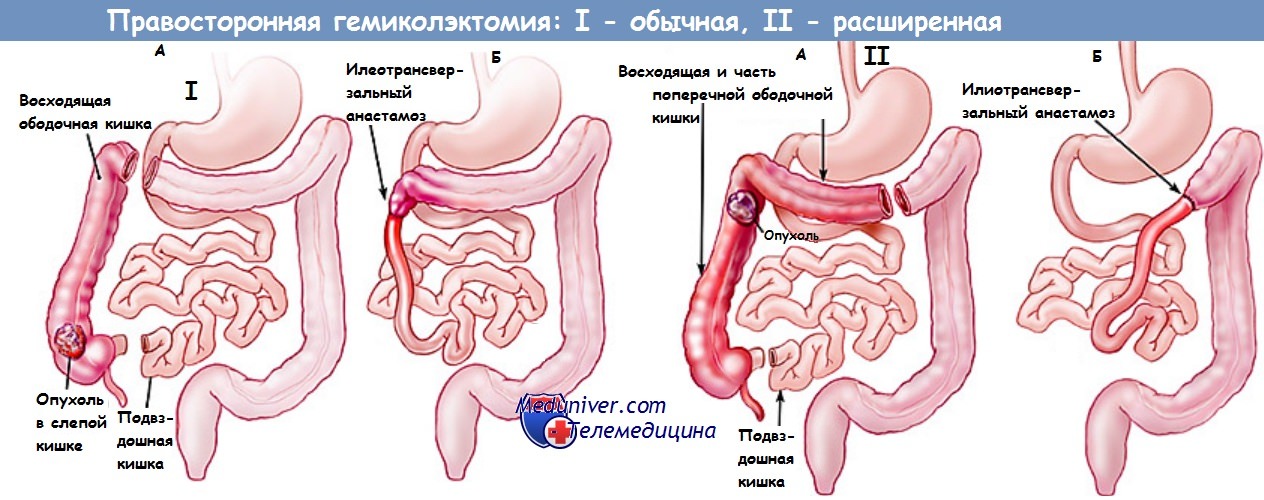
Гемиколэктомия: правосторонняя и левосторонняя
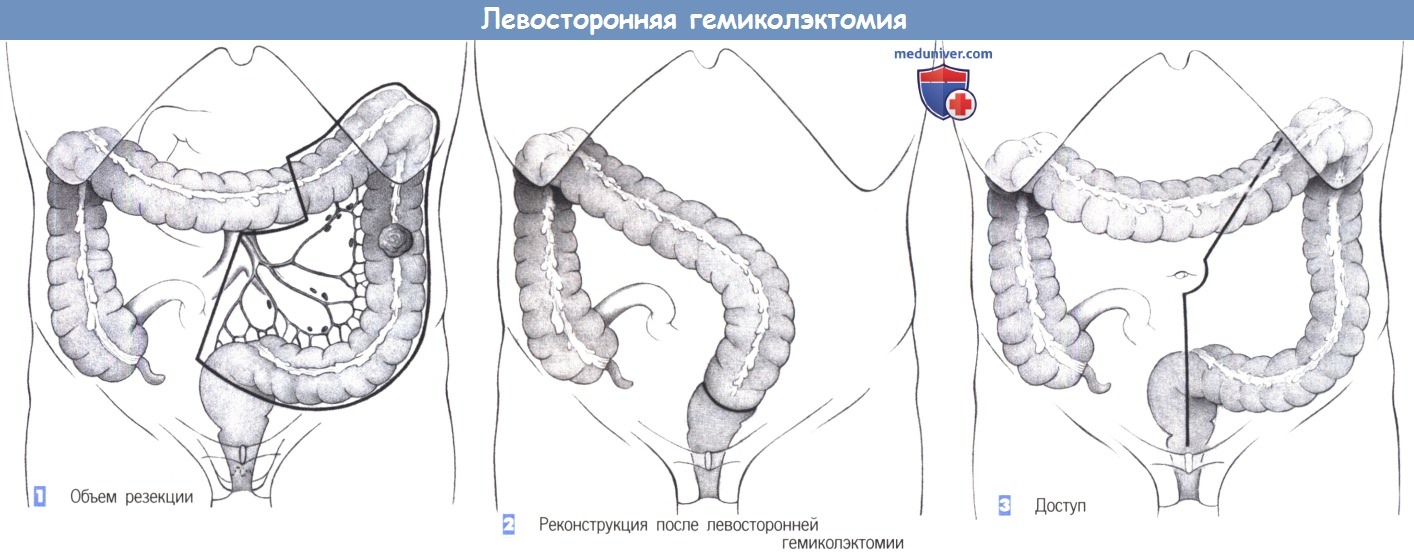
Гемиколэктомия – это удаление половины толстого кишечника. Процедура может быть правосторонней или левосторонней, в зависимости от расположения опухоли.
Правосторонняя гемиколэктомия предполагает иссечение правой половины толстой кишки, а также части поперечной и тонкой кишки. Левосторонняя гемиколэктомия целесообразна при онкологии сигмовидного отдела кишечника.
Операция выполняется под общим обезболиванием. Какую именно технику проведения операции выбрать, решает хирург. Все зависит от причины и запущенности патологического процесса.
После операции пациенты пребывают на стационарном лечении на протяжении 10-14 дней. Прогноз определяется стадией заболевания и успешностью операции.
Особенности операции Гартмана
Суть хирургического вмешательства по методике Гартмана заключается в:
В нынешнее время все операции на толстой кишке, соответствующие вышеуказанным принципам, называют «методикой Гартмана».
Оперативное лечение онкологии толстой кишки по методу Гартмана обладает следующими достоинствами:
Оперативное вмешательство по Гартману может быть экстренным, срочным (в случае непроходимости кишки), а также плановым (если опухоли развиваются медленно и без осложнений).
Реабилитационный период после операции Гартмана занимает 1,5-2 месяца. При благоприятном восстановлении пациента выписывают из стационара на 10-13 сутки. В случае формирования колостомы пациент во время восстановительного периода может пройти обучение, чтобы правильно и самостоятельно себя обслуживать.
В клинике АЦМД практикуются самые эффективные, инновационные хирургические способы лечения онкологии кишечника. Здесь работают профессионалы с огромным опытом. Клиника АЦМД – это ваш шанс на исцеление!
Записывайтесь на прием по телефонам: (044) 393-09-33 / (044) 393-09-30
Операция гартмана на сигмовидной кишке
Показания, этапы, техника резекции сигмы
б) Предоперационная подготовка:
— Предоперационные исследования: эндоскопия с биопсией, рентгеноконтрастное исследование; исключение отдаленных метастазов злокачественных опухолей: ультразвуковое исследование, компьютерная томография.
— Подготовка пациента: ортоградный лаваж кишки, катетеризация центральной вены, периоперационная антибиотикотерапия, катетеризация мочевого пузыря.
в) Специфические риски, информированное согласие пациента:
— Повреждение левого мочеточника (1% случаев)
— Травма селезенки (1% случаев)
— Несостоятельность анастомоза (менее 10% случаев)
г) Обезболивание. Общее обезболивание (интубация).
д) Положение пациента. Лежа на спине, модифицированное литотомическое положение по Ллойду-Дэвису.
е) Оперативный доступ при резекции сигмовидной кишки. Срединная лапаротомия ниже пупка. Также возможен разрез по Пфанненштилю или левый параректальный разрез Леннандера. Лучшим выбором является лапароскопический доступ.
ж) Этапы операции:
— Объем резекции
— Реконструкция
— Доступ
— Введение ретрактора в рану
— Мобилизация сигмовидной кишки
— Круговая диссекция сигмовидной кишки
— Скелетизация брыжейки сигмовидной кишки
— Удаление препарата
— Анастомоз задней стенки
— Анастомоз передней стенки
— Закрытие дефекта в брыжейке
з) Анатомические особенности, серьезные риски, оперативные приемы:
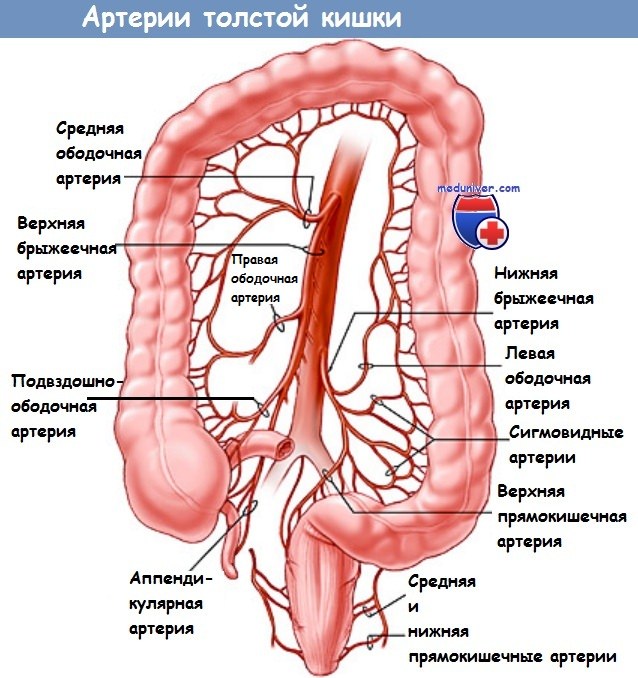
— Сигмовидная кишка расположена вблизи левого мочеточника, левой яичковой/яичниковой артерии и вены и нижнего полюса селезенки.
— Анастомоз должен быть свободным от натяжения; возможна мобилизация левого изгиба ободочной кишки.
Предупреждение: избегайте повреждения нижнего полюса селезенки при тракции ободочной кишки во время мобилизации.
и) Меры при специфических осложнениях:
— Несостоятельность анастомоза: если область операции хорошо дренируется, используется выжидательная тактика при парентеральном питании до самопроизвольного закрытия свища. При любых признаках перитонита выполните срочную релапаротомию и наложите отводящую стому или снимите анастомоз, закройте прямую кишку как слепую культю и создайте концевую стому нисходящей ободочной кишки (операция Гартмана).
— Стриктура анастомоза: развивается, только если анастомоз находится под натяжением. Если возможно, выполните эндоскопическую дилатацию, иначе потребуется повторная операция.
л) Этапы и технкиа резекции сигмы (сигмовидной кишки):
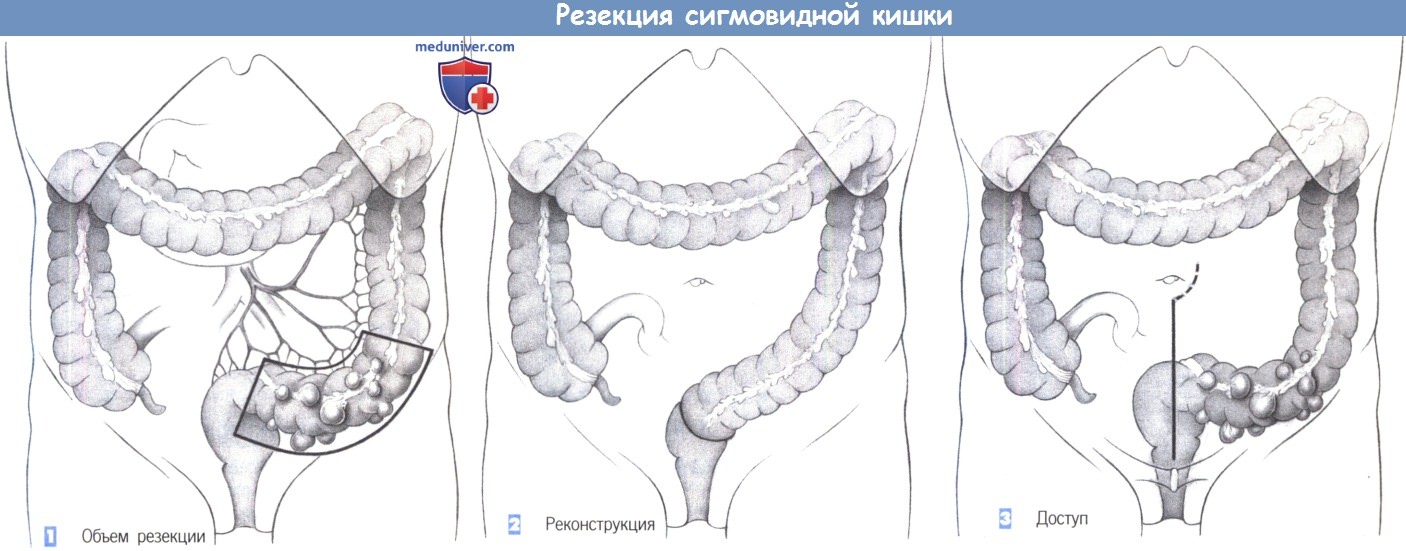
1. Объем резекции
2. Реконструкция
3. Доступ
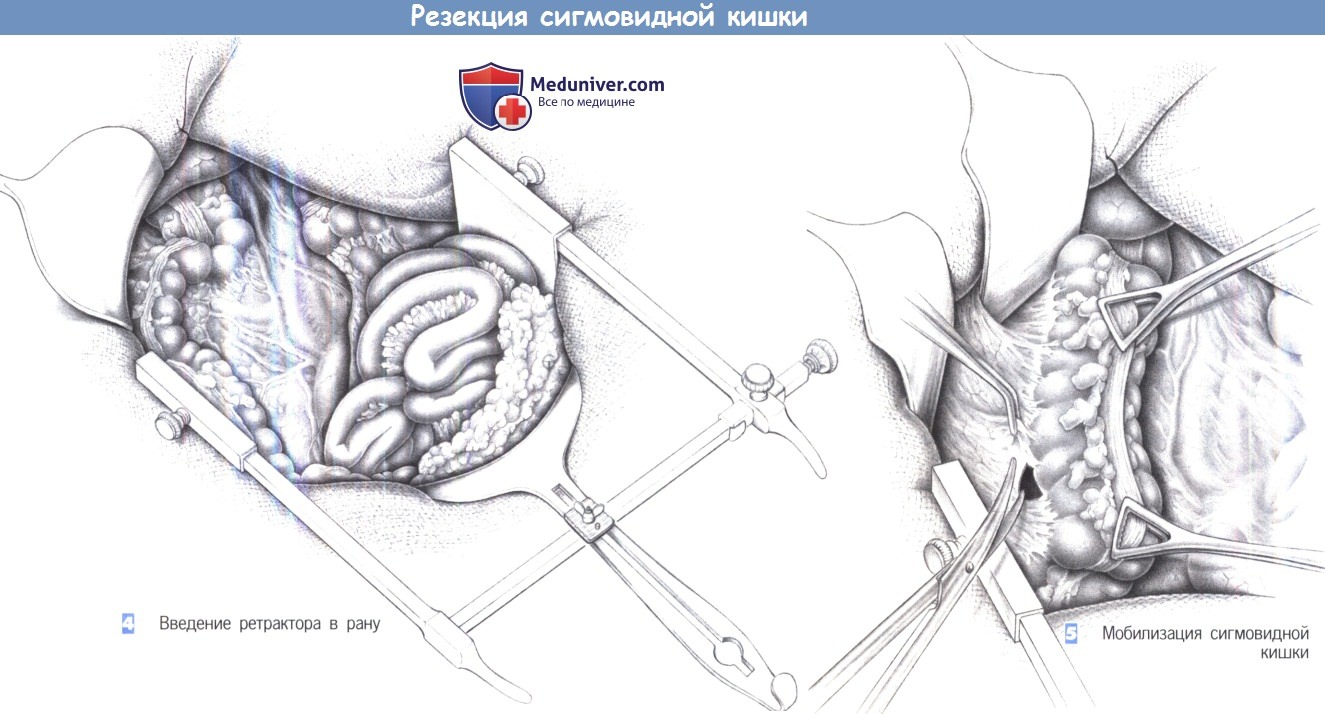
4. Введение ретрактора в рану
5. Мобилизация сигмовидной кишки
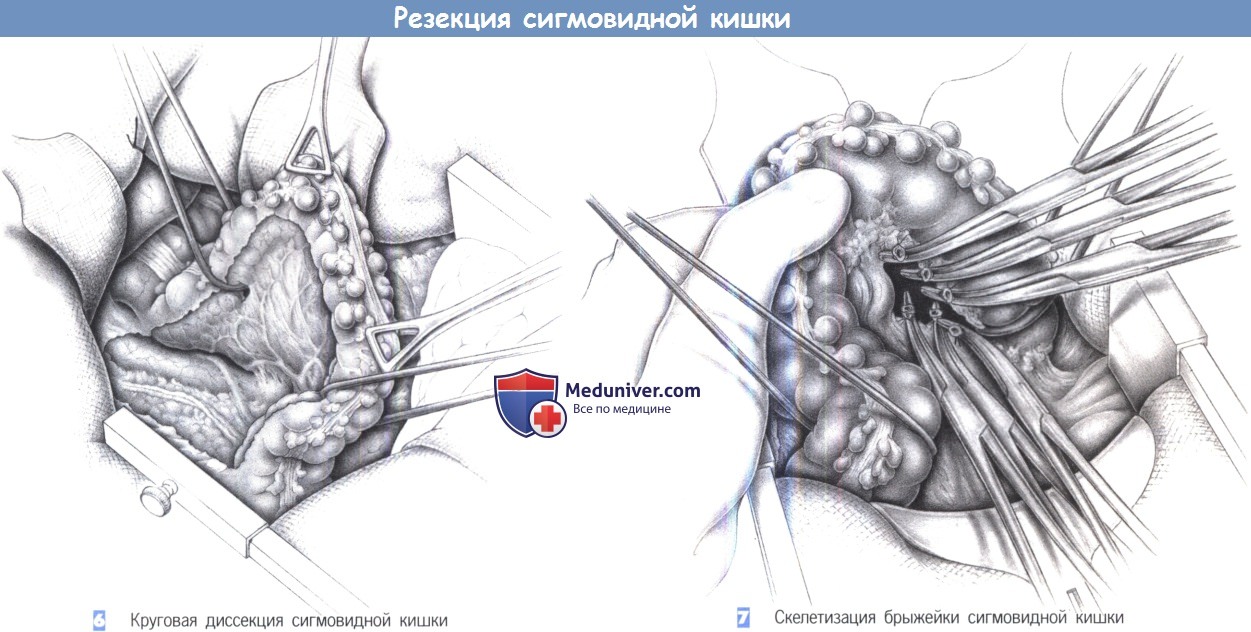
6. Круговая диссекция сигмовидной кишки
7. Скелетизация брыжейки сигмовидной кишки
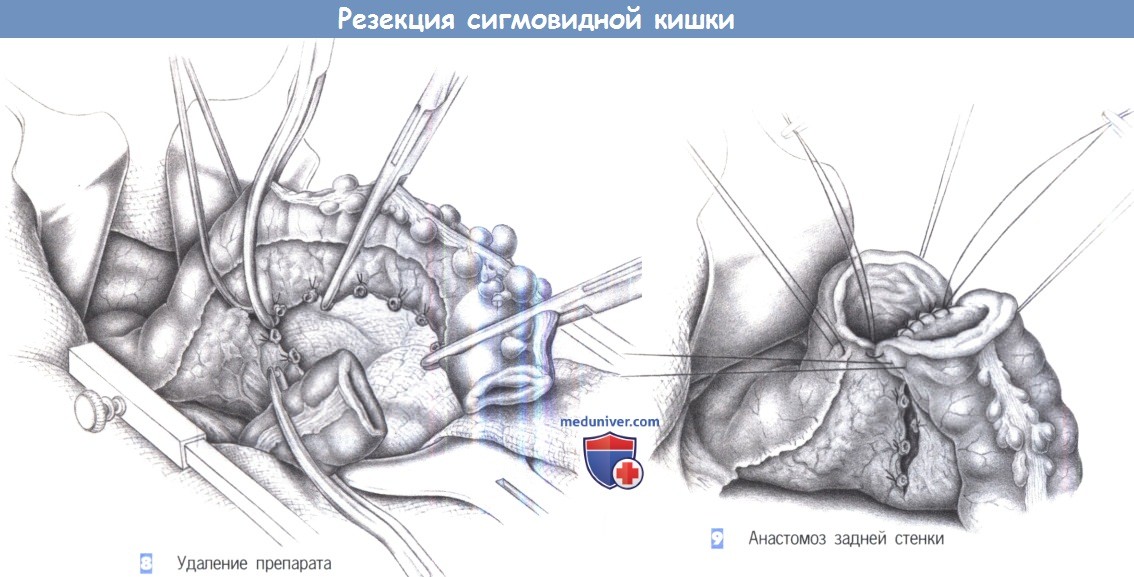
8. Удаление препарата
9. Анастомоз задней стенки
10. Анастомоз передней стенки
11. Закрытие дефекта в брыжейке
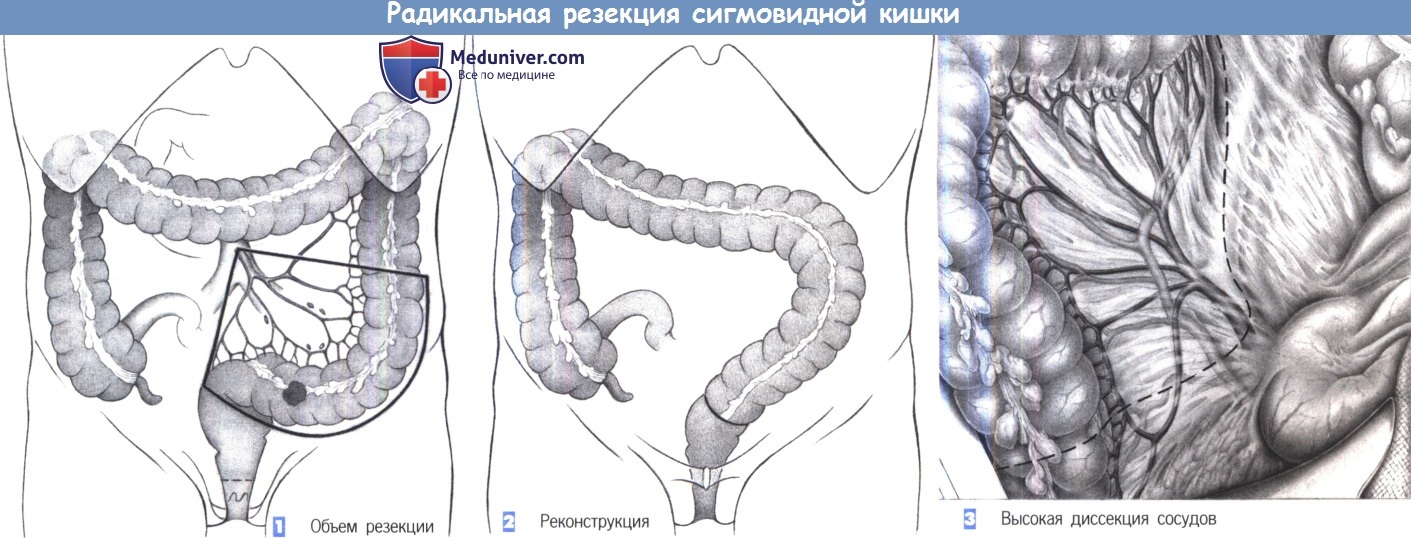
1. Объем резекции. Трубчатая резекция сигмовидной ободочной кишки (то есть, исключительно резекция кишки без полного удаления ее брыжейки) показана при воспалительных процессах и дивертикулах. Объем резекции определяется степенью патологических изменений в стенке кишки. Диссекция проводится близко к стене кишки.
2. Реконструкция. Восстановление непрерывности кишки в виде анастомоза между нисходящей ободочной кишкой и прямой кишкой обычно не составляет труда. Мобилизация селезеночного изгиба необходима только при обширной резекции.
3. Доступ. Доступ через нижнюю срединную лапаротомию, которая может быть расширена вокруг пупка. У женщин по косметическим соображениям можно выполнить разрез Пфанненштиля.
4. Введение ретрактора в рану. После вскрытия брюшной полости вводится ранорасширитель с кремальерой. Для этого весьма полезной оказалась рамка Голайера. После осмотра тонкой кишки она покрывается влажным полотенцем вместе с большим сальником, перемещенным в верхний отдел брюшной полости, где он удерживается длинным клинком среднего размера ретрактора Голайера.
6. Круговая диссекция сигмовидной кишки. Полная мобилизация сигмовидной кишки позволяет обнажить заднюю поверхность брыжейки. Объем резекции определяется степенью воспалительных изменений. Края резекции отмечаются резиновыми петлями. Мочеточник должен всегда четко определяться в пределах забрюшинного пространства. Его легче всего обнаружить там, где он пересекает подвздошные сосуды. Также должен быть обнаружен и предохранен яичниковый/яичковый сосуд, лежащий более латерально.
8. Удаление препарата. После полной мобилизации и скелетизации кишка резецируется между раздавливающими зажимами со стороны препарата и эластичными кишечными зажимами со стороны остающихся отделов кишки. Место операции обкладывается полотенцами, смоченными антисептическим раствором.
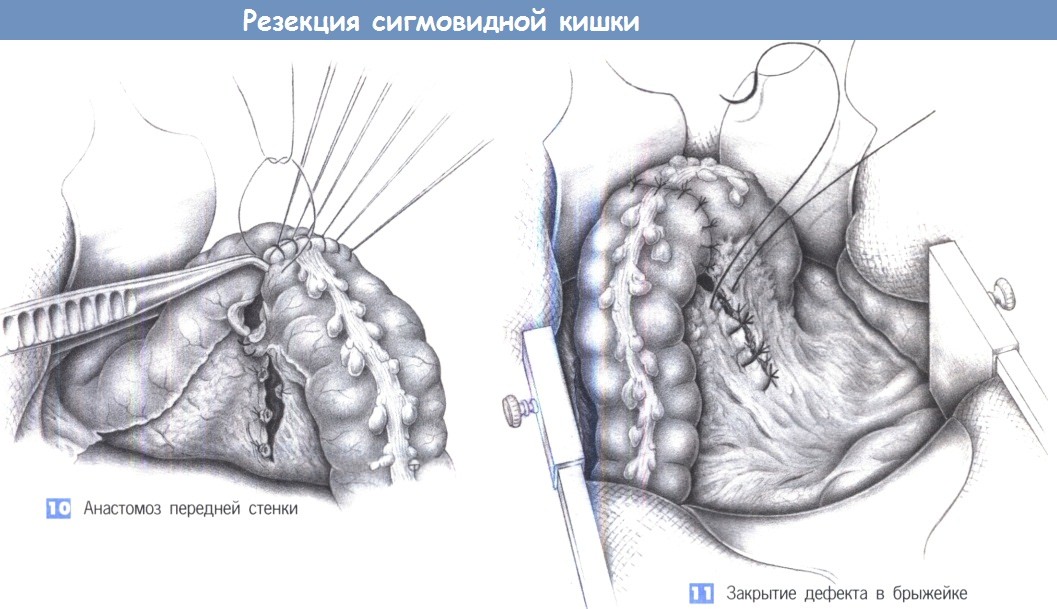
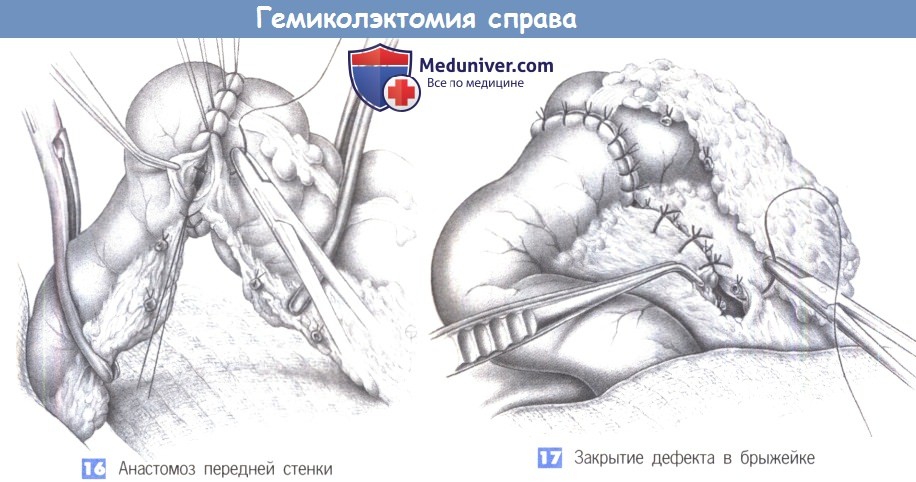
9. Анастомоз задней стенки. Ручным или аппаратным швом выполняется анастомоз в «конец в конец». Ручной метод требует, чтобы проксимальный и дистальный концы были стабилизированы швами-держалками. Используются одиночные швы из 3-0 PGA. Анастомоз создается однорядным швом, с косым направлением стежка в стенке кишки (больше серозной оболочки, меньше слизистой оболочки), промежутки между швами должны составлять 0,5 см.
10. Анастомоз передней стенки. Анастомоз передней стенки выполняется с помощью такой же однорядной техники. Два угловых стежка задней стенки вворачиваются.
11. Закрытие дефекта в брыжейке. Брыжейка сигмовидной кишки закрывается отдельными швами, без травмы сосудистой аркады, которая подвергла бы опасности кровоснабжение анастомоза. Операцию завершает введение двух дренажей и послойное закрытие брюшной стенки.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Хирургия»
Операция гартмана на сигмовидной кишке
Методика правосторонней гемиколэктомии
а) Место проведения. Стационар, операционная.
б) Альтернатива:
• Лапароскопический доступ.
• Расширенная правосторонняя гемиколэктомия (включающая оба изгиба и часть нисходящей кишки).
• Операция Гартмана с длинной культей и концевая илеостома.
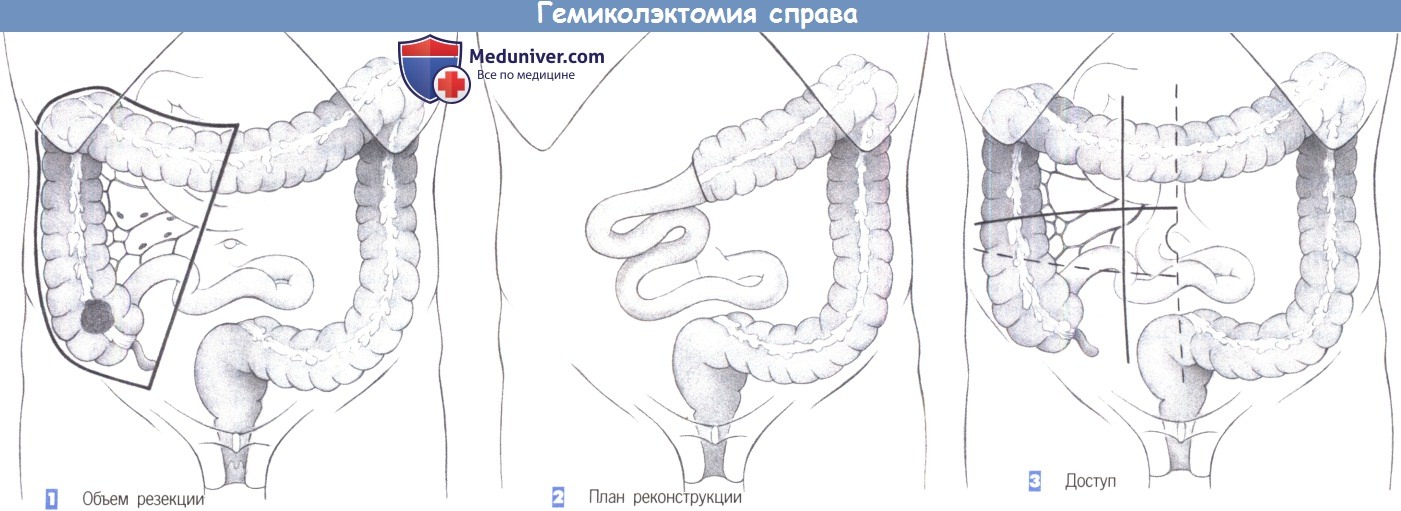
в) Показания для правосторонней гемиколэктомии: рак правых отделов ободочной кишки, дивертикулярная болезнь, заворот слепой кишки.
г) Подготовка:
• Полное обследование толстой кишки во всех плановых случаях, желательна маркировка (татуаж) мелких новообразований.
• Механическая подготовка кишки (традиционно) или без подготовки (развивающаяся концепция).
• Установка мочеточниковых стентов в случаях повторных операций или выраженных анатомических изменений (например, при воспалении).
• Маркировка места наложения стомы.
• Антибиотикопрофилактика.
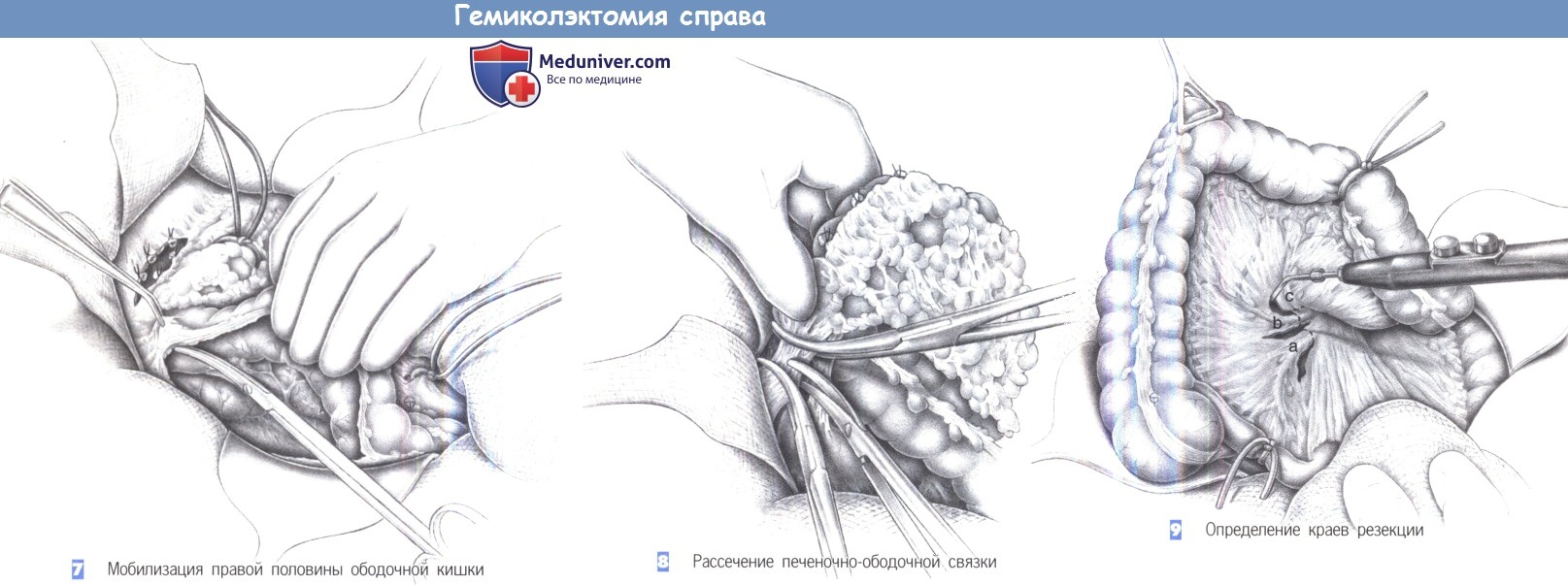
д) Этапы операции правосторонней гемиколэктомии:
1. Положение пациента: на спине, модифицированное положение для промежностного камнесечения (по предпочтению хирурга).
2. Лапаротомия: среднесрединная, правая поперечная (от пупка), подреберный разрез справа.
3. Установка абдоминального ранорасширителя и ручных зеркал для экспозиции правых отделов ободочной кишки.
4. Ревизия брюшной полости: местная резектабельность, вторичные патологические изменения (печень/желчный пузырь, тонкая/толстая кишка, женские половые органы), другие изменения.
5. Определение границ резекции:
а. Слепая/восходящая кишка: правая ветвь средней ободочной артерии.
б. Печеночный изгиб: расширенная правосторонняя гемиколэктомия.
6. Мобилизация правой половины ободочной кишки: начинается от илеоцекального соединения и продолжается вдоль латерального канала до печеночного изгиба. Анатомические ориентиры: мочеточник, двенадцатиперстная кишка (избегать травмы!).
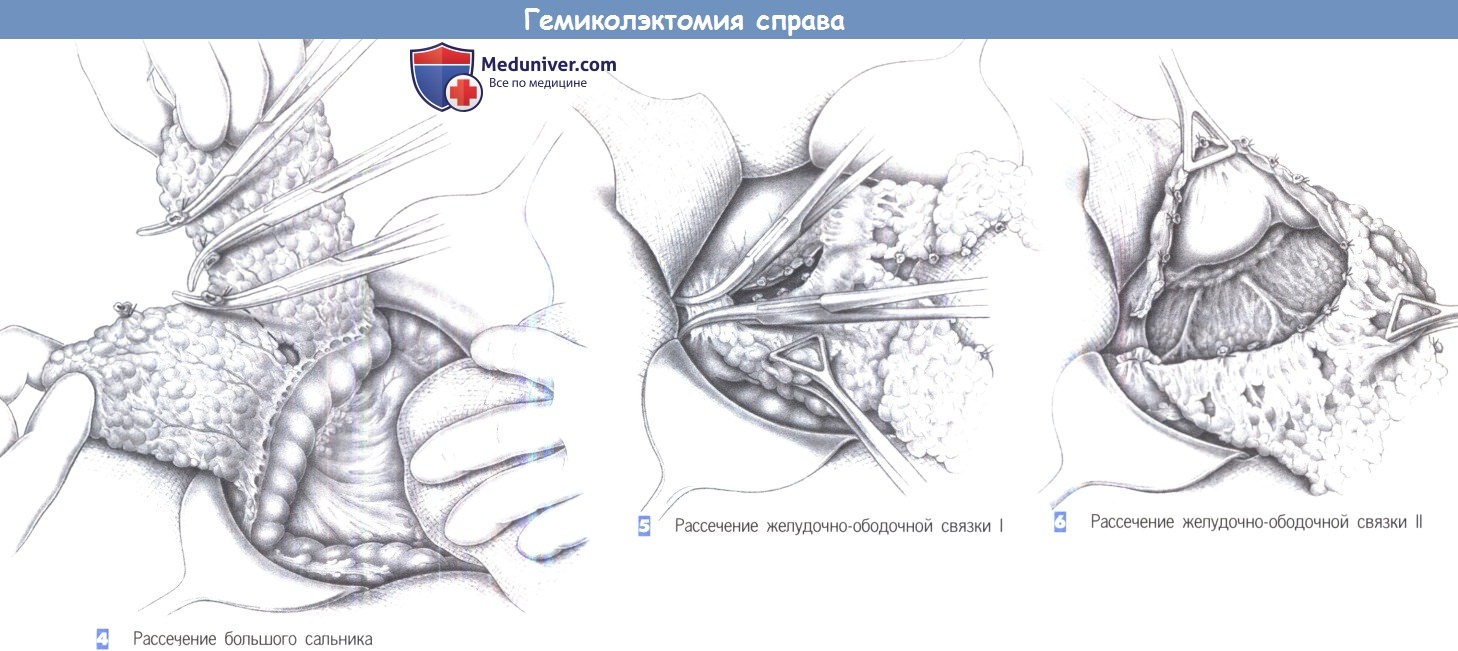
7. Рассечение сальниковой сумки: онкологические принципы резекции требуют выполнения, по крайней мере, гемиоментэктомии со стороны опухоли; разделение желудочно-ободочной связки проводится в несколько этапов (при доброкачественном заболевании сальник можно сохранить, отделив его от поперечно-ободочной кишки).
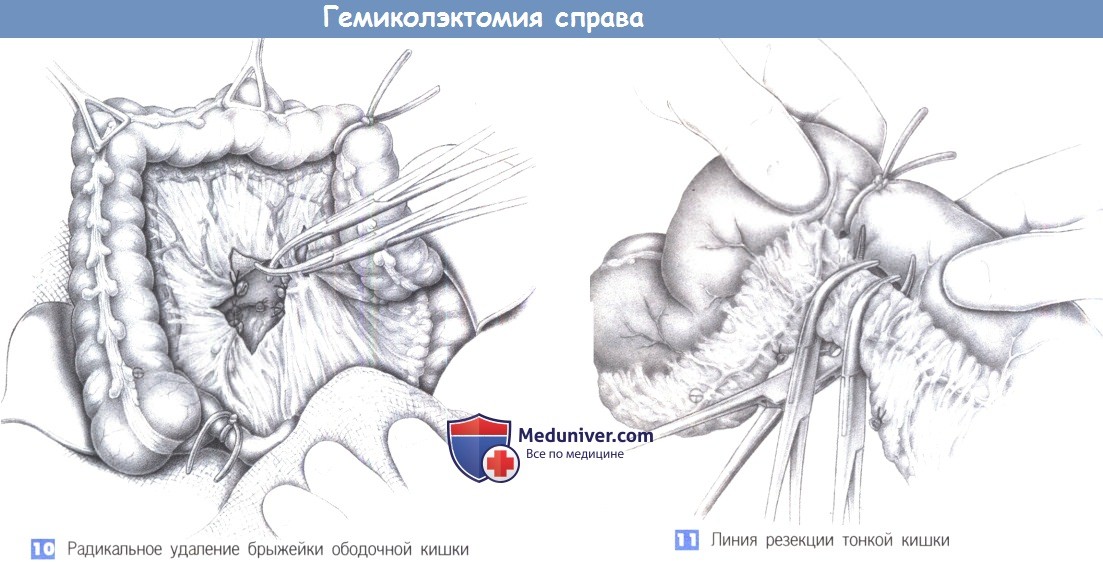
8. Идентификация подвздошно-ободочного сосудистого пучка: контурируется при тракции за слепую кишку по направлению к правому нижнему квадранту.
9. Онкологическая перевязка (перевязка с прошиванием) сосудов правой половины ободочной кишки. Перед пересечением тканей необходимо убедиться в безопасности мочеточника.
10. Поэтапное лигирование в направлении правой ветви средней ободочной артерии.
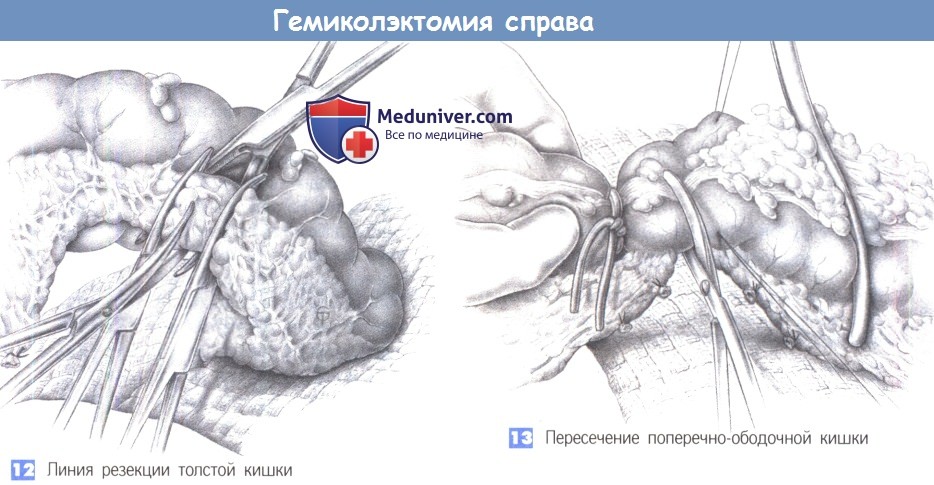
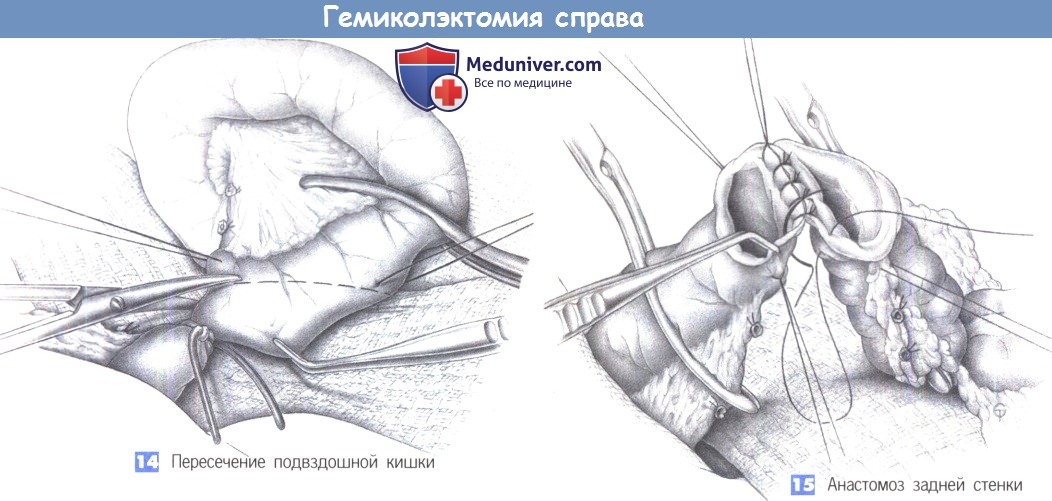
11. Пересечение кишки и формирование степлером илеотрансверзоанастомоза «бок в бок».
12. Удаление и макроскопическое исследование препарата: верификация патологических изменений и границ резекции.
13. Укрепление скрепочного шва отдельными узловыми швами.
14. Ушивание окна в брыжейке.
15. Дренирование не показано (за исключением особых случаев). Необходимость в назогастральном зонде (НГЗ) отсутствует.
16. Ушивание раны.
е) Анатомические структуры, подверженные риску повреждения: правый мочеточник, двенадцатиперстная кишка, верхняя мезентериальная вена, средняя ободочная артерия.
ж) Послеоперационный период: ведение больных «fast-track»: прием жидкостей на первый послеоперационный день (при отсутствии тошноты и рвоты) и быстрое расширение диеты по мере переносимости.
з) Осложнения правосторонней гемиколэктомии:
• Кровотечение (связанное с хирургическим вмешательством): тракции за верхнюю мезентериальную вену, неадекватное лигирование сосудистой ножки, средняя ободочная артерия.
• Несостоятельность анастомоза (2%): технические ошибки, натяжение, неадекватное кровоснабжение.
• Повреждение мочеточника (0,1-0,2%).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Операция гартмана на сигмовидной кишке
Методика реконструкции кишечника после операции Гартмана
а) Место проведения. Стационар, операционная.
б) Альтернатива:
• Оставить незакрытой: в связи с отягощенным коморбидным статусом или в связи с невозможностью низведения (редко).
• Проктэктомия, низведение. Колоанальный анастомоз (с/без временной илеостомы).
в) Показания для реконструкции после операции Гартмана:
• Наличие концевой колостомы после операции Гартмана с подтвержденной целостностью культи прямой кишки, более 3-х месяцев после формирования, нормализация общего и нутритивного статуса больного.
г) Подготовка:
• Полное обследование толстой кишки (ирригоскопия или колоноскопия), включая контрастное исследование культи прямой кишки (для оценки ее длины и конфигурации).
• Полная механическая подготовка кишки.
• Клизмы в культю прямой кишки + ректоскопия (подтверждение отсутствии бария).
• Антибиотикопрофилактика.
• Разъяснительная беседа: врач должен убедиться, что пациент осознает риск неудачи реконструктивной операции (=> постоянная колостома) или необходимость формирования временной илеостомы.
д) Этапы операции реконструкции кишечника после операции Гартмана:
1. Положение пациента: модифицированное положение для промежностного камнесечения, надувной иммобилизатор, прикрепленный к столу, руки пациента приведены к туловищу.
4. Цель 1: удаление петель тонкой кишки из полости таза и идентификация/мобилизация культи прямой кишки.
5. Цель 2: идентификация толстой кишки, несущей стому, мобилизация селезеночного изгиба.
6. Два полуовальных разреза кожи в поперечном направлении вокруг стомы, проходящие по касательной к кожно-слизистому соединению у орального и каудального края колостомы, и полная мобилизация стомы из всех слоев брюшной стенки (включая часто имеющийся грыжевой мешок).
7. Иссечение рубцовых тканей по краю стомы, наложение кисетного шва, введение головки циркулярного степлера максимально возможного размера, завязывание лигатуры; погружение кишки в брюшную полость.
8. Место выведения стомы впоследствии можно либо использовать как порт для ручной ассистенции, либо герметизировать его протектором раны или цапками для белья.
9. Полная лапароскопическая мобилизация может занять много времени: если спайки слишком плотные или не разделяются => конверсия к открытому вмешательству, т.е. через срединную лапаротомию.
10. Введение степлера в прямую кишку и проведение копья через культю под контролем зрения.
11. Формирование анастомоза => тест: погружение анастомоза под воду и инсуффляция воздуха в прямую кишку через сигмоидоскоп (пузырьки воздуха: да/нет?)
12. Повторная ревизия брюшной полости.
13. Удаление портов и/или ушивание лапаротомной раны.
14. Место выведения стомы: ушивание кожи (альтернатива: кожа не ушивается для заживления вторичным натяжением).
е) Анатомические структуры, подверженные риску повреждения: вскрытие просвета кишки, разрывы брыжейки, повреждение эпигастральных сосудов.
ж) Послеоперационный период:
• Ведение больных «fast-track»: прием жидкостей на первый послеоперационный день (при отсутствии тошноты и рвоты) и быстрое расширение диеты по мере переносимости).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Операция Гартмана
Для лечения рака сигмовидной кишки, ректосигмоидного отдела, а также опухолевого поражения верхне-ампулярного отдела прямой кишки (при невозможности формирования анастомоза – сшивания двух участков кишки) применяется операция Гартмана: резекция пораженного опухолью участка толстой кишки и наложение одноствольной колостомы с возможностью последующего отсроченного восстановления кишечника.
Стома (στομα –греч.) – это искусственно созданное сообщение между просветом любого полого органа (трахея, желудок, мочеточник и др.) и поверхностью кожи человека.
Кишечная стома (εντερικό στόμιο–греч.) – это искусственно созданное сообщение между тем или иным отделом кишечника человека и поверхностью кожи.
Суть операции Гартмана определяется несколькими моментами:
Сейчас все операции, которые соответствуют этим принципам, называют операциями «по типу Гартмана».
Основные преимущества операции Гартмана:
Операция Гартмана может быть экстренной (при прободении), срочной (при непроходимости кишки) и плановой (при опухолях без осложнений).
Операция по Гартману выполняется тогда, когда нельзя сразу выполнить наложение межкишечного анастомоза. Это бывает:
После колэктомии некоторым пациентам проводят специальную процедуру, называемую колостомией. Колостомия заключается в выведении части ободочной кишки наружу через брюшную стенку. Таким образом формируется отверстие, через которое будет выводиться кал, так называемая колостома. Как правило, колостому накладывают ненадолго, и только в редких случаях она остается на всю жизнь.
В процессе операции выше поврежденного участка кишки формируется разрез круглой формы, через который выводится ободочная или сигмовидная кишка. Ее пришивают к краям образовавшегося отверстия. Со временем возвышение над кожей, образовавшееся вследствие операции, сглаживается по мере уменьшения отека. Отверстие сужается.
Резекция сигмовидной кишки
Резекция сигмовидной кишки (сигмоидэктомия) – операция, направленная на удаление сигмовидной кишки, с формированием кишечной стомы или анастомоза, соединяющего интактные части кишечника. Сигмоидэктомия в отделении абдоминальной хирургии GMS Hospital осуществляется с помощью инновационных малотравматичных техник, что обуславливает быстрое восстановление, отсутствие п/операционных осложнений и скорейшее возвращение к привычному ритму жизни.
Врачи по специализации
Преимущества проведения операции в GMS Hospital
Основным приоритетом в работе хирургов клиники GMS является комплексный подход к пациенту. А это означает сочетание максимальной результативности и радикальности операции с возможностью скорейшего восстановления полной функциональности органа и организма в целом. Именно поэтому наши доктора отдают предпочтение современным малоинвазивным методам хирургического вмешательства, таким, как лапароскопическая сигмоидэктомия.
Преимущества лапароскопической резекции сигмовидной кишки:
Благодаря малотравматичным операционным методам, нам удается в большинстве случаев сохранить нормальную перистальтику кишечника и избежать кишечной стомы. Наша клиника оснащена эндоскопическим оборудованием экспертного класса, а это означает, что у нас есть возможность проводить прицельные малоинвазивные операции с минимальным травмированием здоровых тканей.
Почему нужно делать операцию
Сигмовидная кишка – один из отделов толстого кишечника, принимающий активное участие в процессе пищеварения. Заболевания этого отдела отрицательно влияют на работу всего кишечника, а многие патологии несут прямую угрозу жизни. Объем и метод хирургического вмешательства зависит от стадии и распространенности патологического процесса.
Стоимость резекции сигмовидной кишки
Цены, указанные в прайс листе, могут отличаться от действительных. Пожалуйста, уточняйте актуальную стоимость по телефону +7 495 104 8605 (круглосуточно) или в клинике GMS Hospital по адресу: г. Москва, ул. Каланчёвская, 45.
| Название | Цена |
| Резекция сигмовидной кишки с выведением ануса | 500 000 руб. |
Уважаемые клиенты! Каждый случай индивидуален и конечную стоимость Вашего лечения можно узнать, только после очного визита к врачу GMS Hospital.
Указаны цены на самые востребованные услуги. Вы можете обслуживаться по полису ДМС, оплачивать отдельно каждый визит, заключить договор на годовую медицинскую программу или внести депозит и получать услуги со скидкой. В выходные и праздничные дни клиника оставляет за собой право взимать доплату согласно действующего прейскуранта. Услуги оказываются на основании заключенного договора.
Принимаются к оплате пластиковые карты MasterCard, VISA, Maestro, МИР.
с ведущими российскими и зарубежными медицинскими учреждениями
и передовые методики диагностики и лечения
С какими показаниями обращаться
Прямым показанием к проведению сигмоидэктомии являются:
Специалисты отделения абдоминальной хирургии клиники GMS отдают предпочтение малоинвазивным оперативным методам, поэтому основная часть вмешательств проводится с помощью лапароскопических методик. Но в отдельных случаях требуется только полостная операция.
Подготовка, диагностика
Подготовка к сигмоидэктомии проводится согласно стандартной схеме. Перед операцией обязательно проводится комплексное обследование, которое включает:
Назначаются консультации узких специалистов – терапевта, проктолога, анестезиолога и т.д. Какие методы исследования будут назначены в вашем случае, врач определяет индивидуально.
Операция по поводу резекции сигмовидной кишки требует предварительной подготовки:
Как проводится резекция сигмовидной кишки
Сигмоидэктомия выполняется под общим наркозом. Кишку после ревизии выделяют и удаляют пораженный участок, затем восстанавливают целостность кишечника с помощью анастомоза –сшивания интактных участков кишки. Если одновременное восстановление непрерывности кишечника невозможно, выполняется формирование колостомы. В таком случае реконструкция кишечника будет проведена через пару месяцев.
Существует два основных способа проведения оперативного вмешательства:
Операция продолжается несколько часов, объем вмешательства зависит от стадии и степени распространенности патологического процесса, наличия сопутствующих патологий и т.д. Лапароскопическая сигмоидэктомия в клинике GMS проводится с помощью современных эндоскопических стоек, которые обеспечивают высококачественное изображение оперируемой области в многократном увеличении.
Применение новейшего оборудования ведет к минимальному травмированию тканей.
Резекция сигмовидной кишки
Резекция сигмовидной кишки (сигмоидэктомия) представляет собой операцию, при которой производится удаление пораженной части этого отдела кишечника. В зависимости от ситуации, иссечению может подлежать как небольшой фрагмент сигмы, так и вся она целиком. Операция может проводиться открытым или лапароскопическим доступом (через небольшие проколы в брюшной стенке), а также с использованием комбинированной методики. При определенных показаниях сигмоидэктомия выполняется с временным выведением окончания кишки через брюшную стенку наружу. В этом случае через некоторое время обычно проводится повторная хирургическая реконструкция для восстановления естественной проходимости кишечника.
Принятие решения о целесообразности операции и технике ее проведения — серьезнейший фактор эффективного лечения, и в этом отношении нельзя переоценить важность квалификации лечащего врача. Обращаясь в Центр хирургии «СМ-Клиника», вы гарантированно попадаете на прием к высококлассному специалисту с большим опытом клинической практики.
Преимущества проведения сигмоидэктомии в «СМ-Клиника»
Показания к резекции сигмовидной кишки
Подготовка к операции
При плановом хирургическом вмешательстве проводится стандартное предоперационное обследование, включающее комплекс лабораторных анализов, ЭКГ, консультации стоматолога, кардиолога, терапевта. Также проводится колоноскопия, УЗИ и КТ органов брюшной полости, исследование на онкомаркеры.
При экстренных показаниях к операции производится объективный осмотр пациента хирургом и терапевтом, УЗИ, забор крови на общий анализ, HbsAg, HCV, на группу и резус фактор, RW и ВИЧ. Пациентам с сопутствующими хроническими заболеваниями предоставляется консультация других узких специалистов, решается вопрос с приемом назначенных другими врачами медикаментов и проведение дополнительных исследований по их назначениям.
Вся необходимая подготовка может быть проведена в нашей клинике за 1-2 дня.
При плановой операции пациенту за несколько дней назначается специальная диета, предписывающая легкоперевариваемые продукты с низким содержанием клетчатки. Производится этапное клизмирование для полного очищения кишечника. Операция выполняется натощак.
Техника проведения операции
Вид наркоза — общий эндотрахеальный. В зависимости от показаний используется открытый или лапароскопический метод. При открытой операции врач рассекает брюшину, производит визуальную ревизию брюшной полости, определяет точные границы пораженного участка. Выделяет сигмовидную кишку, накладывает зажимы по границам предполагаемой резекции, перевязывает питающие сосуды и отсекает пораженный участок сигмы. Края кишки сшиваются вручную или с применением циркулярного сшивающего аппарата. После этого специальными методами выполняется проверка кишечного шва на герметичность. Устанавливается дренаж и производится послойное ушивание раны.
Длительность операции — 1,5 часа.
Виды операций по резекции сигмовидной кишки
Если позволяет клиническая ситуация, хирурги Центра стремятся проводить лапароскопические операции, поскольку они позволяют снизить травматичность тканей и значительно сократить период восстановления. Кроме того, хирургам важно сохранить органы женщины и их функции. Однако, если это невозможно (значительный объем кисты, риск развития раковой опухоли и др.), наши врачи выполняют и другие операции:
Лапароскопическая резекция сигмовидной кишки
Если позволяет ситуация, операция проводится лапароскопическим доступом. В этом случае вместо полостного разреза брюшины делается несколько небольших проколов (портов), через которые хирург вводит в брюшную полость эндоскопические хирургические инструменты. Операция производится под визуальным УЗИ контролем. Применение малотравматичной техники позволяет значительно снизить риски послеоперационных осложнений и болей, сокращает кровопотерю, период восстановления и имеет хороший косметический эффект — отсутствие грубых рубцов. Сшивание кишки в этом случае производится специальным сшивающим аппаратом, который вводится через прямую кишку. Следует знать, что при проведении лапароскопический резекции сигмовидной кишки врачи всегда готовы по текущим показаниям к ее переходу в открытый этап.
Операция Гартмана
Выполняется обычно ослабленным и пожилым пациентам по следующим показаниям, чаще всего экстренным:
Операция Гартмана характеризуется выводом открытого конца кишки на брюшную стенку, где он подшивается к коже и формируется искусственный задний проход — колостома.
Возможно проведение операции в два этапа. В этом случае через определенное время проводится повторная реконструкция с удалением колостомы и восстановлением естественного прохождения каловых масс. Может выполняться как открытым доступом, так и с применением метода лапароскопии.
Операция гартмана на сигмовидной кишке
Выбор вида хирургического вмешательства и обоснование его объема при раке ободочной кишки
История хирургического лечения рака ободочной кишки насчитывает более 150 лет. Reybard в 1833 году выполнил первую резекцию ободочной кишки по поводу злокачественной опухоли с формированием межкишечного анастомоза. В России в 1886 году Е.В.Павлов выполнил первую резекцию слепой кишки по поводу ее злокачественной опухоли с анастомозом между восходящей ободочной и подвздошной кишкой. В отличие от манипуляций на тонкой кишке резекция толстой кишки, по мнению В. Шмидена (1910г) относится к числу самых ответственных хирургических вмешательств, связанных с существованием таких особенностей, как наличие патогенной микрофлоры в содержимом полого органа, отсутствие брыжейки в фиксированных участках ободочной кишки, более тонким слоем мышечной оболочки. Указанные особенности толстой кишки предопределяют повышенную требовательность к надежности формирования межкишечных анастомозов с учетом анатомических особенностей различных отделов ободочной кишки и адекватности кровоснабжения анастомозируемых сегментов.
Среди способов формирования межкишечных соустий наиболее предпочтительными являются анастомозы, сформированные по типу «конец в конец», «бок в бок», и в ряде случаев «конец в бок». Формирование любого из видов анастомоза осуществляется наложением серозно-мышечных Ламбертовских швов и обвивного внутреннего вворачивающегося Шмиденовского, т.е. двухрядного шва. Возможно наложение вместо Шмиденовского шва отдельных узловых швов (например по Матешуку – узелками внутрь). Помимо ручного способа формирования межкишечного соустья заслуживает внимания формирование анастомоза однорядным швом с использованием лазерного скальпеля (на этапе пересечения анастомозируемого сегмента кишечной стенки), а в хирургии с использованием лапароскопической техники и сшивающих аппаратов для формирования механического шва.
Говоря о надежности сформированных межкишечных анастомозов, особое внимание следует уделять жизнеспособности сшиваемых участков толстой кишки, адекватности их кровоснабжения, отсутствию их натяжения. Нарушение трофики стенки кишки, обусловленное супрастенотическим расширением при различной степени выраженности обтурационной кишечной непроходимости, неадекватном кровоснабжении, картина разлитого перитонита, обусловленного перфорацией опухоли, являются абсолютными противопоказаниями к формированию межкишечного анастомоза при одномоментных резекциях. В подобных случаях предложены двух- и трехэтапные хирургические вмешательства (Операция Гартмана, Грекова, типа Шлоффера и др.).
На 30-ом конгрессе французских хирургов в 1921 году выступил с кратким сообщением хирург из Парижа Hartman с сообщением о выполненных им двух операциях. Основная идея операции – резекция пораженного злокачественной опухолью сегмента кишки с глухим закрытием дистального и выведением в виде противоестественного ануса проксимального отдела. В нашей стране операцию Гартмана по поводу рака толстой кишки в 1929 году выполнил Н.Н.Петров. Среди положительных моментов данного оперативного вмешательства следует отметить удаление опухоли на первом этапе, устранение таких осложнений опухолевого процесса как обтурационная кишечная непроходимость, перфорация опухоли, а главное- сохранение дистального сегмента толстой кишки, необходимого в последствии для выполнения реконструктивной операции- восстановления непрерывности кишечной трубки. Кроме того, операция Гартмана является малотравматичной и достаточно радикальной.
Таким образом, в тех клинических случаях, когда возникает необходимость выполнения двухэтапных оперативных вмешательств наиболее часто выполняют операции типа Микулича или Гартмана. При их выполнении в свете современных онкологических требований признается обязательным удаление пораженного опухолью сегмента кишки с перевязкой и пересечением основных кровеносных сосудов и выполнение адекватной лимфодиссекции. Выполнение операций в указанном объеме соответствует требованиям онкологического радикализма и позволяет надеяться на стойкое выздоровление и выполнении в дальнейшем реконструктивно-восстановительной операции.
Основным недостатком данных хирургических вмешательств является наличие хоть и временной колостомы. Поэтому повсеместно в специализированных онкопроктологических клиниках происходит переосмысление показаний к выполнению двухэтапных хирургических вмешательств, считая их выполнение оправданным лишь у ослабленных больных с явлениями декомпенсированной кишечной непроходимости.
При опухолевом поражении правой половины ободочной кишки при любой форме кишечной непроходимости, токсико-анемической форме рака, после проведения адекватной патогенетически обоснованной предоперационной корригирующей терапии показано выполнение правосторонней гемиколэктомии с первичным швом анастомоза.
При опухолевом поражении левой половины ободочной кишки хирургическое вмешательство в объеме левосторонней гемиколэктомии или сегментарной резекции сигмовидной кишки с формированием первичного толстокишечного анастомоза показано при компенсированной и субкомпенсированной формах обтурационной кишечной непроходимости, а также при опухолевом процессе, осложненном перифокальным и внутриопухолевым воспалительным процессом.
Расширение показаний к формированию первичного анастомоза при декомпенсированной форме кишечной непроходимости возможно (при отсутствие некорригируемых метаболических нарушений) за счет расширения объема хирургического вмешательства до тотальной или субтотальной гемиколэктомии с формированием илео-или цекосигмоанастомоза. Подобные оперативные вмешательства отвечают всем требованиям онкологического радикализма и при определенном опыте ненамного удлиняют время выполнения оперативного вмешательства.
Объем и характер хирургического вмешательства по поводу рака ободочной кишки зависит от ряда факторов, среди которых важнейшими являются локализация, степень распространения опухоли, наличие осложнений основного заболевания, а также общее состояние больного. Адекватный выбор способа хирургического вмешательства является залогом успешного лечения и не должен сопровождаться нарушением основных онкологических принципов. Для профилактики диссеминации опухоли в ходе оперативного вмешательства некоторые авторы рекомендуют выполнять предварительную перевязку магистральных кровеносных сосудов до выполнения каких-либо манипуляций с опухолью. По мнению других исследователей, пересекать и перевязывать сосуды, питающие тот или иной сегмент толстой кишки целесообразно лишь после установления операбельности опухоли, что можно установить только в процессе мобилизации кишки с опухолью.
В патогенезе возникновения локорегионарных рецидивов, по мнению большинства авторов, главную роль играет несоответствие объема оперативного вмешательства степени регионарного распространения опухолевого процесса по основным лимфатическим коллекторам и лимфоузлам. Неудаленные во время хирургического вмешательства пораженные метастазами регионарные лимфоузлы являются основной причиной неудач хирургического и комбинированного лечения колоректального рака. В этой связи с практических позиций решающее значение для выбора адекватного объема оперативного вмешательства приобретает знание наиболее типичных зон вероятного поражения метастазами основных групп лимфатических узлов в зависимости от опухолевого поражения различных анатомических отделов ободочной кишки.
При раке слепой кишки, восходящей ободочной кишки, печеночного изгиба ободочной кишки и проксимального отдела поперечной ободочной кишки адекватным объемом является выполнение правосторонней гемиколэктомии с перевязкой и пересечением стволов подвздошно-ободочной и правой ободочной артерии в непосредственной близости от места их отхождения от верхней брыжеечной артерии
Важно отметить, что метастазы в регионарные лимфоузлы по данным ряда авторов, при выполнении правосторонней гемиколэктомии встречаются у 22,5-28,7% больных.
При опухолевом поражении печеночного (правого) изгиба ободочной кишки и особенно проксимальной трети поперечной ободочной кишки возможно поражение лимфатических узлов, располагающихся вдоль основного ствола средней ободочной артерии. Отток лимфы вдоль правой ветви основного ствола средней ободочной артерии и подвздошно-ободочной являются второстепенными. Радикальность оперативного вмешательства обеспечивается увеличением объема хирургического вмешательства до расширенной правосторонней гемиколэктомии.
При локализации опухоли в средней трети поперечной ободочной кишки наиболее частым объемом хирургического вмешательства является сегментарная резекция с перевязкой и лигированием средней ободочнокишечной артерии и вены
Противником такого объема хирургического вмешательства при раке средней трети поперечной ободочной кишки является Л.И.Снешко, который полагает, что при такой локализации опухоли хирург не всегда может заранее определить направление тока лимфы. Не так часто, но встречается поражение метастазами помимо «типичных» регионарных лимфоузлов по ходу средней ободочнокишечной артерии ретроградное метастазирование с поражением лимфоузлов, расположенных вдоль правой ветви средней ободочнокишечной артерии и вдоль ветвей правой ободочнокишечной артерии. Поскольку нельзя исключить возможность такого атипичного метастазирования необходимо до принятия решения об объеме оперативного вмешательства и адекватной лимфодиссекции производить тщательную ревизию указанных зон возможного метастазирования. Радикализм оперативного вмешательства при подозрении на поражение указанных зон обеспечивается выполнением расширенной правосторонней гемиколэктомии.
Кровоснабжение оставшейся части ободочной кишки при выполнении указанного объема хирургического вмешательства осуществляется по Риолановой дуге из системы нижней брыжеечной артерии. При отсутствие адекватного кровообращения по дуге Риолана объем оперативного вмешательства должен быть расширен до субтотальной колэктомии с формированием цеко- или илеосигмоанастомоза. Возможно, что ток лимфы замкнется по левой ветви средней ободочнокишечной артерии и по дуге Риолана вплоть до поражения лимфоузлов у ствола девой ободочнокишечной артерии. В указанной ситуации радикализм оперативного вмешательства обеспечивается выполнением расширенной левосторонней гемиколэктомии, либо субтотальной гемиколэктомии.
В случае, когда опухолью поражена средняя и дистальная треть сигмовидной кишки выполняется резекция сигмовидной кишки, с удалением всех лимфоузлов по ходу нижней брыжеечной артерии, сигмовидных артерий. Чаще всего, при неосложненном опухолевом процессе, операция заканчивается формирование межкишечного анастомоза.
Выбор вида хирургического вмешательства при осложненном течении рака ободочной кишки
Большинство больных колоректальным раком поступают в специализированные лечебные учреждения в III и IV стадии опухолевого процесса. У многих из них отмечаются различные осложнения (обтурационная форма кишечной непроходимости, перфорация опухоли, кровотечение и перифокальный воспалительный процесс), нередко требующие выполнения экстренного хирургического вмешательства.
Результаты оперативных вмешательств у больных с осложненным колоректальным раком в известной мере зависят от квалификации оперирующего хирурга, его способности оценить степень и выраженность патологического процесса, осложняющего течение основного заболевания, и учетом общего состояния больного. Важнейшим критерием правильности выбранного вида хирургического вмешательства при осложненном раке ободочной кишки является частота послеоперационных осложнений и, в частности, недостаточность швов анастомоза, а также послеоперационная летальность.
По данным ряда авторов послеоперационная летальность при кишечной непроходимости достигает 35-40%. Высокие цифры послеоперационной летальности заставляет специалистов прибегать к выполнению двух-, а зачастую и трехэтапных хирургических вмешательств. Некоторые хирурги рекомендуют выполнять первичную резекцию ободочной кишки с коррекцией изменений, вызванных осложнением. При выборе вида хирургического вмешательства авторы рекомендуют стремиться не только избавить больного от острого хирургического осложнения, но и при возможности выполнить радикальную операцию.
Наличие симптомов кишечной непроходимости при раке ободочной кишки обусловливает трудности выбора метода формирования межкишечного анастомоза, так как нарушение пассажа содержимого по толстой кишке приводит к изменению состояния ее стенок, появлению супрастенотического расширения, полнокровию сосудов и стазу венозной крови. Формирование анастомоза в таких крайне неблагоприятных условиях чревато развитием его несостоятельности, особенно в тех случаях, когда из-за стеноза не представлялось возможным адекватно подготовить толстую кишку к оперативному вмешательству.
Одним из наиболее опасных осложнений рака ободочной кишки является перифокальное и внутриопухолевое воспаление, часто распространяющееся на окружающие ткани. Частота подобного осложнения достаточно высока и колеблется от 6% до 18%. Это осложнение проявляется клиникой острого воспаления и интоксикацией, а распространение процесса на соседние органы и окружающие ткани способствует образованию инфильтратов, абсцессов, флегмон. Нередко выраженный воспалительный процесс в опухоли и окружающих ее органах трактуют как опухолевую инфильтрацию, что является причиной неадекватного объема хирургического вмешательства.
Наличие перифокального и внутриопухолевого воспаления при раке ободочной кишки оказывает существенное влияние на выбор объема и характера хирургического вмешательства лишь в тех случаях, когда воспалительный процесс распространяется на окружающие органы и ткани. Трудности интраоперационого подтверждения вовлечения в опухолевый процесс соседних органов и тканей при раке ободочной кишки, осложненном перифокальным воспалением, вынуждает прибегать к выполнению комбинированных хирургических вмешательств. При отсутствии признаков вовлечения в воспалительный (опухолевый) процесс соседних органов показано выполнение типовых хирургических вмешательств.
При макро- и микроскопическом исследовании удаленных препаратов в группе больных с перифокальным воспалительным процессом, подвергнутых комбинированным хирургическим вмешательствам, было установлено распространение воспаления на окружающие органы и ткани и только у части из них, наряду с воспалительной была выявлена опухолевая инфильтрация соседних органов и тканей. Представленные сведения наглядно демонстрируют важность правильного выбора вида хирургического вмешательства при раке ободочной кишки, особенно при наличии различных неблагопроиятных факторов, пренебрежение которыми существенно ухудшает непосредственнные и отдаленные результаты радикальных, паллиативных и комбинированных хирургических вмешательств.
Комбинированные операции при раке ободочной кишки
Расширение объема хирургического вмешательства, обусловленное распространением злокачественной опухоли на близлежащие органы и ткани увеличивает продолжительность операции, травму и кровопотерю. При анализе результатов комбинированных хирургических вмешательств следует помнить, что в 30-50% случаев при гистологическом исследовании удаленного во время операции единым блоком препарата не наблюдается опухолевой инфильтрации резецированных смежных органов и тканей, вовлеченных в патологический процесс.
Этот факт свидетельствует о том, что почти в 40% клинических наблюдений перифокальный воспалительный процесс в зоне опухоли ободочной кишки ошибочно оценивается как распространенный опухолевый и в ряде случаев приводит к необоснованному отказу от радикального хирургического вмешательства. Выход опухоли за пределы кишечной стенки свидетельствует о далеко зашедшем неопластическом процессе, однако отсутствие отдаленных метастазов, определяемых как клинически до хирургического вмешательства, так и непосредственно во время операции, обусловливают необходимость и целесообразность выполнения комбинированных операций, которые, улучшая качество жизни больных, избавляют их от тяжелых осложнений опухолевого процесса и создают реальные предпосылки для применения специфических методов противоопухолевого лечения.
Как указывалось выше, при выполнении комбинированных хирургических вмешательств «на глаз» и «на ощупь» далеко не всегда можно установить истинность врастания опухоли в соседние органы.
Окончательным в оценке степени распространения является гистологическое исследование удаленного препарата. Проведенный анализ опухолевой инвазии смежных органов и тканей, удаленных или резецированных при выполнении комбинированной операции свидетельствует о том, что почти в 68% случаев имело место истинное врастание опухоли, тогда как у 32% пациентов микроскопическое исследование не установило опухолевой инфильтрации смежных органов, которые были удалены во время комбинированного хирургического вмешательства.
Паллиативные хирургические вмешательства у больных раком ободочной кишки
Паллиативная резекция ободочной кишки или гемиколэктомия существенно улучшает качество жизни, избавляя пациента от таких осложнений опухолевого процесса, как гнойно-септические осложнения, кровотечение, распад опухоли с образованием калового свища.
Хирургические вмешательства без формирования межкишечного соустья выполняются у пациентов с явлениями субкомпенсированной и декомпенсированной кишечной непроходимости. Необходимо подчеркнуть, что при выполнении таких оперативных вмешательств необходимым является соблюдение всех онкологических принципов, направленных на предупреждение местного рецидива опухоли, т.к. раннее его возникновение сводит на нет результаты этих операций.
Сравнительный анализ непосредственных и отдаленных результатов лечения больных раком ободочной кишки, подвергшихся резекции или гемиколэктомии, независимо от того, носила ли операция радикальный или паллиативный характер, показал, что частота и характер послеоперационных осложнений были примерно одинаковыми.
Резюмируя вышеизложенное, можно отметить, что паллиативные хирургические вмешательства в объеме резекции или гемиколэктомии находят все больше сторонников и все чаще являются операцией выбора при метастатическом раке ободочной кишки. Этому способствовало снижение частоты послеоперационных осложнений и летальности, расширение показаний к резекции пораженных метастазами органов (печень, легкие). Определяя показания к выполнению паллиативных хирургических вмешательств в объеме резекции ободочной кишки или гемиколэктомии, необходимо учитывать как общее состояние больного, так и степень диссеменации опухоли.
Серьезному пересмотру в последние годы подверглось и отношение к хирургическому лечению отдаленных метастазов рака ободочной кишки. Поскольку наиболее часто зонами гематогенного метастазирования рака ободочной кишки являются печень и легкие, а эффективность альтернативных хирургическому способов воздействия (лучевая терапия, химиотерапевтическое лечение) при раке толстой кишки и его метастазах остается весьма низкой, использование хирургического метода лечения приобрело особую актуальность. Анализ литературных данных свидетельствует о том, что наилучшие результаты достигнуты при хирургическом лечении метастазов в печень рака толстой кишки (Ю.И.Патютко с соавт.). Тем не менее, резекции печени, особенно обширные, являются хирургическими вмешательствами, требующими высокой квалификации хирурга и доступны только специализированным, хорошо оснащенным центрам.
Одним из важных факторов, оказывающих прогноз на течение заболевания у больных, подвергнутых резекции печени по поводу метастазов, является временной интервал между лечением по поводу первичной опухоли и выявлением метастазов в печень. Установлено, что чем больше продолжительность безрецидивного течения опухолевого процесса, тем благоприятнее прогноз хирургического лечения метастазов в печень.
При определении объема хирургического вмешательства по поводу метастатического колоректального рака важную роль играет изучение функционального состояния печени. Печеночная недостаточность сама по мебе является одной из основных причин послеоперационной летальности при обширных резекциях печени. Печень является органом с большими компенсаторными возможностями. Достаточно 10-15% здоровой ее паренхимы для полноценного функционирования органа.
Многие исследователи полагают, что оценка функциональных резервов оставшейся после обширной резекции паренхимы печени является наиболее актуальным направлением в хирургической гепатологии. По данным литературы, существующие в настоящее время методы и методики для определения функционального состояния печени (в том числе по биохимическим показателям, нагрузочные пробы с индоцианином зеленым и антипирином) не являются оптимальными и их оценка не может прогнозировать развитие острой печеночной недостаточности в раннем послеоперационном периоде.
В последние годы при хирургических вмешательствах на печени используют специальную хирургическую технику: лазерный, плазменный и струйный скальпели, микроволновый коагулятор. В хирургических клиниках ОНЦ авторами использовался отечественный ультразвуковой хирургический аспиратор, производимый в Нижнем Новгороде. Данные аппараты позволяют разрушать и удалять паренхиму печени, оставляя целыми трубчатые структуры, что дает возможность уменьшить интраоперационную кровопотерю, избежать использования гемостатических швов на паренхиму печени и уменьшить зону некроза, что в конечном итоге снижает травматичность операции.
Важным вопросом для определения хирургической тактики является количество метастатических узлов в печени. Множественные узлы значительно ухудшают прогноз и являются одной из основных причин отказа от активной хирургической тактики. Однако, наличие множественных узлов, локализующихся в одной анатомической половине печени, с нашей точки зрения, не являются противопоказанием к хирургическому лечения, хотя, конечно, прогноз у таких больных значительно хуже, чем при солитарных и единичных (2-3 узла) метастазах.
Комбинированное лечение рака ободочной кишки
Лишь в последнее время этот метод лечения стал внедряться в практическую деятельность онкопроктологических клиник.
В зависимости от последовательности применения ионизирующего излучения и оперативного вмешательства различают пред-, после- и интраоперационную лучевую терапию.
Предоперационная лучевая терапия
В зависимости от целей, с которыми назначается предоперационная лучевая терапия можно выделить две основные ее формы:
а) облучение операбельных форм рака ободочной кишки
б) облучение неоперабельных (местно-распространенных) или со мнительно операбельных форм опухолей.
Согласно данным Г.В.Голдобенко c соавт (1997), предоперационная лучевая терапия приводит к изменению биологических свойств опухоли вследствие того, что разрушаются радиочувствительные клеточные популяции, нарушается их способность к репродукции и имплантации, хотя бы и временной, у радиорезистентных клеток. При облучении зон клинического и субклинического распространения опухоли перед хирургическим вмешательством достигается, прежде всего, летальное повреждение высокозлокачественных пролиферирующих клеток, большая часть которых расположена в хорошо оксигенированных периферических участках новообразования, в зонах его роста как в первичном очаге, так и в метастазах. Определенную степень летальных и сублетальных повреждений получают и неразмножающиеся комплексы раковых клеток, благодаря чему снижается их способность к приживлению в случаях попадания в рану, кровеносные и лимфатические сосуды.
Гибель опухолевых клеток в результате лучевого воздействия приводит к уменьшению размера опухоли, отграничению от окружающих нормальных тканей за счет разрастания соединительнотканных элементов (в случаях длительного предоперационного облучения и отсроченных операций).
При морфологическом и авторадиографическом исследовании удаленных опухолевых тканей отмечается повышение степени дифференцировки в результате гибели анаплазированных, более радиочувствительных клеток. Признаки лучевого поражения опухолей обычно выражаютя в усилении дистрофических и некробиотических процессов: исчезновении митозов, дискомплектации раковых клеток, усилении плазмоцитарной и гистоцитарной инфильтрации стромы, пролиферации фибробластов, нарастании склероза и др. Все эти факторы создают условия для увеличения резектабельности, повышают возможность абластичного выполнения оперативных вмешательств, уменьшая угрозу развития рецидивов и метастазов. Однако, ряд авторов не нашел преимуществ предоперационного облучения по сравнению с чисто хирургическим видом лечения.
Несомненную роль в развитии местных рецидивов рака и отделенных метастазов играет неполное удаление первичной опухоли и регионарных лимфогенных метастазов, диссеминацией клеток злокачественной опухоли по операционной ране, по кровеносным и лимфатическим сосудам. Последнее обстоятельство подтверждается исследованиями ряда авторов, в которых было показано, что раковые клетки и их комплексы в операционной ране во время операций встречаются в 26-43% случаев.
Реализация положительного эффекта предоперационной лучевой терапии определяется, прежде всего, величиной дозы излучения.
Хотя ряд вопросов относительно величины и временного ее распределения все еще находится в стадии изучения, накопленный клинический опыт позволяет установить некоторые факторы, которыми можно руководствоваться при выборе величины дозы.
Во-первых, доза должна быть достаточной, чтобы вызвать гибель большей части клеток опухоли, несущих опасность диссеменации во время операции. Во-вторых, она не должна вызывать заметных изменений в окружающих нормальных тканях, которые могли бы вызвать нарушения процессов заживления операционных ран и увеличения частоты послеоперационных осложнений и летальности.
Многолетний опыт использования комбинированного лечения показывает, что очаговая доза не более 40 Грей, подведенная по 2 Грея ежедневно в течение 4 недель не вызывает сложностей в выполнении последующей операции и не оказывает заметного влияния на заживление послеоперационной раны. В клинических исследованиях было показано, что доза 40-45 Гр приводит к гибели 90-95% субклинических очагов роста.
В связи с появлением мегавольтных источников излучения (гамма-терапевтических аппаратов, линейных ускорителей), углублением радиобиологических знаний о действии ионизирующего излучения на опухолевые и нормальные ткани, были разработаны новые схемы временного распределения дозы, используемые во время предоперационной лучевой терапии и, в частности, так называемое крупнофракционное интенсивное облучение. Однако, до настоящего времени в литературе практически отсутствуют данные о рандомизированных исследованиях по комбинированному лечению больных раком ободочной кишки с использованием интенсивных курсов предоперационного облучения.
Наибольшим опытом лечения рака ободочной кишки с использованием концентрированного предоперационного облучения располагает Российский Онкологический Научный Центр РАМН им Н.Н.Блохина.
Методика лучевой и гипоксирадиотерапии больных раком ободочной кишки
Проведению курса предоперационной лучевой терапии и гипоксирадиотерапии предшествовало клинико-диагностическое обследование больного, направленное на морфологическую верификацию диагноза, оценку степени распространения опухолевого процесса и его осложнений, изучение общего состояния больного и его сопутствующих заболеваний. Для улучшения общего состояния больного, нормализации деятельности жизненно важных органов и систем больным проводилась патогенетически обоснованная корргирующая инфузионно-трансфузионная терапия. Предоперационное лучевое лечение заключалось в дистанционной гамматерапии на аппарате «Рокус» или линейных ускорителях, генерирующих энергию тормозного излучения 15-18 Мэв. Облучение производилось двумя встречно-направленными полями, передним и задним, размером от 10х 12 см до 14х22 см ( в зависимости от размеров опухоли ), но чаще всего использовалось поле 12х14 см. В зону облучения включалась первичная опухоль, околокишечная клетчатка, неизмененные участки толстой кишки выше и ниже опухоли /проксимальнее и дистальнее/ на 3-5 см, а также мезентеральные и парааортальные имфатические узлы.
Изучение возможностей гипоксирадиотерапии /ГРТ/ начинали с использования кислородно-азотной смеси, содержащей 10% кислорода и 90% азота /ГГС-10/. На первом этапе исследования ГГС-10 перед ГРТ проводилась проба на переносимость данной смеси.
В процессе изучения и лечения больных по методике ГРТ с использованием ГГС-10 была отмечена хорошая переносимость больными гипоксического состояния и самого облучения.
В ходе изучения возможностей использования различных гипоксических смесей, в частности, переносимости их, лучевых реакций при повышенных разовых и суммарных очаговых доз, было установлено, что смесь содержащая 9% кислорода и 91% азота /ГГС-9/, также хорошо переносится больными, как и ГГС-10, но дает лучшую «защиту» здоровых тканей, попадающих в зону облучения, в частности, меньшее число и меньшую интенсивность лучевых реакций, как местных, так и общих, даже при подведении предоперационных доз, увеличенных на 25% по сравнению с исходными, т.е. РОД 5 Гр, СОД 25 Гр. И система доставки ГГС к больному, и сами ГГС-10 и ГГС-9 показали высокую надежность, простоту в обращении и отсутствие каких либо осложнений даже у больных пожилого возраста.
На сегодняшний день ГГС-9 является самым эффективным радиопротектором, в 2-3 раза уменьшающим число и интенсивность лучевых реакций, и расширяющим возможности лучевой терапии
Резюмируя все выше изложенное, необходимо отметить, что интенсивная предоперационная гипоксирадиотерапия рака ободочной кишки является эффективным средством, позволяющим существенно снизить число рецидивов и метастазов рака, что не только отражается на качестве жизни больных, но и заметно улучшает показатели 3-5-летней выживаемости больных, особенно при прогностически неблагоприятных стадиях опухолевого процесса. Таким образом, полученные данные позволяют рекомендовать комбинированные методы интенсивной предоперационной гипоксирадиотерапии в широкую практическую деятельность онкопроктологических учреждений.
Послеоперационная лучевая терапия
Определенными достоинствами послеоперационной лучевой терапии являются:
Исходя из механизмов воздействия ионизирующего излучения на нормальные и опухолевые ткани, представляется, что послеоперационная лучевая терапия менее целесообразна, чем предоперационная.
Наличие воспалительных явлений в зоне оперативного вмешательства, нарушение крово- и лимфоснабжения приводит к задержке поступления кислорода к опухолевым клеткам и их комплексам, что делает их радиоустойчивыми. Одновременно, нормальные ткани в состоянии регенерации становятся более радиочувствительными, а именно их в большем объеме надо включать в мишень для послеоперационного облучения, т.к. нужно воздействовать на ложе опухоли, весь послеоперационный рубец и зоны регионарного метастазирования.
— к.м.н. Тамразов Р.И.
Операция гартмана на сигмовидной кишке
Показания, этапы, техника радикальной резекции сигмовидной кишки
а) Показания для радикальной резекции сигмовидной кишки:
— Плановые: злокачественные новообразования сигмовидной кишки.
— Альтернативные операции: левосторонняя гемиколэктомия: обычно необходима при злокачественных опухолях проксимальных отделов сигмовидной кишки; в случае выявления метастазов в печени: трубчатая резекция сигмовидной кишки (скелетизация брыжейки близко к стенке кишки).
б) Предоперационная подготовка:
— Предоперационные исследования: эндоскопия с биопсией, рентгеноконтрастное исследование; исключение отдаленных метастазов злокачественной опухоли: ультразвуковое исследование, компьютерная томография, возможно урологическое обследование.
— Подготовка пациента: ортоградный лаваж кишки, катетеризация центральной вены, периоперационная антибиотикотерапия, катетеризация мочевого пузыря.
в) Специфические риски, нформированное согласие пациента:
— Повреждение левого мочеточника (1% случаев)
— Травма селезенки (менее 5% случаев)
— Несостоятельность анастомоза (менее 10% случаев)
— Расхождение раны (менее 10% случаев)
г) Обезболивание. Общее обезболивание (интубация).
д) Положение пациента. Лежа на спине, модифицированное литотомическое положение по Ллойду-Дэвису.
е) Оперативный доступ для радикальной резекции сигмовидной кишки:
— Срединная лапаротомия, продолжение разреза выше пупка к левому подреберью.
— Радикальная резекция сигмовидной кишки отличается от трубчатой только отдаленностью краев резекции и одновременным удалением всей лимфатической системы брыжейки.
Поэтому здесь будут представлены только эти различия, остальные этапы операции описаны в этой статье на сайте.
ж) Этапы радикальной резекции сигмовидной кишки:
1. Объем резекции
2. Реконструкция
3. Высокая диссекция сосудов
з) Анатомические особенности, серьезные риски, оперативные приемы:
— Сигмовидная кишка расположена вблизи левого мочеточника, левой яичковой/яичниковой артерии и вены и нижнего полюса селезенки.
— В области анастомоза не должно быть натяжения; поэтому возможна мобилизация левого изгиба ободочной кишки.
— Предостережение: избегайте повреждения нижнего полюса селезенки в результате тракции ободочной кишки при мобилизации селезеночного изгиба.
— Прежде чем перевязать левую ободочно-кишечную артерию, убедитесь в целостности артериальной дуги Риолана.
к) Послеоперационный уход после радикальной резекции сигмовидной кишки:
— Медицинский уход: удалите назогастральный зонд на 1-3-й день и дренажи на 7-8 день.
— Возобновление питания: разрешите глотки жидкости с 3-4-го дня, твердая диета после первого послеоперационного стула, приблизительно с 7-го дня.
— Функция кишечника: возможен прием легких пероральных слабительных средств в течение первых недель после возвращения функции кишечника.
— Активизация: сразу же.
— Физиотерапия: дыхательные упражнения.
— Период нетрудоспособности: 2-3 недели.
л) Этапы и техника радикальной резекции сигмовидной кишки:
1. Объем резекции
2. Реконструкция
3. Высокая диссекция сосудов
1. Объем резекции. Радикальная резекция сигмовидной кишки включает удаление сигмовидной кишки и проксимального сегмента прямой кишки, корня брыжейки у места отхождения нижней брыжеечной артерии от аорты и дистального сегмента нисходящей ободочной кишки.
2. Реконструкция. Восстановление непрерывности кишки в виде анастомоза между нисходящей ободочной и прямой кишкой в большинстве случаев требует мобилизации селезеночного изгиба. Отличие от левосторонней гемиколэктомии заключается в сохранении левого изгиба и левой части поперечно-ободочной кишки.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Операция гартмана на сигмовидной кишке
КТ изменения после операции на толстой кишке
Оперативное лечение часто применяется при различных заболеваниях ободочной и прямой кишки доброкачественной и злокачественной природы, таких как воспалительная болезнь кишечника (ВБК), дивертикулиты, полипоз кишечника, а также колоректальный рак. Техника операции напрямую зависит от тяжести заболевания и от объема поражения кишечника. Современные методики оперативного вмешательства включают в себя сегментарную резекцию, радикальную резекцию, а также сфинктер-сохраняющие операции.
а) Варианты резекции ободочной и прямой кишок. Под сегментарной резекцией подразумевается удаление короткого участка ободочной кишки с последующим созданием анастомоза между проксимальной и дистальной культей. Если оперативное вмешательство выполняется по поводу заболевания злокачественной природы, в дополнение к расширенной колэктомии требуется удаление брыжейки пораженного участка ободочной кишки, а также регионарных лимфоузлов.
1. Сегментарная резекция. Сегментарная резекция — это хирургическое вмешательство, при котором удаляется участок ободочной кишки, пораженный заболеванием. Непрерывность ободочной кишки восстанавливается путем наложения анастомоза «конец в конец», «конец в бок», или «бок в бок». Тип сегментарной резекции зависит от локализации патологических изменений: выделяют илеоцекальную резекцию, а также право-, левостороннюю и поперечную колэктомию.
Илеоцекальная резекция, которую обычно используют в качестве способа лечения при болезни Крона, включает в себя удаление терминальных отделов подвздошной кишки и слепой кишки с созданием подвздошно-ободочного анастомоза. При правосторонней колэктомии или гемиколэктомии удаляются терминальные отделы подвздошной кишки, слепая кишка, восходящая ободочная кишка, а также проксимальные отделы поперечной ободочной кишки, после чего создается анастомоз между подвздошной и поперечной ободочной кишкой. Это вмешательство обычно выполняется при раке слепой и восходящей ободочной кишки. При раке печеночного изгиба ободочной кишки лечение обычно подразумевает расширенную правостороннюю колэктомию. Поперечная колэктомия, сегментарная резекция поперечной ободочной кишки могут использоваться при раке с локализацией в средних отделах поперечной ободочной кишки. Левосторонняя колэктомия или гемиколэктомия подразумевает удаление селезеночного изгиба, нисходящей ободочной кишки, а также проксимальных отделов сигмовидной кишки, с последующим формированием анастомоза между поперечной ободочной кишкой и дистальными отделами сигмовидной кишки. Это вмешательство в целом применяется при опухолях, расположенных в дистальных отделах поперечной ободочной кишки или в нисходящей ободочной кишке.
Данные лучевых методов диагностики после сегментарной резекции включают в себя отсутствие визуализации удаленных сегментов кишечника; наличие хирургических клипс, которые обычно непрозрачны для рентгеновских лучей; а также перемещение ближайших органов в «освободившуюся» после операции область.
2. Операция Гартмана. Операция Гартмана подразумевает формирование колостомы после дистальной колэктомии или сигмоэктомии и закрытие культи дистальных отделов ободочной или прямой кишки. Вмешательство часто выполняется в экстренных случаях, например, при осложненном дивертикулите, перфорации сигмовидной кишки, обструктивном раке ободочной кишки, если при немедленном формировании анастомоза велик риск нарушения его герметичности.
3. Передняя резекция. При передней резекции удаляется ректосигмоидный отдел толстой кишки и создается анастомоз между нисходящей ободочной и прямой кишкой. Эта операция используется в качестве метода оперативного лечения по поводу рака верхней и средней трети прямой кишки. Передняя резекция подразделяется на три основных типа:
(1) высокая передняя резекция, при которой удаляются дистальные отделы нисходящей ободочной кишки, сигмовидная кишка и верхние отделы прямой кишки выше области, покрытой брюшиной;
(2) низкая передняя резекция (НПР), которая подразумевает удаление ректосигмоидного отдела толстой кишки вплоть до средних отделов прямой кишки, ниже уровня брюшины; и
(3) расширенная или ультранизкая передняя резекция, сфинктер-сохраняющая операция, при которой происходит удаление дистальных отделов сигмовидной кишки и прямой кишки вплоть до ее дистальных отделов (Schwartz и Brunicardi, 2010). В случае нижней передней резекции, тотальной мезоректумэктомии, тотальная резекция брыжейки средних и нижних отделов прямой кишки необходима для полного удаления путей оттока лимфы внутри мезоректальной фасции.
4. Брюшно-промежностная резекция (БПР). Брюшно-промежностная резекция или операция Майлса предполагает удаление сигмовидной, прямой кишки, полное удаление ануса, с последующим формированием постоянной колостомы. Показанием для этого вмешательства является рак нижних отделов прямой кишки, злокачественные опухоли анальной области, а также осложнения воспалительных заболеваний кишечника с локализацией в прямой кишке и в анальной области. В настоящее время брюшно-промежностная резекция выполняется не так часто из-за успехов сфинктер-сохраняющих операций и адъювантной терапии, в т.ч. лучевой. Тем не менее, БПР до сих пор считается лучшим методом лечения пациентов с распространенным поражением анальных сфинктеров, недержанием кала, а также пациентов с воспалительной болезнью кишечника на завершающих стадиях.
5. Тотальная колэктомия. Тотальная колэктомия, при которой ободочная кишка удаляется целиком, после чего создается анастомоз между терминальными отделами подвздошной кишки и прямой кишкой, показана при заболеваниях с диффузным поражением ободочной и прямой кишки, таких как язвенный колит и семейный аденоматозный полипоз (САП). Однако тотальная колэктомия не является методом лечения, устраняющим причину болезни, поскольку рецидив заболевания может произойти в прямой кишке, которая не удаляется.
6. Ресторативная проктоколэктомия с созданием подвздошно-анального резервуарного анастомоза. Эта операция предусматривает удаление ободочной и прямой кишки целиком (тотальная проктоколэктомия) с формированием резервуара из подвздошной кишки и созданием анастомоза между этим резервуаром и анусом вдоль зубчатой линии. Это вмешательство является методом выбора в лечении по поводу язвенного колита, САП, наследственного неполипозного колоректального рака, направленным непосредственно на устранение заболевания. Подвздошный резервуар выполняет накопительную функцию. Обычно его создают похожим на букву J (из-за чего он называется J-резервуаром). Несмотря на низкий уровень смертности (ниже 1%), операции по созданию подвздошно-анального резервуарного анастомоза характеризуются высоким уровнем заболеваемости, обусловленной вмешательством, в пределах 18-70% (Beliard и Prudhomme, 2010). Самым частым осложнением операции является неспецифическое воспаление резервуара, сформированного из подвздошной кишки, возникающее у (вплоть до) 50% пациентов, особенно у тех, которым операция была выполнена по поводу язвенного колита (Wu и Shen, 2010).
б) Типичные лучевые признаки послеоперационных изменений со стороны ободочной кишки. В ближайшем постоперационном периоде могут обнаруживаться скопления стерильной жидкости реактивного характера. Большинство из них не являются инкапсулированными и располагаются в областях не измененной анатомии либо в зоне оперативного вмешательства. Пневмоперитонеум — другая частая находка — обычно разрешается через несколько дней после операции. Если через неделю, прошедшую с момента операции, пневмоперитонеум сохраняется, либо количество свободного газа увеличивается, при условии отсутствия дренирования брюшной полости или расхождения краев операционной раны, это позволяет предположить нарушение герметичности анастомоза либо перфорацию полого органа (Ghahremani и Gore, 1989).
В течение двух месяцев после передней резекции или низкой передней резекции обычно обнаруживаются скопления жидкости либо мягкотканный компонент в пресакральной области или по средней линии (DuBrow et al., 1995). Пресакральное пространство может быть расширено и прямая кишка определяться до 2 см кпереди от крестца (Weinstein et al., 2013). Скопления жидкости или газа вне полости брюшины по ходу подвздошных сосудов обычно являются «доброкачественной» находкой и исчезают в течение нескольких месяцев (DuBrow et al., 1995).
После брюшно-промежностной резекции оставшиеся органы малого таза (мочевой пузырь, матка, семенные пузырьки, а также тонкая кишка) обычно смещаются кзади в область, находящуюся перед крестцом или копчиком. Наличие мягкотканного компонента в пресакральной области является другой частой находкой, отображающей послеоперационные изменения в виде фиброза или грануляционной ткани. Они могут обнаруживаться в течение первых 4-6 месяцев после операции и существовать до двух лет и дольше (Kelvin et al., 1983).
Редактор: Искандер Милевски. Дата публикации: 27.5.2019
Операция гартмана на сигмовидной кишке
Введение
Циркулярные сшивающие аппараты фирм Johnson & Johnson диаметром 29 мм и Auto Suture 28 и 31 мм использовали при выполнении всех низких ПРПК (30 чел.), восстановлении пассажа по толстой кишке с анастомозом на глубине менее 10 см от ануса (2 чел.). У 60 пациентов аппаратный анастомоз был наложен на уровне или выше тазовой брюшины после ПРПК, резекции сигмовидной кишки и при восстановлении пассажа после обструктивной резекции.
Таблица 1. Виды операций на толстой кишке
Способ наложения анастомоза
Сшивающим циркулярным аппаратом
Резекция сигмовидной кишки
Восстановление пассажа по ободочной кишке после обструктивной резекции
Передняя резекция прямой кишки
Низкая передняя резекция прямой кишки
Традиционный «ручной» анастомоз был выполнен 87 больным в основном после выполнения гемиколонэктомии слева, резекции сигмовидной кишки и при восстановлении пассажа по толстой кишке, реже после ПРПК с анастомозом на уровне не менее 12 см от ануса. Еще шести пациентам после брюшно-анальной резекции был наложен «ручной» сигмоанальный анастомоз. Разгрузочные колостомы были сформированы в 45 случаях. Показанием к их наложению послужили плохая предоперационная подготовка кишки, колоанальный анастомоз, технические трудности при формировании толстокишечного соустья, выраженное ожирение, тяжелый спаечный процесс брюшной полости.
У 4 больных (57,1 %) третьей группы были диагностированы стриктуры сигмоанального анастомоза с сужением просвета кишки до 7-8 мм. Клинических проявлений обструктивного синдрома не было, так как у всех была наложена проксимальная разгрузочная колостома. Также у всех четырех ранний послеоперационный период после брюшно-анальной резекции осложнился несостоятельностью сигмоанального анастомоза. Одному удалось провести бужирование стриктуры с положительным эффектом, еще одной больной выполнить операцию типа Гартмана. Двоим пациентам произведена лишь реконструкция проксимальной двуствольной колостомы.
По нашим данным, из девяти диагностированных рубцовых стриктур шесть были клинически значимыми, а четыре сформировались на фоне несостоятельности колоанального анастомоза при выполнении брюшно-анальной резекции (таб. 3).
Таблица 3. Влияние несостоятельности, типа анастомоза на формирование стриктур толстокишечных анастомозов
Пациенты без НА
Резекция сигмовидной кишки
Восстановление пассажа по ободочной кишке после операции Гартмана
Формирование стриктур толстокишечных анастомозов, а также их лечение становится актуальной проблемой в связи с увеличением количества операций на толстой кишке с первичным восстановлением пассажа. При ручном лигатурном шве в зоне анастомоза на определенный срок остается шовный материал, что приводит к инфицированию стенок кишки, развитию воспаления с образованием микроабсцессов, что в последующем способствует рубцеванию, сужению и деформации анастомоза [1, 3]. По данным литературы, все это присуще и механическому шву, так как скрепка, хотя и в меньшей степени, обладает теми же свойствами, что и нить [4]. Некоторые авторы отмечают, что образование рубцовых стриктур не зависит от пола, возраста, характера заболевания, но коррелирует с уровнем анастомоза, способом его наложения и опытом хирурга [7]. Чем ниже анастомоз, тем больше стриктур.
Для лечения стриктур возможно применение эндоскопических методик, среди которых наиболее эффективной признается дилятация зоны анастомоза, однако положительный эффект возникает лишь у части больных. Около половины пациентов требуют повторного оперативного вмешательства, которое, в связи с наличием выраженного спаечного процесса в малом тазу, связано с техническими трудностями [5]. Мы также убедились в преимуществах эндоскопического бужирования, хотя в 44 % случаев из-за значительного сужения потребовалось выполнение повторных реконструктивных операций.
Выводы
Операция гартмана на сигмовидной кишке
Показания, этапы, техника гемиколэктомии слева
а) Показания для гемиколэктомии слева:
— Плановые: патологическое поражение ободочной кишки между селезеночным изгибом и прямой кишкой.
— Альтернативные операции: суб-/тотальная колэктомия, резекция сигмовидной кишки. Лапароскопическая операция.
б) Предоперационная подготовка:
— Предоперационные исследования: эндоскопия с биопсией, рентгеноконтрастное исследование; исключение отдаленных метастазов злокачественной опухоли: ультразвуковое исследование, компьютерная томография, возможно урологическое обследование.
— Подготовка пациента: ортоградный лаваж кишки, катетеризация центральной вены, периоперационная антибиотикотерапия, катетеризация мочевого пузыря.
в) Специфические риски, информированное согласие пациента:
— Несостоятельность анастомоза (менее 5% случаев)
— Травма селезенки (менее 5% случаев)
— Повреждение мочеточника (менее 1% случаев)
— Расхождение раны (менее 5% случаев)
г) Обезболивание. Общее обезболивание (интубация).
д) Положение пациента. Лежа на спине, возможно модифицированное литотомическое положение по Ллойду-Дэвису (позволяет использовать сшивающий аппарат).
е) Оперативный доступ при гемиколэктомии слева. Срединная лапаротомия. Возможно продление разреза выше пупка косо к левому реберному краю для мобилизации селезеночного изгиба. Может быть выполнена лапароскопическая мобилизация селезеночного изгиба, сопровождаемая резекцией прямой кишки во время открытой операции.
ж) Этапы операции:
— Объем резекции
— Реконструкция после левосторонней гемиколэктомии
— Доступ
— Мобилизация сигмовидной кишки
— Диссекция корня брыжейки
— Высокое пересечение сосудов
— Мобилизация проксимальных отделов прямой кишки
— Рассечение мезоректум
— Мобилизация селезеночного изгиба I
— Мобилизация селезеночного изгиба II
— Разделение желудочно-ободочной связки
— Дистальное пересечение
— Скелетизация брыжейки
— Проксимальное пересечение
— Дилатация проксимальной кишки
— Аппаратный шов I
— Срабатывание сшивающего устройства
— Аппаратный шов II
— Дистальное пересечение
— Скелетизация брыжейки
— Проксимальное пересечение
— Дилатация проксимальной кишки
— Аппаратный шов I
— Срабатывание сшивающего устройства
— Аппаратный шов II
и) Меры при специфических осложнениях. Несостоятельность анастомоза: если место операции хорошо дренируется, примените выжидательную тактику при парентеральном питании до самопроизвольного закрытия свища; при любых признаках перитонита выполните релапаротомию и создайте отводящую стому или снимите анастомоз, закройте прямую кишку как слепую культю, и наложите концевую коло-стому (операция Гартмана).
к) Послеоперационный уход:
Медицинский уход: удалите назогастральный зонд на 1-3-й день и дренажи на 7-8-й день. Возможно продолжение периоперационной антибиотикотерапии.
Возобновление питания: разрешите глотки жидкости с 3-4-го дня, твердая пища после первого послеоперационного стула, приблизительно с 7-го дня.
Функция кишечника: могут быть назначены умеренные пероральные слабительные средства в течение первых недель после восстановления функции кишечника Физиотерапия: дыхательные упражнения.
Период нетрудоспособности: 2-3 недели.
л) Этапы и техника гемиколэктомии слева:
1. Объем резекции
2. Реконструкция после левосторонней гемиколэктомии
3. Доступ
4. Мобилизация сигмовидной кишки
5. Диссекция корня брыжейки
6. Высокое пересечение сосудов
7. Мобилизация проксимальных отделов прямой кишки
8. Рассечение мезоректум
9. Мобилизация селезеночного изгиба I
10. Мобилизация селезеночного изгиба II
11. Разделение желудочно-ободочной связки
12. Дистальное пересечение
13. Скелетизация брыжейки
14. Проксимальное пересечение
15. Дилатация проксимальной кишки
16. Аппаратный шов I
17. Срабатывание сшивающего устройства
18. Аппаратный шов II
1. Объем резекции. Обширные опухоли сигмовидной и нисходящей ободочной кишки требуют левосторонней гемиколэктомии, то есть, резекции от середины поперечно-ободочной кишки до проксимальных отделов прямой кишки с включением всех лимфатических путей вдоль нижней брыжеечной артерии. Также удаляется левая половина большого сальника, но описание этого этапа операции будет опущено как очевидное.
2. Реконструкция после левосторонней гемиколэктомии. Восстановление непрерывности после левосторонней гемиколэктомии требует обширной мобилизации поперечно-ободочной кишки, в некоторых случаях до печеночного изгиба.
3. Доступ. Эффективна нижняя срединная лапаротомия с возможным продлением разреза вокруг пупка к левому верхнему отделу брюшной полости и, в зависимости от анатомической ситуации, до реберного края.
4. Мобилизация сигмовидной кишки. После вскрытия брюшной полости вводится рамка Голайера, дающая хорошую визуализацию операционного поля. Сигмовидная ободочная кишка захватывается либо двумя зажимами Дюваля, либо руками и смешается медиально. Боковые прикрепления сигмовидной кишки к брюшной стенке разделяются ножницами и пинцетом вдоль так называемой белой линии. Диссекция производится здесь в основном в бессосудистом слое; сосудистые структуры забрюшинного пространства остаются нетронутыми.
5. Диссекция корня брыжейки. Содержащий опухоль сегмент кишки перекрывается проксимально и дистально затянутыми резиновыми петлями, чтобы предотвратить внутрипросветное распространение опухолевых клеток. Корень брыжейки мобилизуется вдоль сосудов до места их отхождения от аорты. Мочеточник, который пересекает подвздошные и яичниковые/семенные сосуды спереди, должен быть обнаружен и защищен.
6. Высокое пересечение сосудов. Полная мобилизация брыжейки позволяет определенно идентифицировать место отхождения нижней брыжеечной артерии и проследить нижнюю брыжеечную вену до нижнего края поджелудочной железы. Оба сосуда пересекаются между зажимами Оверхольта и перевязываются с прошиванием. Обработка этих сосудов сопровождается рассечением париетальной брюшины до малого таза и далее кпереди между задней стенкой мочевого пузыря и передней стенкой прямой кишки.
7. Мобилизация проксимальных отделов прямой кишки. После завершения кругового рассечения брюшины дна таза краниальные части боковых связок рассекаются между зажимами Оверхольта и перевязываются с прошиванием.
При необходимости прямая кишка может быть также частично отделена от стенок таза. Диссекция ведется при тщательной защите предкрестцовых вен и нервных сплетений в бессосудистом слое.
8. Разделение мезоректум. Мезоректум также захватывается между зажимами Оверхольта и поэтапно пересекается. Только тщательная диссекция позволит, с одной стороны, добиться хорошего бескровного операционного поля, а с другой стороны, не нарушит кровоснабжения сегмента кишки, который предполагается использовать для анастомоза.
9. Мобилизация селезеночного изгиба I. Мобилизация селезеночного (левого) изгиба требует разделения диафрагмально-ободочной связки, при этом нужно избегать повреждения нижнего полюса селезенки. Чтобы обеспечить точную экспозицию этой области, необходим дополнительный ретрактор. Для реконструкции без натяжения необходимо полностью освободить и сместить медиально селезеночный изгиб ободочной кишки.
10. Мобилизация селезеночного изгиба II. Чтобы обнаружить связочные структуры в области селезеночного изгиба, пересечь их между зажимами Оверхольта и перевязать, нисходящая ободочная кишка и левая половина поперечно-ободочной кишки должны быть смещены в медиальном направлении.
11. Разделение желудочно-ободочной связки. Для обнажения и пересечения левой желудочно-ободочной связки требуется осторожная тракция левой части поперечноободочной кишки в каудальном направлении. Особую осторожность следует соблюдать, чтобы не повредить селезенку и хвост поджелудочной железы. По завершении этой диссекции мобилизованной оказывается вся левая половина ободочной кишки от середины ободочной кишки до прямой кишки.
12. Дистальное пересечение. Если предполагается наложение аппаратного анастомоза, накладывается кисетный шов. После наложения зажима для кисетного шва и изогнутого под прямым углом зажима проксимальнее него кишка ниже границы препарата обкладывается брюшными тампонами, смоченными дезинфицирующим раствором и пересекается изогнутыми ножницами. Для ручного анастомоза пересечение производится между раздавливающим (проксимальным) и нераздавливающим (дистальным) зажимами.
13. Скелетизация брыжейки. Степень скелетизации брыжейки определяется требуемым объемом резекции. Основным ориентиром является место пересечения нижней брыжеечной артерии. Мочеточник и забрюшинные сосуды должны тщательно предохраняться.
15. Дилатация проксимальной кишки. Проксимальная часть кишки достаточно широко расширяется двумя корнцангами, так чтобы головка циркулярного сшивающего аппарата могла быть введена без затруднений. Кисетный шов должен проверяться и, при необходимости, подкрепляться.
17. Срабатывание сшивающего устройства. Сшивающее устройство активируется при достаточном натягивании проксимальной кишки и, в то же время, при управляемом усилии на рукоятках инструмента. В ходе этого маневра хирург должен быть уверен в том, что сегменты кишки правильно ориентированы для анастомоза. После того как помощник сообщил о полном закрытии сшивающего аппарата, область вокруг анастомоза еще раз исследуется для выявления интерпозиции смежных структур или дефектов, которые, возможно, возникли на этом этапе операции.
18. Аппаратный шов II. После прошивания устройство частично открывается на два полуоборота и извлекается осторожными вращательными движениями, сопровождаемыми управляемой противотягой на проксимальном конце кишки. За этим следует повторный осмотр области анастомоза. Водонепроницаемость анастомоза подтверждается введением в прямую кишку раствора повидон-йодина. С этой целью хирург рукой закрывает просвет кишки с проксимальной стороны, после чего вводится 100-200 мл раствора до появления в области анастомоза выпуклости.
Любые утечки закрываются отдельными швами. Может быть выполнена интраоперационная эндоскопия. Операция завершается введением двух дренажей, послойным закрытием брюшной стенки и установкой активного дренажа в подкожную клетчатку.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Операция гартмана на сигмовидной кишке
Показания, этапы, техника лапароскопической резекции сигмовидной кишки
а) Показания для лапароскопической резекции сигмовидной кишки:
— Плановые: дивертикулез в отсуствии признаков дивертикулита сигмовидной кишки.
— Альтернативные вмешательства: открытая техника при перфорации, абсцессе.
б) Специфические риски, информированное согласие пациента. Как и при открытой резекции. Возможен переход к открытому доступу.
в) Обезболивание. Общее обезболивание (интубация).
г) Положение пациента. Лежа на спине, модифицированное литотомическое положение Ллойду-Дэвису.
д) Оперативный доступ при лапароскопической резекции сигмовидной кишки. Непосредственно над пупком или на 4-5 см выше него устанавливается троакар для камеры, два рабочих троакара вводятся в правой боковой и правой подвздошной области, сигмовидная кишка извлекается через небольшой разрез по Пфанненштилю. Возможно введение четвертого троакара в левой боковой области живота для мобилизации левого изгиба.
е) Этапы операции:
— Создание пневмоперитонеума
— Размещение рабочих троакаров
— Разделение спаек. Мобилизация сигмовидной/нисходящей ободочной кишки
— Обнаружение и предохранение левого мочеточника
— Определение объема резекции
— Диссекция брыжеечного окна
— Циркулярная диссекция ректосигмоидного отдела
— Дистальное пересечение кишки сшивающим аппаратом Endo-GIA
— Трубчатая скелетизация сигмовидной брыжейки с помощью UltraCision или эндоклипера
— Разрез по Пфанненштилю и извлечение сигмовидной кишки
— Резекция кишки и затягивание шва вокруг головки наковальни циркулярного сшивающего аппарата
— Погружение кишки и закрытие разреза по Пфанненштилю
— Трансанальное введение циркулярного сшивающего аппарата
— Соединение сшивающего устройства
— Создание анастомоза
— Испытание на водонепроницаемость
— Удаление троакаров и закрытие разрезов
ж) Анатомические особенности, серьезные риски, оперативные приемы:
— Для введения первого троакара после предыдущей операции всегда используйте открытую технику.
— Переместите камеру для мобилизации левого изгиба ободочной кишки и подумайте об использовании дополнительного троакара в левой боковой области живота.
— Мобилизуя брыжейку сигмовидной кишки, проксимально идентифицируйте левый мочеточник.
з) Меры при специфических осложнениях:
— При плохой визуализации из-за обширных спаек или при наличии продолжающегося воспаления вовремя перейдите к открытому доступу.
— Остальное, см. статью по открытой резекции сигмовидной кишки.
и) Послеоперационные мероприятия:
— Медицинский уход: удалите назогастральный зонд на 1-й день и дренажи, если они использовались, на 7-й день.
— Возобновление питания: разрешите глотки жидкости с 1-го дня, расширяйте диету при возобновлении перистальтических шумов.
— Физиотерапия: дыхательные упражнения.
— Период нетрудоспособности: 2-3 недели.
к) Этапы и техника лапароскопической резекции сигмовидной кишки:
1. Расположение пациента
2. Положение троакаров
3. Мобилизация ободочной кишки
4. Диссекция ректосигмоидного отдела
5. Пересечение ректосигмоидного отдела
6. Скелетизация брыжейки сигмовидной кишки
7. Извлечение сигмовидной кишки
8. Погружение кишки
9. Трансанальное введение циркулярного сшивающего аппарата
10. Создание анастомоза
3. Мобилизация ободочной кишки. Натяните сигмовидную кишку и разделите боковые врожденные сращения. Затем рассеките брюшину, идентифицируйте левый мочеточник и мобилизуйте брыжейку сигмовидной кишки и нисходящую ободочную кишку. Возможна мобилизация левого изгиба.
4. Диссекция ректосигмоидного отдела. Разрез брюшины в полости малого таза начинается с левой стороны. После этого следует правосторонний разрез и формирование брыжеечного окна. Затем справа с помощью ультразвукового инструмента выполняется циркулярная диссекция дистального края резекции.
5. Пересечение ректосигмоидного отдела. После циркулярной диссекции кишка пересекается сшивающим аппаратом Endo-GIA.
6. Скелетизация брыжейки сигмовидной кишки. Затем проводится скелетизация брыжейки сигмовидной кишки с помощью UltraCision или, после раздельного выделения сосудов, между эндоклипсами. Диссекция может выполняться близко к стенке кишки (то есть верхняя прямокишечная артерия может быть сохранена). До точной идентификации мочеточ ника следует соблюдать особую осторожность.
7. Извлечение сигмовидной кишки. Выполняется разрез по Пфанненштилю и кишка извлекается. Завершается диссекция брыжейки сигмовидной кишки (предостережение: основная диссекция брыжейки сигмовидной кишки, должна быть проведена интраабдоминально, диссекция после выведения кишки не имеет никаких преимуществ). Накладывается кисетный шов и сигмовидная кишка резецируется.
8. Погружение кишки. Вокруг головки наковальни сшивающего аппарата накладывается кисетный шов, и кишка погружается в брюшную полость. Разрез по Пфанненштилю ушивается, вновь накладывается пневмоперитонеум.
9. Трансанальное введение циркулярного сшивающего аппарата. Трансанально вводится циркулярный сшивающий аппарат, и линия скобочного шва на прямой кишке протыкается копьем настолько близко к центру, насколько это возможно. Из брюшной полости устройство может направляться при помощи двух тупферов.
10. Создание анастомоза. Сшивающее устройство соединяется таким образом, чтобы не перекрутить проксимальный сегмент кишки.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Операция гартмана на сигмовидной кишке
В статье представлен непосредственный результат операции по устранению концевой колостомы. Пациентка, 44 лет, во время ДТП получила закрытую травму живота с разрывом сигмовидной кишки. При оказании экстренной помощи была выполнена резекция поврежденного участка толстой кишки с формированием концевой колостомы по типу операции Гартмана. В декабре 2016 г. произведена реконструктивно-восстановительная лапароскопически-ассистированная операция по ликвидации сигмостомы с наложением анастомоза конец в конец. Предварительный анализ полученных данных показал, что выполнение реконструктивно-восстановительных вмешательств лапароскопическим способом не оказывает отрицательного влияния на результаты хирургического лечения пациентов с одноствольными колостомами и обеспечивает у них уменьшение выраженности болевого синдрома, раннюю реабилитацию и улучшение качества жизни.
УЗ «Вторая Витебская областная клиническая больница»
УЗ «Витебский областной клинический специализированный центр», Витебск, Республика Беларусь
Актуальность
Внедрение лапароскопических технологий в колоректальную хирургию получает все большее распространение как в дальнем зарубежье, так и на постсоветском пространстве [1, 2]. Такие операции малотравматичны, относительно безопасны, позволяют выполнить полный объем вмешательства, в том числе с онкологических позиций. Вместе с тем лапароскопические операции технически сложнее, продолжительнее по времени, требуют дополнительного обучения персонала и наличия соответствующего оборудования [3—5]. Лапароскопические реконструктивно-восстановительные операции при колостомах не являются исключением [6—9]. Так, к примеру, С.А. Афендулов и В.С. Введенский [1] сообщают о выполнении 198 операций по закрытию колостомы с восстановлением естественного пассажа по толстой кишке у больных, оперированных по поводу хирургических заболеваний и травм, — 84 (42,4%) женщин и 114 (57,6%) мужчин. Возраст больных варьировал от 18 до 83 лет. Операции с целью восстановления естественного пассажа выполнялись из местного доступа после иссечения стомы, из традиционной срединной лапаротомии, а также в лапароскопически-ассистируемом варианте — с использованием «руки помощи». Подход к выбору хирургического доступа был строго индивидуальным и зачастую диктовался не основной патологией, послужившей причиной для формирования колостомы, а характером первичной операции, анатомо-топографическим взаимоотношением проксимального и дистального отрезков толстой кишки, наличием послеоперационной срединной грыжи, результатами обследования [1, 3]. Из местного доступа прооперированы 148 (74,8%) больных, из них по поводу двуствольных колостом в одной анатомической зоне брюшной стенки 80 (54,1%), концевой колостомы 68 (45,9%). Из данной категории пациентов у 19 (12,8%) произведено закрытие колостом лапароскопически с использованием «руки помощи»: у 12 при одноствольной стоме, у 7 при двуствольной колостоме [4, 6, 9]. Срединная лапаротомия использовалась у 50 (25,2%) больных, причем при закрытии одноствольных концевых колостом — у 37 (74%), при двуствольных — у 13 (26%). Формирование межкишечных анастомозов производилось двухрядным ручным способом конец в конец у 119 (60,2%) пациентов и с использованием циркулярных сшивающих степлеров ЕЕА, SEEA и СПТУ — у 79 (39,8%) [1, 2, 10]. С целью улучшения результатов восстановительных операций разработан и применен алгоритм лечебно-диагностических мероприятий, где принципиальными моментами являются создание оптимальных условий для повторной операции по закрытию колостомы уже на этапе обструктивной резекции путем выполнения необходимой мобилизации толстой кишки; фиксация культи при формировании концевой колостомы; профилактика развития осложнений колостомии, определение оптимального срока для выполнения реконструктивно-восстановительных операций; использование рационального хирургического доступа; адекватная психоэмоциональная подготовка больных [2, 3]. При полном соблюдении разработанного алгоритма и тактики ведения больных до и после выполнения реконструктивно-восстановительных операций по закрытию колостомы удалось добиться снижения количества всех послеоперационных осложнений на 14,3%, осложнений со стороны межкишечных анастомозов в виде несостоятельности на 4,3%, снизить послеоперационную летальность на 3,7%, увеличить показатель хороших и удовлетворительных отдаленных результатов до 89,3% [1].
Впервые лапароскопическая операция на толстой кишке была описана в 1991 г. (M. Jacobs и соавт.) [11]. Несмотря на это, в нашей стране подобные операции не получили широкого распространения и тем более не стали «золотым стандартом», таким как лапароскопическая холецистэктомия (1987 г.), в практике общего хирурга. Практический опыт в колоректальной хирургии говорит о необходимости создания достаточного для выполнения резекции и формирования анастомоза доступа. Наиболее «простой» и очевидный доступ — это, безусловно, широкая срединная лапаротомия. Этот травматичный доступ обусловлен не только необходимостью четкой визуализации органов таза, но и, например, мобилизацией селезеночного угла и поперечной ободочной кишки для формирования низких колоректальных анастомозов. Таким образом, указанный доступ нужен лишь для проникновения в различные отделы брюшной полости. Большой разрез является причиной выраженного болевого синдрома, снижения мобильности пациента, отсроченного появления перистальтики, увеличения сроков госпитализации и временной нетрудоспособности, а также ухудшения косметических результатов. Имеются указания на более частое появление раневой инфекции и послеоперационных грыж после лапаротомий. Различными исследованиями доказано, что срединная лапаротомия играет ведущую роль как травматический фактор в абдоминальной хирургии. Показатели физиологических маркеров воспаления заметно выше при лапаротомном оперативном доступе в сравнении с лапароскопическим [3—5]. Лапароскопическое вмешательство вместе с тем не является самоцелью, а выступает лишь как способ лечения, имеет свои недостатки и несомненные преимущества. В настоящее время в малоинвазивной колоректальной хирургии наиболее часто выполняются резекции по поводу опухолей, неспецифического язвенного колита, болезни Крона, ректопексии, при трансанальной эндоскопической микрохирургии. Следует отметить, что количество таких операций невелико, как и специалистов, их выполняющих. Для сравнения: в скандинавских странах количество лапароскопических вмешательств достигает 50—60%, в США — 25—30% от всех операций по поводу колоректального рака [2, 5].
Отдельную группу составляют пациенты, перенесшие по экстренным показаниям резекцию пораженного участка кишки с выведением стомы. У части таких больных стома остается пожизненно, остальные же нуждаются в проведении реконструктивно-восстановительных операций. Подавляющее большинство вмешательств по восстановлению непрерывности кишечника выполняется посредством релапаротомии. При этом раневая инфекция возникает в 4—24% случаев, несостоятельность анастомоза достигает 12%, летальность — 4% [1, 2, 5, 6]. Применение лапароскопических технологий для выполнения реконструктивно-восстановительных операций у стомированных больных, по данным литературы, дает частоту возникновения раневой инфекции 14%, несостоятельности анастомоза 3,6%. При этом частота конверсии не превышает 15% и, вероятно, будет снижаться по мере накопления опыта хирургами [5, 6].
Кроме вышеуказанных преимуществ, применение лапароскопии у стомированных больных, перенесших ранее лапаротомию в ходе инициального вмешательства, может оказаться более привлекательным для пациентов. В то же время неизбежно развивающийся спаечный процесс, измененные анатомические взаимоотношения в брюшной полости, вероятно, сдерживают многих врачей от заведомо технически непростой лапароскопической операции по закрытию толстокишечной стомы [2, 6].
Цель исследования — оценить возможность применения лапароскопической техники в закрытии колостомы.
Материал и методы
Пациентка, 44 лет, в июле 2016 г. во время ДТП получила закрытую травму живота с разрывом сигмовидной кишки. На этапе оказания экстренной помощи выполнена резекция поврежденного участка толстой кишки с формированием концевой колостомы по типу операции Гартмана. Далее, 5 декабря 2016 г., пациентка поступила в проктологическое отделение УЗ «Витебский областной клинический специализированный центр» для получения специализированной помощи по закрытию стомы и восстановлению непрерывности кишечника. Пациентка дообследована в необходимом объеме, выполнены эндоскопическое и рентгенологическое обследования ободочной (через сигмостому) и прямой кишки — патологических изменений слизистой оболочки, нарушения проходимости толстой кишки не выявлено. 13 декабря 2016 г. выполнена реконструктивно-восстановительная лапароскопически-ассистированная операция по ликвидации сигмостомы с наложением анастомоза конец в конец.
Пациентку укладывали в положение Тренделенбурга, точно так, как для выполнения лапароскопической мобилизации сигмовидной кишки. Спаечный процесс, неизбежно возникающий после инициального вмешательства, обусловливает особенности наложения пневмоперитонеума. Для получения доступа в брюшную полость мы прибегли к методике H. Hasson (1971). При этом иссекалась часть рубца до 4 см длиной, вскрывался апоневроз, через полученное отверстие под контролем зрения вводили троакар 10 мм и осуществляли инсуффляцию углекислого газа в брюшную полость. При обзорной лапароскопии выявлен выраженный спаечный процесс в зоне срединного рубца, во фланках. Размещение троакаров по мере разделения спаек осуществляли так же, как при резекции левых отделов толстой кишки. Спайки пересекали между большим сальником, тонкой кишкой, желудком и передней брюшной стенкой. Петли тонкой кишки после пересечения спаек смещали кверху из малого таза для обнаружения культи дистальной трети сигмовидной кишки. Культю сигмовидной кишки выделяли из сращений, мобилизовали остаток брыжейки для получения подвижного дистального конца кишки. Стомированный участок ободочной кишки также выделяли, частично мобилизовали селезеночный угол толстой кишки на длину, необходимую для наложения анастомоза. Затем рассекали циркулярным разрезом кожу, подкожную клетчатку, апоневроз и брюшину около стомы. Через отверстие, полученное после выделения стомы, выводили проксимальный и дистальный концы ободочной кишки с наложением ручного анастомоза конец в конец однорядным прецизионным швом. Аппаратный анастомоз не применялся из-за наличия довольно длинного дистального конца, затрудняющего безопасное проведение аппарата по кишке. Зону анастомоза погружали в брюшную полость. Через разрез в правой подвздошной области выведен один контрольный дренаж диаметром 5 мм, который был удален к концу 1-х суток. Дефект брюшной полости и троакарные раны ушиты наглухо.
Результаты и обсуждение
В конце 1-х суток пациентка начала пить жидкость. На 2-е сутки начала вставать. Активно вела себя в палате. Газы отошли на 4-е сутки. Самостоятельный стул получен на 6-е сутки. Швы сняты на 7-е сутки. 23 декабря 2016 г. выписана на амбулаторное лечение.
Лапароскопическое закрытие колостомы и лапароскопическая ректопексия являются операциями из категории малоинвазивной хирургии. Они зачастую переносятся легче, чем резекция толстой кишки, поскольку сопровождаются меньшей препаровкой, травматизацией тканей и при этом не производится удаление кишки.
Для хирургов, только начавших применять лапароскопические методы лечения заболеваний толстой кишки, эти операции следует рассматривать как хороший учебный старт. Кроме того, пациенты, которым выполнено лапароскопическое закрытие колостомы, наглядно ощутили на себе преимущества малоинвазивной хирургии, методом которой им были наложены колостомы.
Выздоровление пациентов после открытых операций, зачастую сопряженное с длительным восстановительным периодом, интенсивным болевым синдромом, повышенным риском возникновения раневой инфекции и уходом за открытыми ранами, является длительным и болезненным процессом. Пациенты, перенесшие лапароскопическое закрытие колостомы, становятся горячими сторонниками и наилучшими защитниками лапароскопических операций.
Несмотря на то что лапароскопический метод вмешательств на толстой кишке пока еще продолжает свое развитие, эта операция, по нашим первым наб-людениям, имеет несомненные достоинства. Длительное наблюдение и анализ результатов позволят определить оптимальные условия проведения подобных операций, сформулировать показания к традиционному и лапароскопическому закрытию колостом, улучшить непосредственные и отдаленные результаты лечения.
Заключение
Операции по восстановлению просвета кишечника с использованием лапароскопической техники выполнимы при условии невыраженного спаечного процесса.
Предварительный анализ показал, что выполнение реконструктивно-восстановительных вмешательств лапароскопическим способом не оказывает отрицательного влияния на результаты хирургического лечения пациентов с одноствольной колостомой. При этом сокращаются время проведения хирургического вмешательства, объем кровопотери. Применение лапароскопически-ассистированного способа реконструктивно-восстановительных вмешательств у больных с колостомой обеспечивает уменьшение выраженности болевого синдрома, раннюю реабилитацию пациентов и улучшение качества жизни.
Незначительный опыт проведения лапароскопически-ассистированных реконструктивно-восстановительных операций и малочисленность наблюдений не позволяют в настоящее время сделать окончательные выводы, однако предполагаемыми результатами нашего исследования являются:
— улучшение качества лечения пациентов с колостомой;
— снижение травматичности оперативного вмешательства;
— уменьшение количества осложнений;
— сокращение сроков стационарного лечения.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Операция гартмана на сигмовидной кишке
Методика левосторонней гемиколэктомии
а) Место проведения. Стационар, операционная.
б) Альтернатива:
• Лапароскопический доступ.
• Расширенная правосторонняя гемиколэктомия (включающая оба изгиба и часть нисходящей кишки).
• Субтотальная резекция или колэктомия (включающая часть или всю сигмовидную кишку).
• Операция Гартмана с длинной культей и концевая илеостома.
в) Показания для левосторонней гемиколэктомии: рак/полипы левых отделов ободочной кишки (селезеночный изгиб, нисходящая кишка).
г) Подготовка:
• Полное обследование толстой кишки во всех плановых случаях, желательна маркировка (татуаж) мелких новообразований.
• Механическая подготовка кишки (традиционно) или без подготовки (развивающаяся концепция).
• Установка мочеточниковых стентов в случаях повторных операций или выраженных анатомических изменений (например, при воспалении).
• Маркировка места наложения стомы.
• Антибиотикопрофилактика.
д) Этапы операции при левосторонней гемиколэктомии:
1. Положение пациента: модифицированное положение для промежностного камнесечения (по предпочтению хирурга).
2. Лапаротомия: среднесрединная.
3. Установка абдоминального ранорасширителя и ручных зеркал для экспозиции левых отделов ободочной кишки.
4. Ревизия брюшной полости: местная резектабельность, вторичные патологические изменения (печень/желчный пузырь, толстая кишка, женские половые органы, тонкая кишка), другие изменения.
13. Ушивание окна в брыжейке.
14. Дренирование обычно не показано. Необходимость в НГЗ отсутствует.
15. Ушивание раны.
е) Анатомические структуры, подверженные риску повреждения: левый мочеточник, яичковые/яичниковые сосуды, селезенка, хвост поджелудочной железы, средняя ободочная артерия.
ж) Послеоперационный период:
• Ведение больных «fast-track»: прием жидкостей на первый послеоперационный день (при отсутствии тошноты и рвоты) и быстрое расширение диеты по мере переносимости.
з) Осложнения левосторонней гемиколэктомии:
• Кровотечение (связанное с хирургическим вмешательством): тракции за селезенку, неадекватное лигирование сосудистой ножки, средняя ободочная артерия.
• Несостоятельность анастомоза (2%): технические ошибки, натяжение, неадекватное кровоснабжение.
• Повреждение мочеточника (0,1-0,2%).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Резекция сигмовидной кишки

Расположение сигмовидной кишки
Название органу дано в связи с тем, что по своей форме он имеет сходство с английской буквой «S». Длина сигмовидного отдела кишечника составляет порядка 55 см. Располагается он в самой нижней части брюшной полости, в непосредственной близости к матке у женщин или мочевого пузыря у мужчин. Поэтому во время операции есть риск случайного повреждения соседних органов. Чтобы избежать такого явления, хирург должен работать максимально аккуратно и предельно точно.
В свою очередь, месторасположение сигмовидной кишки несколько облегчает процесс диагностики. Специалист может выявить некоторые патологии при осмотре пациента и пальпации. Такой диагностический метод позволяет опытному врачу определить перистальтику данного отдела кишечника, его толщину, текстуру и плотность поверхности. Одновременно с этим принимаются в учет ощущения пациента во время пальпации – боли и дискомфорт подтверждают предположение о патологиях сигмовидной кишки.
При отсутствии отклонений толщина кишки составляет около 2,5 см, плотность средняя или выше средней, без повышенной перистальтики. Если в ходе осмотра врач выявит уплотнения или наличие новообразований, то обязательно будут назначены дополнительные методы диагностики. Также поводом для более тщательного исследования являются жалобы пациента на боль даже при незначительном надавливании в левой подвздошной ямке.
Для подробной диагностики сигмовидного отдела кишечника в подавляющем большинстве случаев назначается рентгенография или ректороманоскопия. Обязательными являются лабораторные исследования кала, крови и мочи. Пациенты женского пола дополнительно направляются на гинекологический осмотр с целью исключения патологий органов репродуктивной системы, которые по симптомам схожи с воспалительными недугами сигмовидной кишки.
Показания для проведения резекции
Резекция сигмовидной кишки – это удаление части или целого отдела кишечника, составляющего восьмую часть его общей длины. Поэтому операция назначается только в том случае, когда медикаментозная терапия не позволяет достичь выздоровления. Если в результате обследования было выявлено, что причиной болей и плохого самочувствия пациента является сигмоидит (воспаление органа), то ему прописываются антибиотики и лечебная диета. Дополнительно могут быть назначены препараты для устранения симптомов недуга – обезболивающие, жаропонижающие.

Подготовка к операции
Приблизительно за сутки до резекции сигмовидной кишки пациента начинают готовить к процедуре. В первую очередь необходимо полностью очистить кишечник, это является залогом снижения риска развития послеоперационных осложнений. Для очистки могут использоваться специальные слабительные препараты или клизмы, выбор зависит от индивидуальных показателей пациента. Если операция плановая, то за неделю до ее проведения больному показана специальная диета, включающая в себя исключительно жидкие блюда и молочные продукты.
Дополнительно требуется прием препаратов, способствующих стабилизации общего состояния. В их число входят диуретики, ингибиторы, медикаменты, влияющие на артериальное давление и тому подобное. А вот противовоспалительные лекарственные средства стоит отменить за 10-14 дней до операции – они воздействуют на функции тромбоцитов, что влечет за собой изменение характеристик свертываемости крови.
В случае приема пациентом витаминов и БАДов рекомендуется отказаться от них на некоторый промежуток времени.
Просто некоторые активные вещества способны разжижать кровь или влиять на сердечно-сосудистую систему, а это может стать причиной развития осложнений в ходе операции по резекции сигмовидной кишки.
Ход операции
Есть несколько методик выполнения резекции сигмовидной кишки, выбор напрямую зависит от характера и причины патологии. К примеру, пациенту, у которого вследствие врожденной аномалии случился заворот кишок, показана срочная операция по Микуличу или Гартману. В первом случае иссекается отмершая часть кишечника, потом части сигмы сшиваются особым образом и временно фиксируются на брюшной стенке. Через 3-4 месяца, когда пациент восстановился, проводится повторная операция, при которой устраняется свищ, и кишечник получает дооперационную форму, только становится несколько короче.
По методике Гартмана после удаления атрофированного участка кишки проходное отверстие выводится наружу. Такое вмешательство подразумевает намного меньшую нагрузку на организм, но вернуться к привычному образу жизни после него будет невозможно. Поэтому когда пациент окрепнет, может быть назначена операция по формированию кишечника.
При новообразованиях и полипах в средней трети сигмы удаляется весь орган. Сначала хирург через разрез брюшной стенки выводит петли кишки, накладывает анастомоз и иссекает пораженный участок кишечника. Если патология позволяет «обойтись» удалением половины сигмы, то после иссечения оставшиеся части сшивают между собой, что позволяет восстановить естественные функции кишечника.
Период реабилитации
Стоит понимать, что удаление части кишечника влияет на функции ЖКТ в целом. Поэтому в течение восстановительного периода важно соблюдать все врачебные предписания касательно питания. Изначально в рационе будут присутствовать исключительно жидкие блюда, затем постепенно добавляются пюре, каши, твердая еда. Вся пища должна быть легкоусвояемой.
В первые 10 дней после операции показана особенно строгая диета, затем постепенно в рацион добавляется отварная рыба, курица. Добавление новых продуктов весьма похоже на первый прикорм ребенка – требуется пару дней, чтобы проверить реакцию организма на них. В среднем для адаптации кишечника к «новым условиям» необходимо 1,5-2 месяца.
Операция гартмана на сигмовидной кишке
Лечение рака прямой кишки. Операции при раке прямой кишки
Наиболее эффективным при раке прямой кишки является хирургическое лечение, характер которого во многом зависит от локализации опухоли, стадии процесса, общего состояния больного и наличии или отсутствии осложнений. Операции обычно предшествует предоперационная подготовка, направленная на терапию сопутствующих заболеваний, уменьшение раковой интоксикации и освобождение кишечника от содержимого. Всем больным с анемией, гипопротеинемией, гиповолемией переливают кровь, плазму и другие белковые препараты. При дегидратации необходима коррекция водно-электролитного баланса. Для подготовки кишечника больного за 5—7 дней до операции переводят на бесшлаковую диету. За 2 сут назначают слабительные и ставят очистительные клизмы (утром и вечером). Утром в день операции после клизмы в прямую кишку вводят газоотводную трубку для удаления оставшейся жидкости. За 5 дней до операции дают фуразолидон по 0,1 г 4 раза в день или накануне операции невиграмон в течение 20 ч 5 раз по 1 капсуле. Хорошие результаты при подготовке прямой кишки к радикальным операциям могут быть получены при применении так называемых элементных диет.
Радикальные операции при раке прямой кишки могут быть трех основных типов: резекции, экстирпации и ампутации. Резекции заключаются в удалении пораженного сегмента прямой кишки с одно- или двухмоментным восстановлением непрерывности органа. К ним относятся передняя резекция, брюшно-анальная резекция по Хохсисгу и резекция по Гартману. Переднюю резекцию производят при локализации опухоли в ректосигмоидном или верхнеампулярном отделе прямой кишки. Операция состоит в мобилизации и иссечении части сигмовидной и прямой кишок с последующим наложением первичного анастомоза конец в конец. Последний создают вручную двухрядными узловыми швами или с помощью сшивающего аппарата КЦ-28. В результате oпeрации сохраняется запирательная функции анального жома и не нарушается иннервация мочевого пузыря. Брюшно-анальная резекция показана при раке верхне- н средиеампуляриого отделов прямой кишки, нижний край которых находится на высоте 7—8 см от заднепроходного отверстия. Операция включает мобилизацию прямой и сигмовидной кишок с перевязкой нижней брыжеечной артерии дистальнее отхождения левой ободочной.
Важными условиями ее успешного выполнения являются достаточная длина сигмовидной кишки и хорошая васкуляризация последней за счет краевой артериальной дуги. Мобилизованную прямую и сигмовидную кишки низводят через лишенный слизистой оболочки концевой отрезок прямой кишки и фиксируют к коже на уровне анального отверстия. Выведенный наружу сегмент кишки отсекают вместе с опухолью. В ряде случаев при раке проксимального отдела прямой кишки первичная резекция сопряжена с большим риском. В этом случае после резекции отрезка кишки, несущего опухоль, проксимальный конец сигмовидной кишки выводят в виде одноствольного подвздошного ануса, а периферическую культю прямой кишки ушивают наглухо и погружают под тазовую брюшину (операция Гартмана).
Экстирпация прямой кишки (обычная и расширенная) занимает одно из видных мест в хирургическом лечении рака кишки, особенно при локализации опухоли ниже 7 см от ануса. Она позволяет удалить орган, несущий опухоль, в пределах фасциальных футляров с параректальной клетчаткой и лимфатическими узлами. Вместе с прямой кишкой удаляют и ее сфинктерный аппарат. Операция состоит из внутрибрюшного и промежностного этапов, которые выполняются одной или двумя бригадами хирургов. После мобилизации сигмовидной и прямой кишок S-образную кишку пересекают, ее отводящую петлю опускают на дно таза и перитонизируют, а приводящий конец выводят в виде одноствольного ануса. Ампутацию прямой кишки в настоящее время производят но довольно ограниченным показаниям при раке аноректальной области, преимущественно в тех случаях, когда имеются противопоказания к экстирпации.
При неудалимом раке прямой кишки производят паллиативные операции. Они направлены на восстановление проходимости кишки выше опухоли посредством наложения двухствольного противоестественного ануса. С этой целью через небольшой разрез в левой подвздошной области выводят петлю сигмовидной кишки, которую подшивают к брюшине и коже с образованием шпоры. Ее просвет вскрывают сразу, если имеется кишечная непроходимость, или через 24—48 ч при ее отсутствии.
За последние годы при раке прямой кишки сделаны попытки наряду с хирургическим лечением применить лучевое лечение н химиотерапию. Однако полученные при этом данные отличаются большой неоднородностью и требуют дальнейших наблюдений.
За последние годы операбельность рака прямой кишки значительно увеличилась. Радикально оперируется 80% больных: более половины из них живут 5 лет и более.
Операция гартмана на сигмовидной кишке
Показания, этапы, техника гемиколэктомии справа
а) Показания для правосторонней гемиколэктомии:
— Плановые: злокачественные опухоли илеоцекальной области, восходящей ободочной кишки и печеночного изгиба ободочной кишки; доброкачественные поражения восходящей ободочной кишки, при которых менее обширная резекция не допустима.
— Альтернативные операции: илеоцекальная резекция, расширенная правосторонняя гемиколэктомия, субтотальная колэктомия, паллиативная энтероэнтеростомия.
б) Предоперационная подготовка:
— Предоперационные исследования: колоноскопия с биопсией, возможно контрастная рентгенография; исключите отдаленные метастазы: ультразвуковое исследование, возможна компьютерная томография; возможно урологические обследование.
— Подготовка пациента: ортоградный лаваж кишки, катетеризация центральной вены, периоперационная антибиотикотерапия, катетеризация мочевого пузыря; коррекция анемии.
в) Специфические риски, нформированное согласие пациента:
— Недостаточность анастомоза (2% случаев)
— Кровотечение (1% случаев)
— Кишечная непроходимость (2% случаев)
— Раневая инфекция (2-10% случаев)
— Повреждение мочеточника или двенадцатиперстной кишки
г) Обезболивание. Общее обезболивание (интубация).
д) Положение пациента. Лежа на спине.
ж) Этапы операции:
— Объем резекции
— План реконструкции
— Доступ
— Рассечение большого сальника
— Рассечение желудочно-ободочной связки I
— Рассечение желудочно-ободочной связки II
— Мобилизация правой половины ободочной кишки
— Рассечение печеночно-ободочной связки
— Определение краев резекции
— Радикальное удаление брыжейки ободочной кишки
— Линия резекции тонкой кишки
— Линия резекции толстой кишки
— Пересечение поперечно-ободочной кишки
— Пересечение подвздошной кишки
— Анастомоз задней стенки
— Анастомоз передней стенки
— Закрытие дефекта в брыжейке
з) Анатомические особенности, серьезные риски, оперативные приемы:
— Кровоснабжение правой половины толстой кишки обеспечивается подвздошно-ободочной, правой и средней ободочными артериями и венами (краевая аркада).
Правая половина ободочной кишки и правый мочеточник расположены близко друг к другу.
— Резекция большого сальника:
1. Показана при злокачественных опухолях в области печеночного изгиба ободочной кишки: выполняйте резекцию в пределах желудочно-сальниковой сосудистой аркады
2. Не обязательна при злокачественных опухолях в области слепой кишки, возможна резекция правой семенной/яич-никовой артерии и вены.
— Идентифицируйте правый мочеточник: он пересекает общую подвздошную артерию у ее бифуркации на внутреннюю и внешнюю ветвь.
Предупреждение: избегайте разрыва венозного анастомоза между средней ободочной веной и нижней поджелудочнодвенадцатиперстной веной, расположенного близко к нижнему краю поджелудочной железы. Будьте осторожны с натяжением поперечно-ободочной кишки во время мобилизации.
л) Этапы и техника гемиколэктомии справа:
1. Объем резекции
2. План реконструкции
3. Доступ
4. Рассечение большого сальника
5. Рассечение желудочно-ободочной связки I
6. Рассечение желудочно-ободочной связки II
7. Мобилизация правой половины ободочной кишки
8. Рассечение печеночно-ободочной связки
9. Определение краев резекции
10. Радикальное удаление брыжейки ободочной кишки
11. Линия резекции тонкой кишки
12. Линия резекции толстой кишки
13. Пересечение поперечно-ободочной кишки
14. Пересечение подвздошной кишки
15. Анастомоз задней стенки
16. Анастомоз передней стенки
17. Закрытие дефекта в брыжейке
1. Объем резекции. Радикальная правосторонняя гемиколэктомия подразумевает удаление правой половины ободочной кишки, терминального сегмента подвздошной кишки, региональных лимфатических путей и правой половины большого сальника.
2. План реконструкции. Восстановление непрерывности достигается анастомозом между дистальным сегментом подвздошной кишки и поперечноободочной кишкой; анастомоз укладывается в середине верхнего отдела брюшной полости.
3. Доступ. Хотя для стандартной илеоцекальной резекции будет достаточно выполнения нижней поперечной лапаротомии, для правосторонней гемиколэктомии должна использоваться верхняя поперечная лапаротомия, параректальный разрез или срединный разрез. V пациентов, страдающих выраженным ожирением и имеющих растянутую брюшную стенку, верхняя поперечная лапаротомия иногда дает лучшую визуализацию. Может быть выполнена лапароскопическая мобилизация с выведением препарата и анастомозом через небольшой поперечный разрез.
4. Рассечение большого сальника. Диссекция при правосторонней гемиколэктомии начинается с продольного рассечения большого сальника. Сосуды захватываются между зажимами Оверхольта и перевязываются раздельно. Пересечение большого сальника выполняется до тении поперечно-ободочной кишки.
6. Пересечение желудочно-ободочной связки II. Желудок захватывается зажимом Дюваля и отворачивается в передневерхнем направлении, в то время как ободочная кишка отводится вторым зажимом в передненижнем направлении. Это позволяет выполнить дальнейшее рассечение желудочно-ободочной связки между зажимами Оверхольта в медиальном направлении, близко к желудку. Теперь в глубине раны определяются средние и правые ободочные сосуды.
7. Мобилизация правой половины ободочной кишки. Правая половина ободочной кишки отделяется от ее боковых прикреплений, начинающихся у полюса слепой кишки. Отделение выполняется главным образом острым путем, без перевязки какого-либо крупного сосуда. Правый мочеточник и двенадцатиперстная кишка определяются в глубине раны и тупо отводятся в сторону. Тракция слепой кишки в кранио-медиальном направлении натягивает брыжеечную ножку восходящей ободочной кишки, позволяя обнаружить ее.
8. Рассечение печеночно-ободочной связки. Печеночный изгиб все еще прикреплен в его краниальной части поддерживающими связками. Мобилизация продолжается в два этапа. На поверхностном уровне между зажимами Оверхольта пересекается печеночно-ободочная связка. Печеночно-почечная связка пересекается на более глубоком уровне. После этого правая половина ободочной кишки может быть значительно смещена в медиальном направлении; в глубине раны обнажаются двенадцатиперстная кишка и правый мочеточник.
9. Определение краев резекции. Края резекции правой половины ободочной кишки отмечаются двумя резиновыми петлями, которые перекрывают ее просвет. В просвет кишки может быть введен цитотоксический раствор (200 мл), такой как Betadine (Cardinal Health, Dublin, ОН), для гибели всех свободно плавающих жизнеспособных опухолевых клеток. На этом этапе уточняется объем резекции. При доброкачественных поражениях слепой кишки будет достаточно ее простой резекции (см. ниже). В резекции большого сальника и мобилизации печеночного изгиба нет необходимости. Скелетизация ограничивается диссекцией терминального сегмента подвздошной кишки и восходящей ободочной кишки близко к кишечной стенке. При любых злокачественных поражениях требуется радикальное удаление лимфатических путей. Для этого должны быть выделены подвздошно-ободочная артерия (а), правая ободочная артерия (b) и средняя ободочная артерия (с). С этой целью выполняется диафаноскопия корня брыжейки с последующей диссекцией диатермией и скелетированием.
10. Радикальное удаление брыжейки ободочной кишки. Брыжейка ободочной кишки пересекается поэтапно у ее корня. Резекция начинается с подвздошно-ободочных сосудов, за которыми следуют правые и средние ободочные вены. Необходимо убедиться в целостности дуги Риолана (гарантия кровоснабжения остающегося сегмента поперечно-ободочной кишки). При сомнениях должна быть сохранена левая ветвь средней ободочной артерии. Сосуды перевязываются у их основания с прошиванием. Это единственный способ обеспечить радикальное удаление лимфатических путей.
12. Линия резекции толстой кишки. Последняя остающаяся сосудистая аркада поперечно-ободочной кишки захватывается зажимами Оверхольта и пересекается аналогичным образом. Здесь также важно убедиться в достаточном кровоснабжении левой половины поперечно-ободочной кишки.
13. Пересечение поперечно-ободочной кишки. На левую часть поперечно-ободочной кишки накладывается нераздавливающий жом, и под нее подводится полотенце, смоченное антисептическим раствором. После необязательного наложения швов-держалок кишка пересекается в поперечном направлении. Культя кишки орошается антисептическим раствором.
14. Пересечение подвздошной кишки. Резекция подвздошной кишки выполняется между швами-держалками под защитой нераздавливающего жома. Под линию резекции подводится полотенце, смоченное антисептическим раствором, и в косом направлении от дистального брыжеечного к проксимальному противобрыжеечному краю выполняется пересечение кишки. Это позволяет получить широкий косой срез тонкой кишки, соответствующий просвету ободочной кишки. Швы-держалки могут облегчить косое пересечение.
15. Анастомоз задней стенки. Выполняется анастомоз «конец в конец» с использованием техники прерывистого однорядного шва (3-0 PGA). Несоответствие ширины просветов требует сборивания путем наложения стежков в необходимом направлении. Промежутки между стежками составляют 0,6 см. По завершении формирования задней стенки последний шов используется как шов-держалка. Анастомоз между толстой и тонкой кишкой должен быть сконструирован таким образом, чтобы брыжейки толстой и тонкой кишки были расположены с одной стороны («брыжейка к брыжейке»).
16. Анастомоз передней стенки. Шов передней стенки выполняется с использованием такой же однорядной техники. Шов-держалка (то есть, последний угловой шов задней стенки) погружается первыми швами передней стенки. Анастомоз должен быть свободным от натяжения, хорошо кровоснабжаться и иметь широкий просвет. Адекватность ширины просвета подтверждается большим и указательным пальцами.
17. Закрытие дефекта в брыжейке. Дефект в брыжейке закрывается отдельными швами без повреждения сосудов. Можно укрыть анастомоз прядью сальника.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Операция гартмана на сигмовидной кишке
Выбор оптимального лечения зависит от стадии и локализации опухоли, ее осложнений, ситуации (экстренная или плановая операция), наличия сопутствующих заболеваний и других патологических изменений ободочной кишки. Важность разграничения рака ободочной кишки (например сигмовидной ) и рака прямой кишки обусловлена планом лечения, поскольку в последнем случае определенную роль играет (нео-)адъювантная лучевая терапия.
Сравнение основных категорий риска колоректального рака
б) Симптомы колоректального рака:
• Наиболее часто бессимптомное течение => обычно симптомы появляются на поздних стадиях заболевания!
• Случайное выявление при колоноскопии.
• Симптомы: примесь крови, необъяснимая анемия, изменение частоты и формы стула, запоры, полная непроходимость, боль в животе, перфорация, инфильтрат в брюшной полости, потеря веса.
• Осложнения: массивное кровотечение, толстокишечная непроходимость, перфорация, печеночная недостаточность.
в) Дифференциальный диагноз колоректального рака:
• Симптомы обструкции и кровотечения могут быть следствием любых причин: ВЗК, в частности болезни Крона, других форм колита (ишемического, инфекционного, включая псевдомембранозный С. difficle-ассоциированный или лучевой колит), дивертикулита, СРК.
• Метастазирование в ободочную кишку опухолей желудка, поджелудочной железы, женских половых органов, почек, долькового инвазивного рака молочной железы; лейкемическая инфильтрация.
• Редкие опухоли: карциноид, лимфома, ГИСТ, меланома.
• Предраковые полипы: в частности ворсинчатые полипы, могут занимать большую площадь и всю окружность кишки.
• Доброкачественные заболевания: эндометриоз, пролапс/инвагинация, доброкачественные опухоли (липома), псевдообструкция (синдром Огилви).
г) Патоморфология
Макроскопическое исследование:
• Полиповидное легкоранимое образование или изъязвленное кратерообразное образование с приподнятыми краями, различного размера и распространенности по окружности кишки. При ВЗК опухоль часто плоская с диффузным внутристеночным ростом.
• Путь метастатической диссеминации: лимфоваскулярный => лимфоузлы, гематогенный => система воротной вены => метастазирование в печень => метастазирование в легкие.
Дополнительные исследования (необязательные):
• Рентгенконтрастные исследования (ирригоскопия с барием или гастрографином): неполная колоноскопия, выраженная обструкция, подозреваемая перфорация (=>водорастворимый контраст).
• Виртуальная колоноскопия: роль не определена, риск перфорации.
• МРТ, ПЭТ, ПЭТ-КТ: диагностическое значение не определено.
• Лабораторные исследования: анемия, функция печени (альбумин, ПТИ, АЧТВ), функция почек.
е) Классификация колоректального рака:
• Основанная на локализации в ободочной кишке.
• Основанная на стадии опухоли: локализованная, местнораспространенная (размер, прорастание в другие структуры), метастазы.
• Основанная на системе TNM.
ж) Лечение без операции рака ободочной кишки:
• Пациенты, неоперабельные в связи с наличием сопутствующих заболеваний.
• Пациенты, иноперабельные/инкурабельные в связи с распространенностью опухоли (например, канцероматоз) => симптоматическое лечение, возможно агентирование.
• Метастазы в печени с поражением > 50% паренхимы => паллиативная химиотерапия.
з) Операция при колоректальном раке
Показания:
• Любой рак ободочной кишки (за исключением абсолютных противопоказаний).
• Даже при наличии генерализации желательно достижение локального контроля над опухолью, т.к. возможно выполнение условно радикальной симультанной или отсроченной метастазэктомии с лечебными целями.
Хирургический подход при раке ободочной кишки
а) Радикальное лечение:
• Онкологическая резекция с лимфаденэктомией: безопасные границы резекции >5 см, точный объем резекции зависит от локализации опухоли и путей лимфоваскулярного оттока:
— Слепая/восходящая кишка: правосторонняя гемиколэктомия с перевязкой правой ветви средней ободочной артерии.
— Печеночный изгиб/поперечно-ободочная кишка: расширенная правосторонняя гемиколэктомия с перевязкой средней ободочной артерии.
— Селезеночный изгиб:
1) расширенная левосторонняя гемиколэктомия с перевязкой средней ободочной артерии;
2) расширенная правосторонняя гемиколэктомия/субтотальная резекция ободочной кишки.
— Нисходящая кишка:
1) левосторонняя гемиколэктомия с перевязкой левой ветви средней ободочной артерии и нижнебрыжеечной/левой ободочной артерии;
2) субтотальная резекция ободочной кишки.
— Сигмовидная кишка: резекция сигмовидной кишки с перевязкой верхней прямокишечной или нижней брыжеечной артерии.
— Синхронные опухоли:
1) две раздельные резекции;
2) субтотальная резекция ободочной кишки.
— Опухоли, прорастающие в другие структуры: резекции eb-bloc.
— Метастазы в печени: симультанные резекции оправданы, если они технически выполнимы и переносимы больным (возможно отсроченные резекции).
— Профилактическая овариоэктомия не показана, но рекомендована при наличии видимых изменений в одном или обоих яичниках.
— Канцероматоз: резекция первичной опухоли, интраперитонеальный катетер как рутинная процедура не имеет смысла.
— Лапароскопический доступ эквивалентен открытому в опытных руках.
• Больной моложе 50 лет/ННПРТК:
1) субтотальная резекция/колэктомия с илеосигмоидным/ректальным анастомозом;
2) сегментарная резекция.
• САТК:
1) проктоколэктомия;
2) колэктомия с илеоректальным анастомозом, если нет рака прямой кишки или число полипов прямой кишки
Экстренное лечение колоректального рака:
• Рак правых отделов: хирургическое лечение, как и в плановой ситуации, первичный тонкотолстокишечный анастомоз.
• Рак левых отделов:
— Резекция с интраоперационным лаважем толстой кишки и первичным анастомозом.
— Установка стента для декомпрессии при обструкции левых отделов => резекция с формированием анастомоза в плановом порядке.
— Более расширенный объем операции, позволяющий сформировать тонкотолстокишечный анастомоз: субтотальная резекция ободочной кишки с первичным илеосигмоидным или илеоректальным анастомозом.
— Двухэтапное лечение:
а) операция Гартмана (=> реконструкция в плановом порядке);
б) формирование первичного анастомоза и проксимальная стома (=> закрытие стомы в плановом порядке);
в) проксимальная стома (=> резекция и ликвидация стомы в плановом порядке).
— Трехэтапное лечение (в основном не применяется): проксимальная стома (трансверзостома) => резекция и формирование анастомоза в плановом порядке (с сохранением отключающей стомы) => закрытие стомы в плановом порядке.
и) Паллиативное лечение:
• Сегментарная резекция.
• Проксимальная стома.
• Формирование обходного анастомоза.
• Стентирование.
— Повторные хирургические вмешательства:
• Метастазы: «сандвич» подход (резекция первичной опухоли, химиотерапия, резекция метастазов).
• Рецидив: если локализован, повторная резекция.
• Канцероматоз: обычно только эксплоративная лапаротомия, возможен индивидуальный подход.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Операция гартмана на сигмовидной кишке
Лечение заворота сигмовидной кишки. Консервативное и оперативное лечение заворота сигмовидной кишки.
До 50-х годов прошлого века лечение заворота сигмовидной кишки было исключительно хирургическим и сопровождалось существенной летальностью.
Вам, возможно, придется выполнять процедуру самому, без визуального контроля. В этом случае используйте ригидный ректоскоп, проводя его до уровня заворота, который хорошо заметен. Смазанную вазелином трубку проводят через ректоскоп и далее с помощью осторожных манипуляций в сигмовидную кишку. Третий метод заключается в использовании гибкого колоноскопа и манипулировании им непосредственно в зоне обструкции сигмовидной кишки. Очевидный успех вашей манипуляции подтвердит внезапный выброс газов и кала прямо вам в лицо.
Оперативное лечение заворота сигмовидной кишки
Неоперативные методы лечения заворота сигмовидной кишки эффективны у большинства больных, так как истинная странгуляция встречается нечасто. Экстренная лапаротомия показана, если на основании клинических данных (очевидный перитонит) заподозрен странгуляционный некроз или если попытки консервативного лечения заворота несостоятельны. Во время операции (позиция — как для камнесечения) вы сталкиваетесь с гигантски раздутой сигмовидной кишкой, которая должна быть разгружена. Лучше это делать осторожно раскручивая кишку с одновременным продвижением в расширенный ее сегмент трубки, предварительно введенной в прямую кишку. В наши дни у большинства пациентов, которые подвергаются экстренной операции по поводу заворота, сигмовидная кишка нежизнеспособна или значительно пострадала. Таким образом, операцией выбора является ее резекция с наложением колоректального анастомоза либо с выведением колостомы по Хартманну. Выбрать способ завершения вмешательства столь же существенно, как и при обструкции злокачественной опухолью, о чем говорилось выше. Наконец, мы должны упомянуть о возможности сигмопексии — фиксации сигмовидной кишки к боковой брюшной стенке. Это имеет лишь теоретическое значение в случаях, когда сигмовидная кишка жизнеспособна и хорошо разгружена и вы полагаете, что ее резекция с анастомозом — это «уж слишком» для одного пациента.
После успешной неоперативной декомпрессии при завороте сигмовидной кишки
Для предотвращения рецидивов заворота сигмовидной кишки простым решением является плановая сигмоидэктомия. Делают небольшой поперечный разрез, через который извлекают и резецируют гипертрофированную петлю сигмовидной кишки. Нет общепринятого мнения о том, когда необходима сигмоидэктомия для предотвращения заворота. Около половины больных переносят всего один эпизод, но если он повторяется, обычно возникает и третий. Поэтому большинство хирургов предлагают резекцию именно после 2-го эпизода. Это звучит, как анекдот, когда хрупкой даме 80 с лишним лет, у которой эпизоды заворота следовали один за другим, каждый раз говорили, что ей не показана плановая операция, так как причина непроходимости вполне доброкачественна. Лишь после 12-го эпизода она доказала свое право на операцию, была подвергнута сигмоидэктомии и при совершенно гладком послеоперационном течении выписана домой через 5 дней.
Рак ободочной кишки
Рак толстой кишки, или колоректальный, (рак ободочной и прямой кишки ссылка) занимает 4-е место в мире в структуре онкологической заболеваемости. В экономически развитых странах занимает 2-е место. На сегодняшний день статистические данные свидетельствуют о том, что в России рак толстой кишки занимает одну из ведущих позиций и уступает лишь раку легкого, желудка и молочной железы. Каждый год в России раком ободочной кишки заболевает более 15 000 человек.
Основным методом лечения рака ободочной кишки является хирургический. В отделении абдоминальной онкологии МНИОИ им. П.А. Герцена выполняется полный спектр оперативных вмешательств при всех локализациях опухолей в ободочной кишке.
Правосторонняя гемиколэктомия. Операцию выполняют при локализации опухоли в слепой кишке, червеобразном отростке, восходящем отделе ободочной кишки. При этом, удаляются все правые отделы ободочной кишки единым блоком с окружающей клетчаткой и лимфатическими узлами, правой половиной большого сальника.
Резекция поперечной ободочной кишки. Операцию выполняют при локализации опухоли в средних отделах поперечной ободочной кишки. Всю поперечную ободочную кишку удаляют вместе с ее брыжейкой, в которой расположены кровеносные сосуды и лимфатические коллекторы, полностью удаляют большой сальник.
Левосторонняя гемиколэктомия. Операцию выполняют при локализации опухоли в нисходящей ободочной кишке, начальных отделах сигмовидной кишки. Удаляется левая половина ободочной кишки вместе с сигмовидной кишкой, единым блоком с лимфатическими узлами и левой половиной большого сальника.
Резекция сигмовидной кишки. Выполняют операцию при наличии опухоли в средней трети сигмовидной кишки.
Удаляется вся сигмовидная кишка в едином блоке с окружающей клетчаткой, лимфатическими узлами.
Данные операции могут быть выполнены как «открытым» способом – выполняется разрез передней брюшной стенки, так и при помощи лапароскопической методики. Такой метод применим при локализованных (ограниченных) опухолях I-II ст. Через отдельные «проколы» в брюшной стенки вводят эндоскопические инструменты и видеокамеру. Операция проводится под большим оптическим увеличением, что позволяет прецизионно удалить опухоль вместе с лимфатическими узлами, полностью соблюдая онкологические принципы радикализма хирургического вмешательства. Минимальная хирургическая травма обеспечивает быстрое полное восстановление после операции.
Наибольшие трудности представляет лечение местнораспространенных опухолей ободочной кишки, когда имеется прорастание в соседние органы. Наиболее часто речь идет о поражении мочевыделительной системы (почки, мочеточники, мочевой пузырь), реже матка, яичники, печень, желудок, тонкая кишка. Хирургическое лечение таких пациентов подразумевает выполнение так называемых расширенных и комбинированных резекций.При лечении этой тяжелой группы необходимо участие хирургов-онкологов различных специальностей – абдоминальных онкологов, онкоурологов, онкогинекологов. Отделение абдоминальной онкологии МНИОИ им. П.А. Герцена активно сотрудничает с другими хирургическими подразделениями института – Онкоурология, Онкогинекология.
Еще более сложной проблемой является лечение больных с наличием так называемой перитонеальной диссеминации (канцероматоз брюшины). Таким больным хирурги-онкологи в большинстве медицинских учреждениях (в том числе и специализированных) либо сразу отказывают в лечении, или столкнувшись с этой проблемой во время операции, завершают ее пробным разрезом и осмотром брюшной полости. В клинике в последние годы в этих случаях прибегают к выполнению расширенных циторедуктивных вмешательств, подразумевающих удаление первичной опухоли и максимально возможное удаление отсевов по брюшине. Оперативные вмешательства дополняют по показаниям фотодинамической терапией или интраоперационной внутрибрюшной гипертермической химиотерапией, что дает надежду на улучшение отдаленных результатов лечения.
К сожалению, только хирургическое лечение не может обеспечить полное выздоровление при запущенных стадиях заболевания. Причинами этого является поздняя обращаемость пациентов за квалифицированной медицинской помощью, несвоевременное, и проведенное не полном объеме, обследование. В таких случаях приходится прибегать к комбинации хирургического и лекарственного лечения. Показаниями для проведения комбинированного лечения является III стадия опухолевого процесса, наличие метастазов в удаленных лимфатических узлах, низко- и недифференцированные опухоли. Выбор схемы лечения определяется в зависимости от степени распространенности опухолевого процесса, результатов морфологического исследования, наличия факторов прогноза (опухолевые непроходимость, перфорация, абсцедирование), возраста больного, общего состояния и сопутствующей патологии. Современные схемы химиотерапии позволяют значительно улучшить результаты хирургического лечения, а в ряде случаев достигнуть полного выздоровления.
При выполнении любого варианта операции на ободочной кишке, при отсутствии полноценного кровоснабжения толстой кишки, особенно при срочных операциях на неподготовленной кишке, при наличии кишечной непроходимости хирургам приходится формировать временную колостому. В абдоминальном отделении МНИОИ им. П.А.Герцена возможно выполнение практически всех восстановительных операций (закрытие колостомы, восстановление непрерывности кишечного тракта после операции Гартмана и т.п.). Данные операции позволяют достичь полной социальной реабилитации и возвращают пациентов к нормальной жизни.