Как долго лечится дисбактериоз кишечника у взрослых
Как долго лечится дисбактериоз кишечника у взрослых
Дисбактериоз кишечника
При эубиозе (то есть в норме) микрофлора кишечника представляет собой оптимальное соотношение различных бактерий – кишечной палочки, лактобацилл, энтерококков и др., всего более 500 видов. Дисбактериозом называют дисбаланс микробов, который длится продолжительное время. Это очень распространенное состояние, встречающееся примерно у 90 % взрослых и 95 % детей.
При должной коррекции, которую может назначить только врач, дисбактериоз кишечника проходит, но при отсутствии лечения обычно переходит в более тяжелую, прогрессирующую форму. Данное бактериологическое состояние принято рассматривать в качестве проявления или осложнения какого-либо заболевания, чаще всего – желудочно-кишечного тракта.
Причины развития дисбактериоза
Гибель полезных бактерий, населяющих микрофлору кишечника, может быть связана с такими факторами, как:
К факторам, повышающим риск развития дисбактериоза кишечника, относят постоянные стрессы и неблагоприятную экологию, от которых страдают жители современных мегаполисов.
Общая симптоматика
Симптомы дисбактериоза кишечника различаются по локализации дисбиотических изменений и степени их выраженности. На тяжесть клинических проявлений влияют возраст, образ жизни, состояние иммунной системы, стадия развития патологии.
1 стадия
На данном этапе дисбаланс бактерий выражен слабо: пациента могут беспокоить небольшие расстройства кишечника. Обычно такое состояние связано с кратковременным воздействием на микрофлору, например, со сменой привычной пищи, напитков. После окончания воздействия провоцирующих факторов или привыкания к новым условиям баланс микрофлоры восстанавливается.
2 стадия
Прекращается производство кишечником необходимого количества ферментов, обеспечивающих нормальное пищеварение. В результате возникает процесс брожения, который проявляется болью и вздутием живота, горечью во рту, метеоризмом, запорами или, наоборот, диареей. Это могут быть симптомы как прогрессирующего дисбактериоза, так и развития заболеваний желудочно-кишечного тракта.
3 стадия
На этой стадии при воздействии большого количества патогенной флоры на стенки кишечника развивается воспалительный процесс. Такой дисбактериоз уже требует медицинского вмешательства. К выраженным симптомам добавляются тошнота, рвота, непереваренные фрагменты пищи в стуле, сильные боли в животе. В некоторых случаях – повышение температуры тела.
4 стадия
Это состояние кишечника, при котором нормальная микрофлора практически полностью вытеснена болезнетворными микроорганизмами, что приводит к нарушению всасывания полезных веществ, развитию авитаминоза и даже анемии. Образующиеся в результате токсины попадают в кровь и провоцируют тяжелые аллергические реакции. Клинические проявления включают возникновение сыпи, экземы, крапивницы, возможно развитие астмы, бессонницы, хронической усталости. Пациент может жаловаться на проблемы с концентрацией внимания. При отсутствии своевременного лечения возникает угроза развития тяжелых кишечных инфекций.
Крайняя степень дисбактериоза – проникновение бактерий желудочно-кишечного тракта в кровь (бактериемия), в некоторых случаях – развитие сепсиса.
Диагностика дисбактериоза
Основная цель диагностики – определение вида микробов, заселяющих кишечник, и их количества. Как правило, используются следующие основные методы:
При проведении диагностики и постановке диагноза учитывается также, что микрофлора кишечника индивидуальна для каждого человека. Ее состав может зависеть от возраста, потребляемой пищи и сезона. В связи с этим специалист основывается не только на результатах анализов, но и на дополнительных обследованиях, позволяющих выявить причину развития дисбактериоза.
Лечение дисбактериоза
Лечение дисбактериоза у взрослых зависит от причин и симптомов и назначается комплексно. Стандартная схема обычно включает меры, направленные на:
Помните, что назначить грамотное и эффективное лечение может только специалист. Чтобы получить квалифицированную консультацию, запишитесь на прием к врачу клиники «АВС-Медицина» по номеру +7 (495) 223-38-83 или заполните заявку на нашем сайте.
Цены на услуги
Прайс временно недоступен. Ведется обновление цен. Актуальные цены уточняйте у операторов call-центра. Извините за доставленные неудобства.
Дисбактериоз кишечника: лечение
Чувствуете дискомфорт в животе, замечаете изменение стула (запоры, поносы), боли, постоянное газообразование? Ответ достаточно прост. Все это является симптомами такой неприятной болезни как дисбактериоз. Что же это за недуг такой? И как с ним бороться? На поверхности и внутри тела человека живет огромное количество различных микроорганизмов. Они защищают нас от патогенных, т. е. способных вызвать заболевания, бактерий и грибов, принимают непосредственное участие в процессе переваривания пищи, способствуют повышению иммунитета.
Но иногда под действием какой-либо причины эти полезные для нас бактерии гибнут, а вместо них начинает усиленно развиваться условно-патогенная флора. Это приводит к формированию дисбактериоза, т. е. к нарушению нормального количественного и качественного соотношения различных бактерий. Появляется слабость, организм быстро утомляется, возможны частые головные боли, уменьшается аппетит, а во рту, чувствуется неприятный вкус метала.
Существует несколько причин возникновения дисбактериоза:
Не стоит откладывать лечение и терпеть неудобства. Ни в коем случае не занимаемся самолечением. Такие действия могут только стать причиной усугубления проблемы. Большинство, насмотревшись реклам по телевизору, бегут в аптеку и начинают принимать рекламируемые препараты. Это большая ошибка! В первую очередь мы отправляемся к врачу терапевту. Лечение дисбактериоза является довольно длительным процессом, при котором необходимо сдать ряд анализов. За Вами остается лишь строго соблюдать все наставления Вашего лечащего врача.
Чем лечить дисбактериоз?
При дисбактериозе лекарственные препараты делятся на две группы:
Дисбактериоз у детей
Но в отличие от взрослых, у детей дисбактериоз опасен тем, что у детей может развиться авитаминоз. Он, в свою очередь ведет за собой такие неприятные последствия, как замедленное развитие ребенка. Ведь все это происходит в период активного роста ребенка его развития. Лечение дисбактериоза у детишек требует более тщательного подхода. Восстановить микрофлору – недостаточно. Необходимо устранить причину ее нарушения.
Причины возникновения дисбактериоза у детей
Но, пожалуй, основной из них являются частые простудные заболевания, к устранению которых мы применяем антибиотики. С самого рождения отличным защитником от дисбактериоза для детей является грудное вскармливание. А уж если не пришлось обойтись без приема антибиотиков, необходимо параллельно при лечении применять выше перечисленные препараты. Ну и обязательно сбалансированное питание.
Профилактика развития дисбактериоза у детей
Чтобы не стать заложником этого неприятного заболевания, постарайтесь вести правильный образ жизни, составьте для себя меню полезного сбалансированного питания и не нервничайте по пустякам.
Дисбактериоз кишечника – это заболевание, которое характеризуется нарушением соотношения и состава населяющих кишечник микроорганизмов.
Без соответствующего лечения данное заболевание может привести к серьёзным нарушениям в работе желудочно-кишечного тракта.
Причины появления дисбактериоза
Существует многоженство факторов, способных изменить нормальную микрофлору кишечника. Но чаще всего своим появление дисбактериоза связано с:
Основные симптомы дисбактериоза
Симптомы дисбактериоза бывают идентичны симптомам других гастроэнтерологических заболеваний. При дисбактериозе могут беспокоить:
Диагностика и лечение дисбактериоза
В первую очередь, для постановки диагноза необходимо провести анализ кала. Также врач может назначить: гастроскопию, ректороманоскопию, ирригоскопию, колоноскопию.
Лечение дисбактериоза кишечника проводится в комплексе и подразумевает: восстановление нормальной микрофлоры кишечника, улучшение пищеварения, восстановление моторики кишечника. Лекарственная терапия подразумевает прием антибактериальных препаратов и бактериальных, регуляторов пищеварения.
Лечение дисбактериоза у взрослых и детей
К какому специалисту следует обратиться, если у вас обнаружились симптомы Дисбактериоза?
Профилактика дисбактериоза
Профилактика дисбактериоза заключается в решении ряда проблем:
Лечение гастроэнтерологических заболеваний – одно из приоритетных направлений работы клиники «Семейная».
Запись на прием к врачу гастроэнтерологу
Обязательно пройдите консультацию квалифицированного специалиста в области гастроэнтерологии в клинике «Семейная».
Дисбактериоз: опасная болезнь или выдумка?
О дисбактериозе, или дисбиозе кишечника, слышали многие. Такой диагноз нередко ставят пациентам, испытывающим вздутие, метеоризм, дискомфорт, нарушение стула, диарею и т. д.
Что такое дисбактериоз?
Термин «дисбактериоз» существует только на территории стран постсоветского пространства. В мировой классификации болезней (МКБ) такого заболевания нет, равно как и его официальных методов лечения и диагностики.
Дисбактериоз не может существовать сам по себе. Он может быть симптомом какого-либо заболевания. Чаще всего это синдром раздраженного кишечника (СРК), к которому могут приводить частые стрессы, неправильное питание, переедание, употребление большого количества газообразующих продуктов, жиров растительного или животного происхождения, алкоголя, недостаток пищевых волокон и т. д.
Кроме того, дисбактериоз кишечника может быть признаком, в том числе, синдрома раздраженной толстой кишки, избыточного микробного роста, антибиотикоассоциированного колита, диареи, а также целиакии — заболевания, при котором организм по тем или иным причинам не может переносить белок глютен, содержащийся в злаковых культурах (рожь, пшеница, ячмень, определенные сорта овса).
Осторожно, дисбактериоз кишечника
Однако некоторые российские врачи нередко ставят пациентам конкретный диагноз — дисбактериоз, уточняя иногда даже стадию заболевания. Одним из методов диагностики дисбактериоза является копрологический анализ. При этом в ходе исследования обращают внимание лишь на пятнадцать-восемнадцать типов бактерий. На самом же деле определить корректно состояние флоры и выявить дисбактериоз кишечника по такому анализу нельзя.
Для лечения прописывают медикаменты — чаще бактериальные препараты в виде порошка, изготовленные путем лиофилизации (засушенные микробы). Но не один из подобных препаратов не имеет доказательной базы. При этом доказано, что при их употреблении не происходит приживаемости бактерий.
Нужно помнить, что какими бы ни были бактерии (живыми или мертвыми) в препаратах, им все равно предстоит пройти барьерную функцию желудка. Кислая среда попросту их уничтожит. А те бактерии, которые все же попадут в кишечник, не задержатся там надолго.
Препараты от дисбактериоза часто рекламируют по телевидению и интернете, ими завалены полки в аптеках. Конечно, они безвредны и принимать их можно долго. Но и результата они не приносят. Недобросовестные фармакологические компании попросту наживаются на доверчивых гражданах.
Кстати, организм человека населен очень большим количеством (более триллиона) полезных бифидо- и лактобактерий. Это неотъемлемая составляющая желудочно-кишечного тракта (ЖКТ). Они принимают участие в окончательном этапе процесса пищеварения, газообразования. Для комфортного пребывания полезным микроорганизмам необходима определенная среда. В тонком кишечнике в основном живут лактобактерии, а в толстом бифидобактерии.
Общий вес бактерий в организме взрослого человека может составлять целых два-три килограмма, а их количество сравнимо с числом клеток всего организма. Если выложить все бактерии одну за другой, их протяженность будет сопоставима с высотой десятиэтажного дома.
«Дисбактериоз» у ребенка
Нередко мамы жалуются, что после введения прикорма у ребенка начинает пучить живот, появляется понос. Если дисбиотические расстройства возникают сразу после введения прикорма, возможно, имеет место целиакия — заболевание, которое поражает генетически предрасположенных людей и протекает в виде иммунного воспаления в тонком кишечнике с нарушением функции всасывания. В этом случае рекомендуется исключить из прикорма манную кашу, хлеб и детские мясные консервы.
Развивается болезнь под влиянием особого белка — глиадина, проникающего через кишечный барьер. При иммунном воспалении часть ворсинок кишечника разрушается. Это происходит при употреблении продуктов, в которых содержится глютен (мука, злаки и злаковые продукты). Для диагностики можно провести исследование на антитела (IgA) к эндомизию. Повышение титра антител свидетельствует о целиакии.
Во многих странах введен скрининг целиакии у детей в возрасте до трех лет. Серологические тесты позволяют заранее выявить группу пациентов, как с классическими формами заболевания, так и скрытыми. Ребенок, больной целиакией, даже будучи уже взрослым, должен обязательно придерживаться безглютеновой диеты. Безглютеновая диета, как национальная культура, существует у многих восточных народов (японцы, китайцы, корейцы). Возможно, поэтому и уровень заболеваемости целиакией там ниже.
Кстати, каждый ребенок при рождении имеет стерильный кишечник, в котором нет бактерий. И в зависимости от того, что в дальнейшем туда попадет, приживется и останется там, будет зависеть здоровье человека.
Профилактика
В качестве профилактики дисбактериоза рекомендуют принимать определенные препараты. Хотя в этом вопросе больше важно правильное питание. Если человек нормально питается, внутренние органы (желудок, поджелудочная железа) функционируют как следует, то с наличием полезных микроорганизмов (лакто- и бифидобактерий) проблем, скорее всего, не возникнет и вероятность появления расстройств, возможно, будет меньше.
Лучше употреблять пищу максимально естественного происхождения: различные овощи, фрукты, свежая рыба, нежирное белое диетическое мясо, а также пить чистую воду, травяные чаи, морсы, компоты, отвары. Полезны качественные йогурты, кефиры, ряженка, в которых содержатся бифидо- и лактобактерии. Чтобы не сомневаться в наличии в них полезных бактерий, эти продукты можно готовить в домашних условиях. Для этого потребуются молоко и закваска, которая продается во многих аптеках.
Если говорить о магазинных йогуртах, то на упаковке должно быть четко указано о содержании полезных бактерий в конкретном продукте (L. rhamnosus, различные бифидобактерии). При этом их количество должно быть не меньше, чем десять в шестой степени. Если в йогурте помимо молока и бактериальной закваски содержатся и другие ингредиенты, например, фрукты, крахмал, желирующий агент и т. д., это уже не традиционный йогурт, а йогуртовый продукт. Польза от него будет не такой высокой.
Нужно помнить, что наполнение организма полезными микроорганизмами, это, конечно, отлично, но при отсутствии благоприятной среды бактерии могут попросту не прижиться и не задержаться в организме.
Кстати, между учеными до сих пор ведутся споры: одни считают, что человек управляет микроорганизмами, другие же полагают, что микроорганизмы управляют человеком. В кишечнике человека живет около пятисот видов микроорганизмов и пока доподлинно неизвестно, какую функцию выполняет каждый из них. На сегодняшний день многие вопросы в области микроэкологии кишечника остаются открытыми. Но благодаря молекулярным методам диагностики научный прогресс не стоит на месте.
Лечить дисбактериоз кишечника, также как и температуру, без выявления первопричины недопустимо. Если поставлен такой диагноз, нужно искать истинную причину возникновения дисбиотических расстройств, а не тратить время на бесполезное лечение. При наличии дискомфорта при пищеварении, вздутии, тяжести после приема пищи, нарушении стула не стоит самостоятельно ставить себе диагноз и заниматься самолечением. Лучше обратиться к врачу, который поможет в конкретной ситуации.
МИКРОЭКОЛОГИЯ КИШЕЧНИКА И АЛЛЕРГИЯ
Проблема дисбактериоза кишечника является сегодня предметом оживленной дискуссии, развернувшейся среди гастроэнтерологов и педиатров. Причины этого кроются в абсолютизации значения состояния микрофлоры кишечника, возведении понятия «дисбактериоз» в ранг
Проблема дисбактериоза кишечника является сегодня предметом оживленной дискуссии, развернувшейся среди гастроэнтерологов и педиатров. Причины этого кроются в абсолютизации значения состояния микрофлоры кишечника, возведении понятия «дисбактериоз» в ранг нозологической формы или «клинико-лабораторного синдрома». В практической деятельности это мешает правильному пониманию патологического процесса, своевременной постановке диагноза и выбору адекватного метода терапии.
У здоровых лиц в кишечнике насчитывается около 500 видов различных микроорганизмов, большую часть из которых составляют представители так называемой облигатной микрофлоры (бифидобактерии, лактобактерии, непатогенная кишечная палочка и др.)
Нормальная микрофлора представляет собой качественное и количественное соотношение разнообразных микробов отдельных органов и систем, благодаря которому поддерживается биохимическое, метаболическое и иммунное равновесие макроорганизма, необходимое для сохранения здоровья человека. То есть микрофлора кишечника — важный фактор, способствующий нормальному развитию и функционированию организма ребенка.
Микрофлора кишечника на 92—95% состоит из облигатных анаэробов. Состав кишечной микрофлоры достаточно индивидуален и формируется в первые дни жизни ребенка. Важнейшим фактором формирования нормальной микрофлоры являются следующие критерии.
До и во время родов:
Для ребенка раннего возраста крайне важно естественное вскармливание, так как женское молоко содержит ряд веществ-пребиотиков, которые способствуют заселению кишечника определенными видами микроорганизмов в определенных количествах. Даже незначительное неблагополучие в первые дни жизни ребенка, а особенно патологические состояния желудочно-кишечного тракта, способны вызвать тяжелые, труднокорректируемые в дальнейшем нарушения биоценоза кишечника. Особый ущерб микрофлоре кишечника в этот период может нанести нерациональная антибиотикотерапия.
Некоторые из важнейших представителей микробиоценоза кишечника и их функции представлены в таблице.
Нарушение микробного равновесия в кишечнике именуется дисбактериозом или дисбиозом кишечника. Согласно отраслевому стандарту, который вскоре должен быть принят, под дисбактериозом кишечника понимается клинико-лабораторный синдром, возникающий при ряде заболеваний и клинических ситуаций и характеризующийся:
Однако с этой формулировкой не согласно большинство практикующих гастроэнтерологов, так как симптомы поражения кишечника возникают не при дисбиозе, а при конкретном заболевании, следствием которого чаще и является нарушение микроэкологии кишечника.
Основные причины дисбактериоза кишечника:
Дисбактериоз кишечника — всегда вторичное состояние. Первопричина его развития — изменение внутренней среды кишки, нарушение пищеварительных процессов, повреждающее действие на кишечную стенку, мальабсорбция. Дисбактериозом кишечника замыкается «патогенетический порочный круг», разорвать который необходимо как для успешного лечения основного заболевания, так и для ликвидации его последствий. Ниже приведена классификация дисбактериоза кишечника, предложенная в 1991 году. Однако, исходя из положения о вторичности дисбактериоза и отсутствии какой-либо специфической клинической картины, данная классификация, по мнению автора, имеет чисто исторический интерес.
Сегодня предложены следующие методы диагностики дисбактериоза кишечника:
К сожалению, приходится констатировать, что традиционные клинические представления о микрофлоре кишечника устарели. И прежде всего из-за неполной информация о микробиоценозе:
Коррекция микроэкологических нарушений базируется на следующих принципах:
С этой целью проводят целенаправленное воздействие на микрофлору с селективным уничтожением (антибиотиками, бактериофагами) нежелательных микроорганизмов и заселением кишечника недостающими представителями флоры, а также общее воздействие на микрофлору с целью создания таких условий в кишечнике, которые были бы неблагоприятны для нежелательных микроорганизмов, но благоприятствовали заселению недостающими.
Для нормализации кишечной микрофлоры используют различные группы препаратов, в том числе пробиотики — живые микроорганизмы и вещества микробного происхождения, оказывающие при естественном способе введения положительные эффекты на физиологические и метаболические функции.
Широкий спектр штаммов высокоимплантируемых микроорганизмов содержат препараты примадофилус: примадофилус (Lactobacillus rhamnosus и Lactobacillus acidophilus), примадофилус бифидус (Lactobacillus rhamnosus, Lactobacillus acidophilus, Bifidobacterium breve, Bifidobacterium longum), примадофилус детский (Lactobacillus rhamnosus, Lactobacillus acidophilus, Bifidobacterium infantis, Bifidobacterium longum), примадофилус джуниор (Lactobacillus rhamnosus, Lactobacillus acidophilus, Bifidobacterium breve, Bifidobacterium infantis, Bifidobacterium longum).
Перспективным в отношении лечения дисбактериоза является линекс — трехкомпонентный комплекс живых лиофилизированных бактерий, действующих на всем протяжении кишечника.
Тем не менее необходимо отметить несовершенство традиционной терапии дисбактериоза, связанное с недостатками антибактериальной терапии (подавление микробиоценоза, рост резистентных форм), фаготерапии (узкая специфичность фагов, быстрое появление фагорезистентных штаммов) и терапии пробиотиками (трудность подбора и неадекватность доз препаратов целям их применения, ограниченная возможность имплантации отдельных штаммов в уже сложившиеся экосистемы кишечника, нестабильность их колонизации, ограниченная антагонистическая активность используемых штаммов, узкий спектр дисбиотической коррекции).
В этой связи в последнее время показана перспективность использования пребиотиков — продуктов метаболизма нормальных микроорганизмов. К препаратам данной группы относится хилак форте, представляющий собой стерильный концентрат продуктов обмена веществ, вырабатываемых нормальной флорой тонкого и толстого кишечника. Хилак форте способствует восстановлению биологической среды в кишечнике, создавая условия для роста и восстановления всех видов собственной микрофлоры, и улучшает физиологические функции и репаративные процессы в слизистой оболочке желудочно-кишечного тракта. Следует отметить, что хилак форте применяется на всех этапах лечения, совместим с другими препаратами и может использоваться в любом возрасте без ограничений.
Недавно на российском рынке появился комбинированный пребиотик отечественного производства лактофильтрум, содержащий энтеросорбент на основе гидролизного лигнина (продукт переработки древесины), который сорбирует в кишечнике токсины и патогенную микрофлору, а также содержит лактулозу — мощный стимулятор роста бифидо- и лактобактерий.
Кроме того, пребиотики добавлены в детскую молочную смесь «Нутрилон Омнео».
C 80-х годов значение нарушений микробиоциноза ЖКТ в патогенезе атопических заболеваний широко дискутировалось. Общепринятой, хотя и недостаточно доказанной, до недавнего времени являлась теория о влиянии инфекционных агентов на механизмы развития атопических заболеваний. Эта схема в общем устраивала как врачей, так и патофизиологов. Однако в конце ХХ века в экономически развитых странах был зафиксирован рост числа атопических заболеваний. Эпидемия аллергии проявилась у поколения людей, родившихся после 60-х годов. Наиболее часто эту тенденцию связывают с западным стилем жизни, который подразумевает снижение частоты вирусных и бактериальных инфекций, что в определенной степени противоречило традиционным представлениям о роли инфекции в генезе атопии. Была сформулирована так называемая «гигиеническая» гипотеза. Данная модель, состоятельность которой была подтверждена целым рядом исследований, коренным образом изменила взгляды на возможность использования пробиотиков при аллергических заболеваниях. Было выдвинуто предположение, что положительная роль инфекции в отношении сдерживания развития аллергии может быть заменена использованием пробиотиков. В настоящее время установлено несколько путей, посредством которых пробиотики модулируют аллергическое воспаление.
Необходимо отметить, что постнатальное созревание в слизистой IgA-системы обычно значительно быстрее происходит в развивающихся, нежели в индустриально развитых странах. Вероятно, это связано с недостаточной микробной стимуляцией в последних. В то же время повышение системного и секреторного IgA показано при оральном введении лактобацилл. Прием Lactobacillus casei и Lactobacillus bulgaricus ведет к снижению повышенной фагоцитарной активности у детей с пищевой аллергией, тогда как у лиц, не страдающих аллергией, пробиотики усиливают фагоцитарную активность. То есть пробиотики по-разному модулируют активность фагоцитоза у аллергиков и неаллергиков. Это означает, что иммуномодулирующий эффект пробиотиков может зависеть от исходного иммунологического статуса больного. К сожалению, клинических исследований, проведенных с учетом этой позиции, нет. Как нет и контролируемых исследований, устанавливающих дифференцированные показания к использованию тех или и иных штаммов пробиотиков у детей с атопическими заболеваниями. Определенные штаммы гастроинтестинальной флоры могут высвобождать низкомолекулярные пептиды, которые модулируют иммунный ответ. Так, пробиотики супрессируют пролиферацию лимфоцитов и продукцию цитокинов T-клетками.
На связь пищевой аллергии и нарушений интестинальной флоры в начале 1980-х годов указали российские ученые. Ярким примером взаимосвязи микробиоциноза кишечника и распространенности атопических заболеваний может служить ситуация, сложившаяся в двух соседних государствах. Так, в Швеции кишечная микрофлора у детей содержит значительное количество Clostridium sp., тогда как аналогичная популяция в Эстонии отличается высоким уровнем Lactobacillus sp. и Eubacterium sp. Возможно, именно этими микробиотическими особенностями и объясняют низкий уровень аллергических заболеваний в Эстонии по сравнению со Швецией. Более того, исследование, проведенное в конце
90-х годов, показало, что микрофлора кишечника у детей в Эстонии схожа с той, которая была выявлена у детей в Швеции в 60-х годах. Необходимо подчеркнуть, что у здоровых эстонских детей выявляется более высокий уровень лактобактерий по сравнению с аллергиками.
Показано снижение риска развития атопической экземы в течение первых двух лет жизни у детей, матери которых получали пробиотики, по сравнению с плацебо-группой. В грудном молоке повышалось количество трансформирующего фактора роста b 2, обладающего противовоспалительными свойствами. В Финляндии беременные женщины, дети которых входили в группу с высоким риском развития атопической экземы, получали ежедневно лактобактерии за 2—4 недели до предполагаемых родов. В опытной группе 36 детей находились на искусственном вскармливании и получали лактобактерии per os в течение первых 6 месяцев жизни, тогда как 28 детей, находящихся на грудном вскармливании, получали лактобактерии только пренатально. Атопическая экзема была диагностирована в 12 месяцев у 15/64 (23%) прошедших курс лечения детей и в плацебо-группе — у 31/68 (46%). Таким образом, можно утверждать, что Lactobacillus GG эффективно предупреждают ранние проявления аллергии у детей из группы риска. При этом уровень общего и специфического IgE, а также кожные пробы не различались у детей в опытной и плацебо-группах. То есть снижение частоты атопической экземы вряд ли может быть объяснено на основании соотношений, а также преобладания TH1/TH2-типов иммунного ответа.
Говоря о терапии атопических заболеваний пробиотиками, надо отметить приоритет российских исследований в этой области. Показано, что введение смеси Propionibacteria и Lactobacillus acidophilus ведет к уменьшению проявлений пищевой аллергии. Однако эти и многие другие исследования не были контролируемыми.
В ходе первого исследования, доказавшего эффективность пробиотиков при аллергических заболеваниях и проведенного в соответствии с «золотым стандартом», дети раннего возраста с доказанной аллергией к коровьему молоку питались сильно гидролизованной смесью или сильно гидролизованной смесью с Lactobacillus rhamnosus GG (ATCC 53103). В другом исследовании 27 детей 4,6 месяца, у которых пищевая аллергия манифестировала на фоне исключительно грудного вскармливания, получали высокогидролизованную смесь или высокогидролизованную смесь с пробиотиками Bifidobacterium lactis Bb-12 или Lactobacillus GG (ATCC 53103). После двух месяцев у детей было отмечено значительное улучшение состояния кожи, оцененное по SCORAD у детей, получавших как Bifidobacterium lactis Bb-12, так и Lactobacillus GG, по сравнению с контрольной группой.
Таким образом, достоверных клинических данных, подтверждающих эффективность пробиотиков в профилактике и лечении атопических заболеваний у детей, явно недостаточно. Вместе с тем экспериментальные данные и единичные клинические исследования подтверждают необходимость проведения дальнейших изысканий, которые позволили бы определить дозы, режимы назначения и показания к использованию пробиотиков.
Литература
Линекс — перспективное средство в лечении дисбактериоза
Свойства линекса, обеспечивающие его ведущую роль в коррекции дисбактериоза:
Классификация дисбактериоза кишечника по И. Б. Куваевой, К. С. Ладодо (1991)
Первая степень — латентная фаза дисбиоза, проявляется только в снижении на 1—2 порядка количества защитной микрофлоры — бифидобактерий, лактобацилл, а также полноценных кишечных палочек — до 80% общего количества. Остальные показатели соответствуют физиологической норме (эубиозу). Как правило, начальная фаза не вызывает дисфункций кишечника и возникает как реакция организма практически здорового человека на воздействие неблагоприятных факторов, таких как, например, нарушение режима питания и др. В этой фазе возможно вегетирование в кишечнике незначительного количества отдельных представителей условно-патогенной флоры.
Клинические проявления дисбактериоза в этой фазе отсутствуют.
Вторая степень — пусковая фаза более серьезных нарушений, характеризуется выраженным дефицитом бифидобактерий на фоне нормального или сниженного количества лактобацилл или сниженной их кислотообразующей активности, дисбалансом в количестве и качестве кишечных палочек, среди которых нарастает доля лактозонегативных или цитратассимилирующих вариантов. При этом на фоне дефицита защитных компонентов кишечного микробиоценоза происходит размножение либо плазмокоагулирующих стафилококков, либо протеев, либо грибов рода Candida. Вегетирование в кишечнике протеев или плазмокоагулирующих стафилококков на этой фазе развития дисбактериоза чаще транзиторное, чем постоянное.
Функциональные расстройства пищеварения выражены неотчетливо — спорадически жидкий стул зеленоватого цвета с неприятным запахом, со сдвигом рН в щелочную сторону, иногда, напротив, задержки стула, иногда может отмечаться тошнота.
Третья степень — фаза агрессии аэробной флоры — характеризуется отчетливым нарастанием содержания агрессивных микроорганизмов; при этом размножаются (до десятков миллионов в ассоциации) золотистые стафилококки и протеи, гемолитические энтерококки; наблюдается замещение полноценных эшерихий бактериями родов Klebsiella, Enterobacter, Citrobacter и др.
Эта фаза дисбактериоза проявляется дисфункциями кишечника с расстройствами моторики, секреции ферментов и всасывания. У больных отмечается учащенный разжиженный стул, часто зеленого цвета, снижение аппетита, ухудшение самочувствия, дети становятся вялыми, капризными.
Четвертая степень — фаза ассоциативного дисбиоза — характеризуется глубоким разбалансированием кишечного микробиоценоза с изменением количественных соотношений основных групп микроорганизмов, изменением их биологических свойств, накоплением токсических метаболитов. Характерно вегетирование энтеропатогенных серотипов E. coli, сальмонелл, шигелл и других возбудителей острых кишечных инфекций. Возможно размножение клостридий.
Эта фаза дисбиоза характеризуется функциональными расстройствами пищеварительной системы и нарушениями общего нутритивного статуса, дефицитом массы тела, бледностью кожных покровов, снижением аппетита, частым стулом с примесью слизи, зелени, иногда, крови, с резким гнилостным или кислым запахом.
Чем опасен дисбактериоз кишечника?
В наше время остро стоит проблема плохой усвояемости пищи, которую человек употребляет ежедневно. Всему виной дисбактериоз. Это явление широко распространено среди детей (около 95 процентов) и взрослых жителей (примерно 90 процентов). Само определение термина «дисбактериоз» характеризует повреждение и изменение микрофлоры кишечника, в результате которого вредных бактерий становится больше, чем полезных. Из-за этой болезни не удаётся полностью усваивать пищу, что существенно снижает уровень роста детей.
Если вы заметили, что ваш иммунитет всегда на низком уровне, нарушен обмен веществ и вы чувствуете упадок жизненных сил, то нужно срочно обратиться к врачу. Это первые признаки дисбактериоза. Лечением дисбактериоза занимается гастроэнтеролог. Эндотоксины и различные не выведенные продукты гниют, что способствует толчку для развития болезни.
Главная причина появления дисбактериоза — это плохое питание, некачественные продукты, избыток потребления жирных, сладких, рафинированных продуктов. Как всем известно лекарства не только лечат, но и калечат. Следовательно при приёме различных антибиотиков, обезболивающих и других лекарств свойственно развитие дисбактериоза. Небольшое влияние имеют психологические и экологические факторы.
Для избавления от вредных бактерий в кишечнике сразу же необходимо наладить правильное питание и начать соблюдать специальную диету. Придется есть больше растительной пищей (желательно низкой тепловой обработки), так как она дольше распадается.
Предстоит отказаться от мучных, мясных и сладких изделий. При нарушенной микрофлоре нельзя употреблять спиртные напитки. Чем больше овощей таких, как капуста, лук и перец, тем быстрее пройдет восстановление. Можно добавить ягоды: клубнику, чернику, смородину, вишню, клюкву в диету. При лечении также нужно добавить в рацион растительную зелень и принимать грамм 300-400 в день.
Но один раз в неделю стоит отдохнуть от диет и дать кишечнику покой. Можно сходить на лечебный массаж или гирудотерапию. Это улучшит работу ферментных систем и поспособствует восстановлению микрофлоры кишечника и дальнейшему избавлению от дисбактериоза.
Взаимосвязь функции местного иммунитета и микробиоценоза кишечника, возможности иммунокоррекции дисбактериоза
Желудочно-кишечный тракт (ЖКТ) выполняет не только пищеварительную, но и иммунную функцию, в частности, участвует в реализации защитных реакций организма против патогенных, условно-патогенных микроорганизмов и многих неорганически
Желудочно-кишечный тракт (ЖКТ) выполняет не только пищеварительную, но и иммунную функцию, в частности, участвует в реализации защитных реакций организма против патогенных, условно-патогенных микроорганизмов и многих неорганических веществ.
Местный иммунитет кишечника
Около 80% всех иммунокомпетентных клеток организма локализовано именно в слизистой оболочке кишечника; около 25% слизистой оболочки кишечника состоит из иммунологически активной ткани и клеток; каждый метр кишечника содержит около 1010 лимфоцитов [1].
Иммунокомпетентная (лимфоидная) ткань ЖКТ представлена организованными структурами (пейеровы бляшки, аппендикс, миндалины, лимфатические узлы) и отдельными клеточными элементами (интраэпителиальные лимфоциты, плазматические клетки, макрофаги, тучные клетки, гранулоциты). Популяция клеток лимфоидной ткани разнородна и состоит из множества групп, подгрупп и клонов клеток с различными функциональными свойствами и специфичностью рецепторов к антигенам [2, 3].
Эпителий ЖКТ отграничивает ткани макроорганизма от огромного количества живых и неживых антигенов — субстанций, несущих признаки чужеродной генетической информации. Пероральное воздействие антигена (в том числе микробов и их токсинов) обычно создает, с одной стороны, местную «слизистую» IgA-защиту (секреторный иммунитет) и клеточно-опосредованную реакцию, но, с другой стороны, и системную толерантность или гипореактивность — подавление последующей выработки антигеноспецифических антител классов G и М и развития клеточно-опосредованного иммунитета. По отношению к патогенным и условно-патогенным микроорганизмам система местного иммунитета кишечника должна проявить адекватные защитные свойства, а по отношению к нормофлоре — как минимум, толерантность, а в лучшем случае — активно участвовать в процессах адгезии, выживания и размножения представителей нормофлоры.
Специфические иммунные механизмы вырабатываются кишечником для защиты от потенциально опасных микроорганизмов в течение всей жизни. Недифференцированные лимфоциты, продуцирующие в большинстве своем секреторные IgA- или IgM-антитела, присутствуют в собственном слизистом слое или пейеровых бляшках. Стимуляция В- и Т-лимфоцитов в присутствии чужеродного антигена происходит вслед за их выходом из брыжеечных узлов в грудной проток, кровеносное русло и возвращением в кишечник, где они скапливаются также в собственном слое слизистой оболочки. Активированные клетки продуцируют специфические антитела классов IgА и IgМ, которые секретируются на поверхности слизистой оболочки через 4–8 дней после стимуляции. Иммуноглобулины образуют комплексы с антигенами, нейтрализуют токсины, препятствуют контакту микроорганизмов с клетками-«мишенями» макроорганизма, способствуют быстрому выведению микроорганизмов из ЖКТ благодаря агглютинации.
Главная функция кишечных антител — иммунное отторжение у поверхности слизистой оболочки. Известно, что IgA преобладает среди иммуноглобулинов во всех секретах и в собственной пластинке кишечника. Секреторный IgA, выполняющий роль главного «чистильщика» и иммуномодулятора слизистой оболочки ЖКТ, удерживается около эпителиальных клеток в результате взаимодействия с гликокаликсом, во многом благодаря присутствию нормофлоры. IgA занимает благоприятную позицию, препятствующую поглощению антигенов. Двумерная молекула IgA может функционировать как агглютинин, уменьшая прилипание бактерий к энтероцитам [4].
В слизистой оболочке кишечника есть также клетки, вырабатывающие иммуноглобулины других классов, но их значительно меньше. Так, соотношение плазматических клеток, продуцирующих IgA, IgM, IgG, равно соответственно 20:3:1 [2].
Важнейшее свойство системы местного иммунитета кишечника — феномен рециркуляции лимфоцитов. Сенсибилизированные антигенами (как пищевыми, так и инфекционными) лимфоциты пейеровых бляшек мигрируют в брыжеечные лимфатические узлы, а оттуда по лимфатическим сосудам через грудной проток и систему кровообращения направляются к собственному слою слизистой оболочки кишечника, главным образом в качестве клеток, секретирующих IgA. Этот механизм обеспечивает формирование клонов лимфоцитов и образование специфических антител в участках слизистой оболочки, отдаленных от очага первичной сенсибилизации. В процессе сенсибилизации плазматических клеток с последующим клонированием лимфоцитов, вырабатывающих антитела с определенными свойствами (аналогичными тем, которые выступили матрицей), участвуют не только нативные молекулы иммуноглобулинов, но и активные Fc- и F(ab’)2-фрагменты.
Клеточный иммунитет кишечника в отличие от системы секретируемых им антител изучен недостаточно. Известно, что после перорального воздействия антигенов системные клеточные иммунные реакции выявляются редко. Очевидно, когда здоровые люди получают безвредные антигены (например, антигены нормофлоры), в слизистой оболочке кишечника не развиваются реакции клеточного иммунитета [2].
Система местного иммунитета кишечника работает следующим образом. Попавшие в просвет кишечника или на слизистые оболочки микроорганизмы распознаются иммуноглобулинами памяти (IgG), после чего информация передается в иммунокомпетентные клетки слизистой оболочки, где из сенсибилизированных лимфоцитов клонируются плазматические клетки, ответственные за синтез IgА и IgМ. В результате защитной деятельности этих иммуноглобулинов включаются механизмы иммунореактивности или иммунотолерантности. Иммунная система «запоминает» антигены нормофлоры, чему способствуют генетические факторы, а также антитела класса G, передающиеся от матери плоду во время беременности, и иммуноглобулины, поступающие в ЖКТ ребенка с грудным молоком. В результате рециркуляции лимфоцитов и клонирования иммунный ответ охватывает все слизистые ЖКТ.
Регуляция иммунных реакций слизистой оболочки кишечника представляет собой сложный процесс, который может изменяться в различных ситуациях, таких как: наличие или отсутствие повреждения слизистой оболочки, сохранение целостности и функциональности биопленки, наличие острых или хронических инфекций, зрелость иммунной системы, состояние питания и генетический потенциал индивидуума. В результате повреждения слизистой оболочки могут возникнуть изменения иммунологической реактивности, хотя в этой ситуации трудно различить первичные и вторичные эффекты.
Роль кишечной микрофлоры в иммунных реакциях
Микрофлора кишечника защищает человека от колонизации экзогенными патогенными микроорганизмами и подавляет рост уже имеющихся в кишечнике патогенных микроорганизмов за счет конкуренции за питательные вещества и участки связывания, а также выработки определенных ингибирующих рост патогенов субстанций. Кроме того, бактерии участвуют в реализации иммунологических защитных механизмов [5].
Известно, что одна из функций нормофлоры — иммунотропная, заключающаяся в стимуляции синтеза иммуноглобулинов, потенцировании механизмов неспецифической резистентности, системного и местного иммунитета, пропердина, комплемента, лизоцима, а также в стимуляции созревания системы фагоцитирующих мононуклеаров и лимфоидного аппарата кишечника [6, 7]. Нормофлора активирует не только местный иммунитет кишечника, но и иммунную систему всего организма, что подтверждается в опытах на безмикробных животных [8]. Основные направления деятельности индигенной (нормальной) микрофлоры в обеспечении нормального иммунного ответа: изменение иммуногенности чужеродных белков путем протеолиза; снижение секреции медиаторов воспаления в кишечнике; снижение интестинальной проницаемости; направление антигена к пейеровым бляшкам. Эти же эффекты реализуются в пробиотических препаратах [5].
В кишечнике бактерии являются важнейшей составной частью биопленки: гликокаликс — слизь — IgA — нормофлора. Биопленка покрывает слизистую кишечника изнутри, занимает все выпуклости, образуемые энтероцитами, и защищает слизистую оболочку от дегидратации, физической и химической агрессии, а также от атак микроорганизмов, бактериальных токсинов, паразитов [9].
На фоне снижения бифидо- и лактобактерий повышается проницаемость эпителиального барьера кишечника для макромолекул пищи и дефицит секреторного IgA [10]. В свою очередь, дефицит секреторного IgA может приводить к развитию заболеваний кишечника и к частым синубронхиальным инфекциям, а в конечном итоге — к предрасположенности к атопии и аутоиммунным заболеваниям [11].
Проведенные на животных исследования показали, что при нарушениях биоценоза в ЖКТ развивается аутоиммунизация к комплексному антигену кишечной стенки, а применение иммунобиологических препаратов предотвращает этот процесс [12].
Дисбактериоз как иммунная дисфункция
Иммунная система регулирует баланс биоценоза кишечника, т. е. механизмы саморегуляции нормофлоры контролируются местным иммунитетом кишечника. Поскольку любой микроорганизм является антигеном, должны существовать механизмы отторжения чужеродных микроорганизмов, а также толерантности и создания благоприятных условий для нормофлоры.
Известно, что через плаценту от матери плоду передаются IgG, то есть иммуноглобулины, обеспечивающие иммунологическую память. Антитела классов М и А через плаценту не проходят, что объясняет недостаточную защищенность новорожденного против грамотрицательных микроорганизмов (энтеробактерии, сальмонеллы) [13]. Кроме того, доказано, что первые микроорганизмы, попадающие в кишечник, появляются там в процессе и после рождения ребенка и прикрепляются к определенным рецепторам [14]. Процесс специфической адгезии условно-патогенных и болезнетворных микроорганизмов к слизистой оболочке ЖКТ может блокироваться среди прочих факторов присутствием IgA и лизоцимом, которые, в свою очередь, способствуют адгезии к рецепторам представителей бифидо- и лактофлоры [15].
Подтверждением роли IgA в предотвращении колонизации слизистых оболочек посторонними микроорганизмами является тот факт, что 99% бактерий представителей нормофлоры не покрыты секреторными иммуноглобулинами. Напротив, энтеробактерии, стафилококки, другие условно-патогенные и сапрофитные микроорганизмы полностью покрыты IgA [8]. В основе этого явления лежит феномен иммунологической толерантности к нормофлоре.
У новорожденных и детей раннего возраста транзиторная иммунная недостаточность — биологическая закономерность, в основном относящаяся к гуморальному иммунитету [13]. У детей этой возрастной группы значительно чаще, чем у детей старше года, возникают стойкие нарушения биоценоза кишечника, что отчасти связано с недостаточностью иммунной системы.
Физиологическая недостаточность системы местного иммунитета кишечника в первые три мес жизни ребенка компенсируется поступлением IgA и других защитных факторов с женским молоком. При грудном вскармливании ежесуточно ребенок получает до 1,5 г IgА. У детей, находящихся на искусственном или раннем смешанном вскармливании, т. е. лишенных защитных факторов женского молока, значительно чаще наблюдаются пищевые аллергии и дисбактериозы кишечника, что отмечается большинством исследователей в этой области.
Проникновение инфекционных агентов на слизистые оболочки ЖКТ и других органов вызывает ответную реакцию системы местного иммунитета в виде нарастания концентрации IgA, который вырабатывается при участии нормофлоры. Соответственно, может возникнуть ситуация, когда микробиологический дисбаланс одного типа будет способствовать усугублению микроэкологических нарушений. Так, снижение количества нормофлоры влечет за собой дефицит IgA, в результате чего повышается колонизация слизистых оболочек условно-патогенной флорой (УПФ).
Врожденные и транзиторные аномалии системы местного иммунитета кишечника снижают резистентность организма не столько к агрессивным вирулентным микроорганизмам, сколько к УПФ. С ними связана устойчивость кишечного дисбактериоза [16].
Практически у 100% людей с приобретенными иммунодефицитами (в результате радиационного воздействия и других иммуносупрессорных факторах) имеются нарушения состава кишечной микрофлоры, при этом у них отмечается не только повышенный рост УПФ, но и резкое снижение нормофлоры [8], то есть нарушаются и защитная функция местного иммунитета, и иммунологическая толерантность, что может косвенно свидетельствовать о том, что система местного иммунитета способствует не только элиминации чужеродных микроорганизмов, но и создает оптимальные условия (а не только иммунологическую толерантность) для нормофлоры.
Учитывая значительное взаимодействие между биоценозом кишечника и системой местного иммунитета кишечника, целесообразно считать дисбактериоз не только микробиологической, но и иммунологической проблемой, что должно отражаться в лечебной тактике.
Иммунокоррекция при дисбактериозе кишечника
Развитие дисбактериоза свидетельствует о недостаточности работы системы местного иммунитета кишечника. Полностью поддерживая тезис о вторичности нарушений биоценоза (дисбактериоз всегда вторичен и причинно обусловлен), можно считать, что одной из причин развития любого дисбактериоза является иммунологическая дисфункция и, прежде всего, недостаточность гуморального иммунитета.
У детей первых месяцев жизни транзиторная иммунная недостаточность — это биологическая закономерность, в основном относящаяся к гуморальному иммунитету. Именно поэтому у детей этой возрастной группы значительно чаще, чем у детей старше года, возникают стойкие и транзиторные нарушения биоценоза кишечника без каких-либо других видимых причин. Затем причинами иммунной дисфункции могут быть хронические вялотекущие паразитарные или микробные инфекции, острые кишечные инфекции, острые респираторные заболевания, детские инфекции, вакцинации; неблагоприятные экологические факторы; стрессы; применение антибиотиков и др. Очень часто проявления дисбактериоза отмечаются через некоторое время после перечисленных воздействий.
Основное средство для иммунокоррекции дисбактериоза — комплексный иммуноглобулиновый препарат (КИП), разработанный сотрудниками МНИИЭМ им. Г. Н. Габричевского [17]. Материалом для получения КИП служит донорская плазма от нескольких тысяч доноров, поэтому можно говорить о коллективном иммунитете. КИП, в отличие от нормального иммуноглобулина человека, содержит иммуноглобулины трех классов: 50% IgG, 25% IgM, 25% IgA. КИП характеризуется повышенным содержанием антител к энтеробактериям (шигеллы, сальмонеллы, эшерихии, протей, клебсиелла и др.), Pseudomonas aeruginosa, стафилококкам, а также к ротавирусам. Таким образом, в состав КИП входят иммуноглобулины 3 классов к основным видам патогенной и условно-патогенной флоры. Специфические антитела, содержащиеся в КИП, нейтрализуют действие энтеропатогенных микроорганизмов, что достигается наличием в препарате антител одинаковой специфичности, но разных классов, способствующих агглютинации, нейтрализации и преципитации инфекционных агентов.
Препарат представляет собой лиофилизированную смесь во флаконах. 1 стандартная доза содержит 300 мг белка и следовые количества консервантов. Введенный через рот, КИП частично расщепляется в желудке и двенадцатиперстной кишке на активные составляющие: Fc- и F(ab’)2-фрагменты, которые сохраняют серологическую и антигенсвязывающую активность иммуноглобулинов [18]. Эти фрагменты имеют слишком большую молекулярную массу, чтобы проникнуть в системный кровоток через слизистую оболочку кишечника, поэтому КИП оказывает в основном местное действие в просвете, на слизистых оболочках и в собственном слое слизистой оболочки, проникая в кровоток в микроколичествах путем пиноцитоза и т. п. Действие КИП происходит на протяжении всего ЖКТ, но особенно в толстом кишечнике, где сосредоточено большое количество лимфоидной ткани (пейеровы бляшки).
Чтобы понять механизм действия КИП, следует вспомнить основные положения классической иммунологии [13, 16]. Известно, что наиболее представленные в сыворотке крови любого человека IgG (75%) имеют самую простую среди антител структуру и являются основными носителями иммунологической памяти. Специфические моноклональные иммуноглобулины образуются в лимфоидной ткани, их синтезируют лимфоциты, прошедшие дифференцировку за счет сенсибилизированных антигеном антител. Несмотря на короткий срок жизни иммуноглобулинов класса G (21–28 дней), за счет дифференцировки лимфоцитов иммунологическая память сохраняется достаточно долго (часто пожизненно). Молекулы иммуноглобулинов у всех людей имеют сходную структуру (например, IgG к клебсиеллам одинаков у всех), поэтому не воспринимаются иммунной системой как чужеродные белки. Введенные в организм «чужие» антитела, достигнув лимфоидной ткани кишечника, включаются в формирование иммунологической памяти наряду с собственными, которые вырабатываются в результате контакта с антигеном. Феномен рециркуляции лимфоцитов способствует образованию специфических антител в участках слизистой оболочки, отдаленных от очага первичной сенсибилизации. Поэтому иммуноглобулины, введенные энтерально, не только выполняют функцию иммунного ответа в кишечнике, но и выступают в роли матрицы, с которой клонируются плазматические клетки с заданными свойствами. Система местного иммунитета кишечника приобретает способность противостоять тем микроорганизмам, антитела к которым содержатся в КИП. Пассивная иммунизация ребенка, получающего материнское молоко, осуществляется аналогично через иммуноглобулины, содержащиеся в нем. Таким образом, иммунокоррекция комплексным иммуноглобулиновым препаратом физиологична. КИП стимулирует механизмы развития собственного местного гуморального иммунитета, что особенно важно для детей, лишенных материнского молока.
Кроме действия на иммунитет кишечника, КИП обладает прямым антимикробным действием за счет содержания в нем антител классов М и А. Эти иммуноглобулины, связываясь с комплементом, вызывают лизис бактерий. Поэтому КИП может использоваться без добавления других антибактериальных препаратов [19].
Для коррекции микробиологических нарушений КИП назначают курсом 5–10 дней по 1 дозе 1 раз в сутки (утром за 30 мин до еды). Пятидневный курс рекомендован при следующих типах дисбактериоза:
Пролонгированные курсы КИП (десятидневный или два пятидневных курса с интервалом между ними 5 дней — схема 5+5) показаны:
Пролонгированные курсы при описанных ситуациях оказались эффективнее традиционного пятидневного курса, что подтвердило специальное исследование [20].
Кроме КИП во флаконах существуют свечные формы, а также комбинации КИП с интерфероном (Кипферон). Кипферон в свечах обладает местным действием в дистальных отделах прямой кишки и общим иммуностимулирующим действием за счет всасывания в геморроидальном сплетении прямой кишки (система нижней полой вены).
КИП в свечах используется у детей со следующими показаниями: запоры, сопровождающиеся развитием трещин прямой кишки; симптомы колита; профилактика и лечение респираторных инфекций у детей старше 1 года; а также совместно с КИП во флаконах, применяемым per os, для усиления иммуностимулирующего действия у детей с выраженным ослаблением иммунитета.
Курс лечения КИП в свечах составляет 5–10 дней, по 1/2–1 свече однократно на ночь, после опорожнения кишечника. Улучшение самочувствия ребенка наступает в процессе лечения или по окончании курса. Эффект применения КИП в свечах подтверждается лабораторными исследованиями.
Кроме коррекции дисбактериоза КИП используют в сочетании с традиционной этиотропной и патогенетической терапией для лечения острых кишечных инфекций установленной или неясной этиологии, особенно у детей раннего возраста [21, 22]. У больных на 2–3 день уменьшается интоксикация, снижается кратность стула, улучшается его консистенция, исчезают патологические примеси, а на 5–6 день наступает нормализация стула. Исследование микрофлоры кишечника показывает санацию организма от возбудителя, при этом, в отличие от использования антибиотиков, уменьшения количества нормофлоры не наблюдается. Свечи с КИП показаны для лечения острых кишечных инфекций у выборочного контингента детей (при рвоте, непереносимости орального введения и т. д.).
Безопасность использования КИП
КИП с осторожностью следует применять у детей с аллергией на белок, реакцией на введение иммуноглобулинов в анамнезе, а также при других ситуациях, чреватых развитием побочных реакций при использовании, и противопоказаниях к применению иммуноглобулинов.
Технология получения КИП, включающая спиртовое фракционирование сыворотки с последующим осаждением фракции иммуноглобулинов полиэтиленгликолем, исключает возможность передачи с препаратом вирусов гепатита В, ВИЧ и других патогенных микроорганизмов. Кроме того, донорская или плацентарная кровь, из которых получают плазму для приготовления КИП, а также серии готового препарата тщательно проверяют. Поэтому опасения инфицирования посредством приема КИП не обоснованы [23].
Клинически выраженные аллергические реакции при приеме КИП наблюдались крайне редко. В некоторых случаях (особенно при совместном использовании с бактериофагами) отмечалось кратковременное ухудшение самочувствия, усиление имевшихся до начала лечения симптомов, что, по-видимому, связано с лизисом УПФ. У некоторых детей на фоне приема КИП снижался аппетит, но восстанавливался всегда быстро и самостоятельно.
Использование КИП пролонгированными курсами не увеличило частоту побочных эффектов по сравнению с традиционными схемами. Для подстраховки в отдельных случаях одновременно с приемом КИП можно назначать антигистаминные препараты.
По вопросам литературы обращайтесь в редакцию.
Ю. А. Копанев, кандидат медицинских наук НИИ эпидемиологии и микробиологии им. Г. Н. Габричевского, Москва
Схемы и подходы к лечению дисбактериоза у взрослых
Дисбиоз (дисбактериоз) – изменение состава и соотношения видов микрофлоры в организме человека, появление неспецифичных для нормы микроорганизмов. Такое состояние возникает под действием конкурирующих болезнетворных микробов, антибиотиков, нарушений питания и др. Процесс может поразить носоглотку, половую систему, но чаще всего поражает пищеварительную систему с развитием дисбактериоза кишечника.
Виды и причины
У практически здоровых лиц встречается возрастной, сезонный, пищевой или профессиональный дисбиоз. В таких ситуациях пациент обычно не имеет жалоб, но при нарушении диеты, переутомлении, перегревании возникают нарушения стула и вздутие живота.
Причины дисбиоза разнообразны, так как на микрофлору негативно влияют многие внешние и внутренние факторы.
Дисбактериоз может осложнить течение следующих заболеваний:
Нередко возникает необходимость в лечении дисбактериоза после приема антибиотиков.
Диагностика
Диагноз можно предположить при наличии одного или нескольких клинических синдромов. Наиболее характерны следующие:
Помимо симптомов, диагностика дисбактериоза основана на изменениях в анализе каловых масс. При микробиологическом исследовании обнаруживают такие изменения:
Таким образом, для дисбиоза характерно нарушение соотношения нормальных и условно-патогенных представителей кишечной микрофлоры. Поэтому лечение дисбактериоза должно восстанавливать баланс микроорганизмов.
Лечение
Терапия начинается с отмены применяемых антибиотиков. Лечение дисбактериоза у взрослых и детей требует изменения образа жизни – уменьшения стрессов, восстановления режима, применения седативных лекарственных растений. Необходимо устранить очаги инфекции, например, кариес зубов.
Схема лечения дисбактериоза кишечника включает такие компоненты:
Терапию начинают с элиминации (подавления) условно-патогенных микроорганизмов. Для этого необязательно использовать антибиотики. Нередко эффективны бактериофаги, иммуноглобулины, пробиотики и пребиотики для кишечника.
Пробиотики, пребиотики, метапребиотики – в чем разница?
Пробиотики содержат полезные бактерии в высушенном или растворенном виде. Они нередко применяются для восстановления микрофлоры кишечника.
Пребиотики – вещества, необходимые для роста нормальной микрофлоры. Они ускоряют восстановление за счет создания благоприятной среды для бактерий, эффективны для лечения дисбактериоза после антибиотиков.
Метабиотики – микробиологические средства на основе компонентов полезной микрофлоры. Они улучшают физиологию, обмен веществ и другие функции нормальных микроорганизмов. Их можно принимать одновременно с антибиотиками. Также по сравнению с пробиотиками такие препараты для микрофлоры кишечника проще дозировать, они безопаснее, лучше хранятся.
Эффективность метапребиотика Стимбифид Плюс доказана в клинических условиях. Препарат повышает устойчивость нормальной микрофлоры к колонизации условно-патогенными микроорганизмами, поэтому эффективен не только для лечения, но и для профилактики дисбактериоза.
Кишечный и влагалищный микробиоценоз и его влияние на репродуктивное здоровье женщины
При нормальном функционировании всего организма в целом и иммунной системы в частности, в просвете кишечника и влагалища женщины сохраняется баланс между полезными и условно патогенными микроорганизмами. При дефиците молочной кислоты в просвете влагалища, создаются благоприятные условия для размножения болезнетворных микроорганизмов, развития дисбактериоза и других заболеваний мочеполовой системы.
Нередко, влагалищный дисбактериоз протекает в комбинации с кишечным дисбиозом или является его следствием.
Причины влагалищного дисбиоза
В норме, слизистая оболочка влагалища заселена лактобактериями и бифидобактериями. Существует целый перечень факторов, которые потенциально могут вызывать нарушение баланса между полезной и условно-патогенной микрофлорой в просвете влагалища. К таким факторам можно отнести:
Симптомы влагалищного дисбиоза
На начальной стадии развития микробиоценоза влагалища, симптоматика заболевания может полностью отсутствовать. По мере нарастания количества болезнетворных микроорганизмов, на первый план выходят такие клинические проявления дисбиоза:
Взаимосвязь кишечного и влагалищного дисбактериоза
Большинство предрасполагающих факторов одинаковы как для влагалищного, так и для кишечного микробиоценоза. Взаимосвязь между дисбиозом кишечника у женщин и репродуктивным здоровье можно отследить на примере такого заболевания, как эндометриоз. Это патологическое состояние характеризуется формированием очагов эндометрия за пределами полости матки.
Немалое значение в механизме развития данного гинекологического заболевания, играют ретроградные менструации, при которых жизнеспособные клетки слизистой оболочки матки попадают в брюшную полость. Вероятность развития эндометриоза при таком сценарии во многом зависит от реакции иммунной системы, важным звеном которой является микробиота кишечника.
Кроме того, дисбаланс микрофлоры в кишечнике и влагалище, может приводить к увеличению уровня эстрогенов в организме женщины, что способствует быстрому прогрессированию эндометриоза. Повышение уровня гормонов эстрогенов, также способствует стремительному росту как доброкачественных, так и злокачественных новообразований женской репродуктивной системы.
Сам по себе дисбактериоз влагалища является тем состоянием, которое в буквальном смысле нарушает естественную защиту женской репродуктивной системы. Снижение местного иммунитета и активизация болезнетворных микроорганизмов увеличивает до максимума риск развития инфекционно-воспалительных заболеваний органов малого таза, чреватых развитием осложнений, включая бесплодие.
Также, была клинически подтверждена связь между нарушением баланса влагалищной микрофлоры и высоким риском формирования рака и предрака шейки матки. Сравнительное исследование мазков из шейки матки здоровых женщин и пациенток с диагностированным предраком шейки матки доказало разность состава микрофлоры. В первом случае, в мазке преобладают лактобактерии, а во втором случае, над полезной микрофлорой доминируют условно патогенные и патогенные микроорганизмы. Кроме того, дефицит лактобацилл в просвете влагалища, подрывает сопротивляемость женского организма перед вирусом папилломы человека (ВПЧ), который в 90% случаев является причиной развития онкологии шейки матки.
Способы восстановления микрофлоры влагалища и кишечника
Развитие влагалищного или микробиоценоза кишечника по отдельности или в совокупности можно предотвратить, соблюдая при этом общие рекомендации. Для того чтобы сохранить репродуктивное здоровье, избежать развития заболеваний органов мочеполовой системы, необходимо придерживаться таких простых правил:
Для восстановления микрофлоры кишечника назначаются пребиотики, пробиотики, метабиотики, симбиотики, которые восполняют дефицит полезных микроорганизмов. При лечении влагалищного дисбиоза чаще назначаются вагинальные суппозитории и капсулы, содержащие молочную кислоту и лактобациллы. Оба вида микробиоценоза поддаются эффективному лечению с помощью метапребиотика Стимбифид Плюс, не имеющего конкурентов среди лучших пробиотиков для восстановления микрофлоры кишечника. Метапребиотик не восполняет популяцию бактерии извне, но помогает эффективно и быстро увеличить количество собственных полезных бактерий в просвете кишечника и влагалища. Данное средство на практике зарекомендовала себя как с лечебной, так и с профилактической целью. Стимбифид Плюс рекомендован для лечения дисбактериоза у женщин и сохранения репродуктивного здоровья.
Способы борьбы с дисбактериозом кишечника
В кишечнике человека находятся огромное количество микроорганизмов. Они могут приносить пользу человеку, но могут и навредить. У здорового человека они находятся в балансе. Однако, если количество полезных микроорганизмов уменьшается, то это приводит к плохому самочувствию и заболеваниям. Дисбактериоз — это нарушение баланса микроорганизмов.
Дисбактериоз не является заболеванием, но может привести к ним, если вовремя не обратить внимание на сигналы организма.
Причины появления дисбактериоза
Все симптомы появляются не сразу, так как организм пытается бороться с проблемой.
При дисбактериозе выделяют следующие симптомы:
Нередко при дисбактериозе могут появиться аллергические реакции, например, зуд, шелушения и высыпания. Может появится аллергия на привычные продукты.
Причины возникновения дисбактериоза
Кишечник является главным источником получения полезных веществ. Но если он начинает работать плохо, то ухудшается иммунитет человека, что приводит к заболеваниям. Поэтому важно знать причину возникновения дисбактериоза.
Главной причиной к появлению дисбактериоза являются антибиотики. Антибиотики будут негативно влиять на микрофлору кишечника, даже если правильно подобрать препараты и дозировку. Для защиты кишечника важно принимать параллельно с антибиотиками препараты, которые будут защищать кишечник.
Также есть другие причины, которые приводят к дисбактериозу:
Способы лечения дисбактериоза
Диета. Питание влияет на микрофлору кишечника, поэтому важно включать в рацион быстрые углеводы, овощи и свести к минимуму потребление жиров. Чем разнообразнее питание, тем больше организм получает питательных компонентов.
Можно придерживаться следующих правил питания:
Медикаментозное лечение. Прием пребиотиков для стимуляции размножения микробов, которые благоприятно влияют на организм. Пробиотики, которые содержат бактерии для нормальной микрофлоры кишечника.
Для уничтожения патогенной микрофлоры применяют антибактериальные препараты.
На финальных стадиях лечения можно принимать препараты для повышения иммунитета.
Для предотвращения появления дисбактериоза необходимо правильно принимать антибиотики, правильно питаться, отказаться от вредных привычек.
Особенности применения препаратов для микробиологической коррекции дисбактериоза кишечника у детей
В комплексной терапии дисбактериоза кишечника у детей выделяют следующие направления: иммунокоррекция, микробиологическая коррекция, коррекция нарушений функций желудочно-кишечного тракта (ЖКТ), лечение сопутствующих заболеваний (прежде всего паразитарных
Ю. А. Копанев
НИИ эпидемиологии и микробиологии им. Г. Н. Габричевского, Москва
Л. Г. Кузьменко, доктор медицинских наук, профессор
В комплексной терапии дисбактериоза кишечника у детей выделяют следующие направления: иммунокоррекция, микробиологическая коррекция, коррекция нарушений функций желудочно-кишечного тракта (ЖКТ), лечение сопутствующих заболеваний (прежде всего паразитарных и хронических инфекционных) [1, 3, 4].
Использование комплексных схем лечения, включающих препараты этих направлений, дают более
выраженный и стойкий клинический и микробиологический эффект, нежели лечение, охватывающее лишь одно из данных направлений
В результате наблюдений в течение трех лет за детьми, получавшими лечение по поводу дисбактериоза кишечника (1-1,5 тысячи пациентов в год), мы выделили некоторые особенности микробиологической коррекции у детей.
Микробиологическая коррекция включает в себя антимикробные препараты и препараты бактерий нормальной кишечной флоры (эубиотики).
Антимикробные препараты при лечении дисбактериоза назначаются для селективной деконтаминации, т. е. целенаправленного снижения количества условно-патогенных микроорганизмов. Для этой цели используются бактериофаги, кишечные антисептики (фуразолидон, интетрикс, энтерол и др.), растительные антисептики (хлорофиллипт, ротокан), противогрибковые препараты [1]. Доказано прямое антимикробное действие комплексного иммуноглобулинового препарата (КИП) [2]. Применение антибиотиков для коррекции дисбактериоза нежелательно, так как эти препараты часто приводят к усугублению микробиологических нарушений аутофлоры. Тем не менее применение антибиотиков оправданно, когда дисбактериоз является следствием хронического инфекционного заболевания (хламидиоз, йерсиниоз).
Особенности применения антимикробных препаратов
1. Применение любых препаратов для селективной деконтаминации может привести к ухудшению состояния. Это связано с токсическим действием продуктов распада условно-патогенных микроорганизмов. Если в составе микробиоценоза кишечника снижено количество бактерий аутофлоры, выполняющих барьерную функцию, вероятность осложнений увеличивается. При ухудшении состояния, которое может быть существенным, следует подключить симптоматическую терапию или приостановить проведение деконтаминации.
2. Антимикробная терапия может оказаться неэффективной без сопутствующей иммунокоррекции.
3. Длительное непрерывное (более двух недель) применение антимикробных препаратов, в том числе бактериофагов, не оправданно, так как в этом случае происходят нарушения состава аутофлоры кишечника. В частности, угнетается кишечная палочка с нормальной ферментативной активностью, а также лактобактерии.
4. В случае когда дисбактериоз кишечника вызван очагом хронической инфекции (хламидии, йерсинии), антибактериальная терапия будет более эффективна, если ее начать в стадии обострения, и менее эффективна, если ее начинать в фазе ремиссии.
Эубиотики (пробиотики) — препараты живых бактерий нормальной кишечной флоры — применяются при коррекции дисбактериоза кишечника с дефицитом этих микробов в составе микробиоценоза кишечника [5]. Препараты данной группы применяются также в ситуациях, когда требуется поддержание микробиоценоза при каких-либо неблагоприятных факторах: кишечные или респираторные инфекции, применение антибактериальных препаратов, в качестве профилактики поствакцинальных осложнений, при прорезывании зубов и др.
Наиболее широко известные эубиотики: отечественные — сухие бифидумбактерин, лактобактерин, ацилакт, аципол, бификол, колибактерин; импортные — примадофилюс, флорадофилюс, линекс. Относительно недавно появились и хорошо себя зарекомендовали жидкие формы: жидкий бифидумбактерин (жидкий концентрат бифидобактерий, ЖКБ), жидкий лактобактерин (жидкий концентрат лактобактерий, ЖКЛ). Препараты примадофилус и фермент лактаза применяются в различных возрастных группах с целью коррекции нарушенной микрофлоры и уменьшения брожения в пищеварительном тракте. Иногда метеоризм и нарушения стула бывают даже у находящихся на естественном вскармливании детей. Для коррекции подобных нарушений, часто связанных с возрастной ферментативной недостаточностью, возможно назначение ферментного препарата лактозы. Можно добавлять содержимое капсулы непосредственно в молоко или молочные продукты.
Примадофилус применяется для коррекции дисбактериоза в любой возрастной группе, поскольку в каждую из четырех форм выпуска препарата включены специально отобранные те виды бифидо- и лактобактерий, которые встречаются в норме в данном возрасте. Препарат выпускается в кишечнорастворимых капсулах и в порошке — для младенцев.
Рекомендуется: обычная доза приема — одна капсула, в порошке — один раз в день по чайной ложке во время еды.
Порошок может добавляться к любым видам пищи, включая детское питание.
Особенности применения эубиотиков
1. Лечебные дозы для восстановления бифидо- и лактофлоры при очень существенном снижении количества этих бактерий (бифидобактерии менее 107, лактобактерии менее 105) — по 5 доз каждого из препаратов два раза в день при курсе лечения не менее трех недель. Применение меньших доз или короткие курсы лечения в этой ситуации часто оказываются недостаточно эффективными.
2. При умеренном снижении бифидо- и лактофлоры (бифидобактерии не менее 107, лактобактерии не менее 105) эффективно использование эубиотиков по 5 доз один раз в сутки. Как поддерживающие препараты эубиотики могут успешно использоваться короткими курсами (7-10 дней).
3. Аутофлора восстанавливается лучше при совместном применении эубиотиков и ферментативных препаратов (абомин, мезим-форте, креон и др.) [4]. Препараты ЖКБ и ЖКЛ содержат ферменты.
4. Во время применения эубиотиков возможно кратковременное ухудшение самочувствия ребенка, не требующее отмены препаратов. Чем активнее препарат, тем более вероятно ухудшение в процессе лечения. Лечение самыми активными из современных эубиотиков — ЖКБ и ЖКЛ — нередко приводит к появлению болей в животе, обострению или появлению кожных высыпаний, изменению характера стула. Все эти явления практически всегда проходят в течение недели, не требуя коррекции терапии.
5. При длительном использовании с лечебной целью однокомпонентных препаратов (например, включающих только бифидофлору) желательно совместно применять в поддерживающей дозе препараты других бактерий аутофлоры. В противном случае, по нашим наблюдениям, может развиться нежелательный перекос микробиоценоза в сторону одной из трех главных групп (бифидофлора, лактофлора, кишечная палочка с нормальной ферментативной активностью) с угнетением остальных.
Знание этих особенностей может помочь более грамотно назначать терапию и правильно оценивать происходящие во время микробиологической коррекции изменения состояния.
Литература
1. Коровина Н. А., Вихирева З. Н., Захарова И. Н., Заплатников А. Л. Профилактика и коррекция нарушений микробиоценоза кишечника у детей раннего возраста. М., 1995.
2. Копанев Ю. А., Соколов А. Л., Алешкин В. А., Пожалостина Л. В., Ефимова О. Г. Действие комплексного иммуноглобулинового препарата на условно-патогенную флору // Врач. 1998. № 5. С. 38.
3. Мухина Ю. Г. Диагностика и коррекция дисбактериоза у детей // Русский медицинский журнал. 1999. №11. С. 487-494.
4. Таболин В. А., Бельмер С. В. и др. Рациональная терапия дисбактериоза кишечника у детей. М., 1998.
5. Применение бактерийных биологических препаратов в практике лечения больных кишечными инфекциями. Диагностика и лечение дисбактериоза кишечника. Методические рекомендации. М., 1986.
Дюфалак — мягкое слабительное для любого возраста
Дюфалак – лекарственное средство с мягким слабительным эффектом, которое регулирует работу кишечника. Оно рекомендовано при запорах, улучшает перистальтику, содержит безопасную для здоровья лактулозу. Это позволяет использовать препарат при лечении пациентов любого возраста.
Показания к применению
Лекарственное средство Дюфалак содержит пробиотик, который изнутри нормализует микрофлору, ускоряет сокращение мускулатуры кишечника. Это стимулирует его очищение естественным путем. При его употреблении увеличивается объем каловых масс, уменьшается поступление токсинов в кровь, а опорожнение проходит легко и без неприятных ощущений.
Инструкция по применению Дюфалак содержит следующие рекомендации:
Препарат Дюфалак назначают для очищения кишечника перед проведением сложных диагностических процедур (колоноскопии, МРТ, КТ), при необходимости оперативного вмешательства на брюшной полости. Применение Дюфалак взрослым показано при запорах, которые вызваны следующими причинами:
При функциональных запорах Дюфалак восстанавливает работу кишечника, ускоряет выведение каловых масс, защищает от интоксикации.
Действие на организм
Основное активное вещество – лактулоза. Это дисахарид, который включает в себя молекулы фруктозы и галактозы. Его синтезируют из сырной сыворотки и молочных продуктов, поэтому компонент имеет натуральное происхождение. При попадании в кишечник лактулоза вступает в контакт с микрофлорой. Бактерии делят полезное вещество на низкомолекулярные органические кислоты. Это значительно увеличивает объем содержимого кишки, повышается давление на стенки и слизистый слой. Усиливается перистальтика, запускается процесс естественного очищения.
Одновременно лактулоза стимулирует приток жидкости в кишечник, задерживает воду (осмотический эффект). Это делает каловые массы более податливыми и мягкими. При регулярном применении восстанавливается нормальный процесс опорожнения, исчезают проблемы со стулом. Лактулоза легко выводится естественным путем. Она поглощает токсины, которые возникают при сильном брожении, ускоряет очищение поверхности слизистых оболочек прямой кишки. Это создает благоприятные условия для развития микрофлоры, размножения полезных бифидобактерий.
Основные фармакологические свойства препарата Дюфалак:
Лекарственный сироп Дюфалак является практически единственным слабительным средством, которое разрешено для применения в разных возрастных группах. Его активно назначают при запорах у грудных детей, пожилых людей. Главное полезное свойство – содержание пребиотиков. Это не перевариваемые компоненты, которые необходимы для здорового метаболизма всей пищеварительной системы. Они регулируют рост полезного микробиоциноза, ускоряют расщепление белков, жиров и углеводов, снижают риск развития онкологических заболеваний органов пищеварения.
Применение препарата Дюфалак при запоре не только стимулирует очищение пищеварительного тракта. При регулярном приеме проходит ощущение тяжести, дискомфорт, улучшается состав микрофлоры. Это важно для полноценной работы иммунной системы: именно в тонкой кишке производится большое количество антител, которые необходимы для защиты от вирусов и бактерий. Это помогают организму противостоять опасным инфекциям.
Формы выпуска
Слабительное средство производится в виде жидкого сиропа светло-желтого оттенка. Основу составляет очищенная вода. В препарате не содержится спирт, искусственные красители или ароматизаторы. Крышечка бутылки одновременно выполняет роль дозатора: на нее нанесены отметки, которые позволяют легко отмерить необходимое количество лекарства.
Эффективный препарат врачи рекомендуют брать в поездку и командировку. Для такого случая производитель предлагает удобные одноразовые пакетики, которые содержат 15 мл сиропа. Это средняя доза для взрослого пациента.
К вопросу о дисбиозе кишечника и его коррекции у детей
Важнейшую роль в жизнедеятельности организма человека играет микробиоценоз кишечника. Всю микрофлору кишечника можно разделить на три группы: основная — бифидобактерии ( Bifidobacterium (В.) bifidum, B. brevis, B. longum, B. adolescentis и др.) и лактоба
Нормальная микрофлора выполняет важные функции — защитную, обменную и иммуноиндуцирующую, участвуя в поддержании гомеостаза. Нарушение любой из них сопровождается изменением метаболизма, возникновением дефицита микронутриентов, снижением иммунного статуса.
Нарушения микробиоценоза кишечника связаны с характером питания, возрастом, проведением антибактериальной, гормональной, лучевой терапии, хроническими заболеваниями желудочно-кишечного тракта, изменением иммунного статуса, состоянием окружающей среды; они наступают задолго до клинических проявлений. Изменения нормальной микрофлоры получили название дисбактериоза, или дисбиоза. Дисбактериоз является микробиологическим понятием и ни в коем случае не может быть самостоятельным диагнозом.
Микроэкологическая классификация степеней тяжести дисбиоза кишечника была предложена в 1998 г. С. Д. Митрохиным.
I степень тяжести — увеличено или уменьшено общее количество кишечных палочек. Кишечные палочки с атипичными биологическими свойствами отсутствуют. Количество бифидобактерий и лактобацилл не изменено. Изменения в общих показателях микробного метаболитного паспорта фекалий характерны лишь в отношении пула летучих жирных кислот (ЛЖК), содержания фенилпропионовой кислоты, скатола и метиламина. Общее содержание ЛЖК у больных с I степенью тяжести дисбактериоза может быть несколько меньшим или большим, чем у здоровых лиц. Содержание скатола снижено. Содержание фенилуксусной кислоты и метиламина повышено. Отмечаются изменения удельного веса щавелевоуксусной кислоты в профиле дикарбоновых кислот (ДКК). Дисбактериоз — латентный, компенсированный, кишечные дисфункции не регистрируются.
II степень тяжести — незначительно снижено количество бифидобактерий и лактобацилл. Наблюдаются количественные и качественные (появление форм с атипичными биологическими свойствами) изменения кишечных палочек. Высеваются в умеренном количестве условно-патогенные кишечные микроорганизмы. Отмечаются изменения как в общих, так и в специфических показателях микробного метаболитного паспорта фекалий (снижение экскреции с фекалиями фенольных соединений: п-крезола, индола, а также скатола). Количество фенилпропионовой кислоты на порядок превышает таковое у здоровых лиц. Профиль фенольных соединений (ФС) также меняется: удельный вес индола возрастает более чем в 2 раза, несколько снижается удельный вес п-крезола и более чем в 10 раз снижен удельный вес скатола. В целом экскреция с фекалиями карбоновых и ароматических аминокислот, фенольных и индольных соединений (за исключением фенилаланина), а также гистамина и серотонина при II степени тяжести дисбиоза снижена. Изменен профиль сложных и простых аминов (АмП): удельный вес гистамина и серотонина ниже, а представителя простых аминов — метиламина — выше. Дисбактериоз — локальный (местный), субкомпенсированный; кишечные дисфункции, как правило, не наблюдаются.
III степень тяжести — существенное снижение количества бифидобактерий (105–106) в сочетании со снижением количества лактобацилл и резким изменением типичных свойств кишечных палочек (значительное преобладание гемолитических, лактозонегативных форм). Значительное увеличение количества условно-патогенных бактерий с патогенными свойствами (гемолитических форм) и патогенных дрожжеподобных грибов (родов Candida albicans, Geotrichum и др.). Характерны еще более выраженные изменения как в общих, так и в специфических показателях микробного метаболитного паспорта фекалий. Снижена величина экскреции с фекалиями ФС: п-крезола и индола. В фекалиях практически отсутствует скатол. Напротив, содержание фенилпропионовой кислоты в каловых массах резко увеличивается. Профиль ФС меняется таким образом, что существенно увеличивается удельный вес индола и значительно снижается удельный вес п-крезола. Cодержание в фекалиях гистамина и серотонина может быть выше или ниже по сравнению с нормой (зависит от нозологической формы основного заболевания). Содержание карбоновых кислот меняется следующим образом: резко уменьшается пул ЛЖК, практически не обнаруживается щавелевоуксусная кислота и значительно возрастает экскреция с каловыми массами альфа-кетоглутаровой кислоты. Изменен профиль ЛЖК. При нарушениях стула по типу диареи удельный вес уксусной кислоты ниже, а пропионовой и масляной кислот, наоборот, повышен, при констипации наблюдается противоположная картина. Отмечаются снижение или увеличение удельного веса молочной кислоты и аналогичные изменения удельного веса альфа-кетоглутаровой кислоты в профиле ДКК.
IV степень тяжести — резкое снижение или отсутствие бифидобактерий, значительное уменьшение количества лактобацилл, резкое уменьшение количества или отсутствие кишечных палочек с типичными свойствами, значительное возрастание количества как облигатных, так и факультативных видов (в норме не встречающихся) кишечных бактерий и дрожжеподобных грибов с патогенными свойствами. Выявляются патогенные кишечные бактериии (сальмонеллы, шигеллы, ерсинии). Качественные изменения в микробном метаболитном паспорте остаются такими же, как и при III степени, но их количественные характеристики еще более изменены; характерна глубокая разбалансировка биохимических регуляторных механизмов микробной экосистемы, сочетающаяся с аналогичной разбалансировкой микробной инфраструктуры кишечника. Дисбактериоз — распространенный (с бактериемией), декомпенсированный (с угрозой генерализации инфекции, сепсиса или септикопиемии); наблюдаются выраженные кишечные дисфункции.
В клинической практике условно выделяются три основные группы кишечной микрофлоры: облигатная — постоянно встречающаяся (резидентная, аутохтонная, индигенная); добавочная (сопутствующая) и транзиторная (случайная, аллохтонная) (табл.).
В зависимости от клинических проявлений выделяют различные степени проявления дисбактериоза. В частности, одна из таких классификаций принадлежит В. А. Таболину (1998).
I степень — латентная фаза дисбиоза, проявляется только в снижении на один-два порядка количества защитной микрофлоры — бифидобактерий, лактобацилл, а также полноценных кишечных палочек (до 80% от общего количества). Остальные показатели соответствуют физиологической норме (эубиозу). Как правило, начальная фаза не вызывает дисфункций кишечника и возникает при воздействии неблагоприятных факторов (нарушение режима питания и др.). В этой фазе возможно вегетирование в кишечнике незначительного количества отдельных представителей условно-патогенной флоры. Клинических проявлений дисбактериоза в этой фазе нет.
II степень — пусковая фаза более серьезных нарушений, характеризуется выраженным дефицитом бифидобактерий на фоне нормального или сниженного количества лактобацилл или снижения их кислотообразующей активности, дисбалансом в количестве и качестве кишечных палочек, среди которых нарастает доля лактозонегативных или цитратассимилирующих вариантов. При этом на фоне дефицита защитных компонентов кишечного микробиоценоза происходит размножение либо плазмокоагулирующих стафилококков, либо протеев, либо грибов рода Candida albicans. Вегетирование в кишечнике протеев или плазмокоагулирующих стафилококков в этой фазе развития дисбактериоза чаще транзиторное, чем постоянное. Функциональные расстройства пищеварения выражены неотчетливо — спорадически жидкий стул зеленоватого цвета с неприятным запахом, со сдвигом рН в щелочную сторону, иногда — задержка стула; может отмечаться тошнота.
III степень — фаза агрессии аэробной флоры, характеризующаяся отчетливым нарастанием содержания агрессивных микроорганизмов; при этом размножаются до десятков миллионов в ассоциации золотистые стафилококки и протеи, гемолитические энтерококки; наблюдается замещение полноценных эшерихий бактериями родов Klebsiella, Enterobacter, Citrobacter и др. Эта фаза дисбактериоза проявляется дисфункциями кишечника с расстройствами моторики, секреции ферментов и всасывания. У больных отмечается учащенный разжиженный стул, часто зеленого цвета, ухудшение самочувствия, дети становятся вялыми, капризными.
IV степень — фаза ассоциативного дисбиоза, характеризующаяся глубоким разбалансированием кишечного микробиоценоза с изменением количественных соотношений основных групп микроорганизмов, изменением их биологических свойств, накоплением токсических метаболитов. Характерно вегетирование энтеропатогенных серотипов E. coli, сальмонелл, шигелл и других возбудителей острых кишечных инфекций. Возможно размножение клостридий. Эта фаза дисбиоза характеризуется функциональными расстройствами пищеварительной системы и нарушениями общего нутритивного статуса, дефицитом массы тела, бледностью кожных покровов, частым стулом с примесью слизи, зелени, иногда крови, с резким гнилостным или кислым запахом.
Для подтверждения диагноза необходимо провести следующее исследование:
Определение состава фекальной микрофлоры — наиболее доступный метод, однако он недостаточно информативен, поскольку отражает микробный состав лишь дистальных отделов кишечника. Важным диагностическим тестом синдрома избыточного бактериального роста является экскреторный дыхательный тест с идентификацией различных метаболитов, которые продуцируются с участием интракишечных бактерий (лактулозный тест с определением в выдыхаемом воздухе Н2). Последний для повседневной педиатрической практики представляется наиболее приемлемым. Газожидкостная хроматография позволяет оценить химические соединения, связанные с жизнедеятельностью нормальной микрофлоры. В ряде случаев целесообразно исследование липополисахаридов (ЛПС)-О-антигена и уровня энтеротоксинов. Для определения степени дисбактериоза можно пользоваться стандартным методом Р. Б. Эпштейн–Литвак и Ф. Л. Вильшанской (1969).
Коррекция нормального состава кишечной флоры должна быть комплексной и направленной в первую очередь на лечение основного заболевания, вызвавшего дисбаланс микрофлоры; необходим комплекс лечебно-охранительных мероприятий по общему оздоровлению организма ребенка в целом и на коррекцию его микрофлоры в частности.
Организация охранительного режима включает благоприятную психологическую атмосферу, длительное пребывание на свежем воздухе, более продолжительный сон, соответствующий режим питания.
Адекватное, сбалансированное питание в соответствии с возрастом ребенка при нормальном функционировании органов и систем предотвращает развитие дисбиозов. Наиболее важным мероприятием является естественное вскармливание детей грудного возраста. Идеальной пищей для новорожденного ребенка и детей первых месяцев жизни является молоко матери, которое больше всего подходит ее ребенку, так как имеет родственную связь с его тканями. Углеводы грудного молока (90% из них составляет β-лактоза) ферментируются посредством бифидобактерий в молочную кислоту, которая обеспечивает низкий уровень рН стула у детей. В литературе неоднократно отмечалось влияние естественного вскармливания на состояние микробиоценоза кишечника у детей раннего возраста. Так, состав микрофлоры мекония новорожденных, получавших грудное молоко, отличался низким содержанием аэробной микрофлоры, превалированием бифидофлоры над аэробной флорой и низким содержанием гнилостных бактерий (клостридии, бактероиды, род Proteus). При искусственном вскармливании рост бифидобактерий либо отсутствовал полностью, либо их содержание было резко снижено.
В настоящее время широкое распространение получает так называемое функциональное питание. Употребляются готовые пищевые продукты, в которые добавлены биопрепараты, антиоксиданты, каротиноиды, ферменты и другие субстраты. Для детей раннего возраста, находящихся на искусственном вскармливании, рекомендуются адаптированные смеси, обогащенные представителями микрофлоры: «Малютка», «Биолакт адаптированный», «Бифидок», «Бифилин», «Бифидолакт», «Бифилайф», «Виталакт» и др. Во многих случаях оправдывает себя применение сухой смеси «Лактофидус», содержащей бифидобактерии и стрептококки, и смеси «НАН» с бифидобактериями. Для выхаживания детей неонатального периода разработано функциональное питание в виде лиофилизированного грудного молока, обогащенного B. bifidum. Принимая во внимание, что одним из важнейших этапов выхаживания новорожденных в отделениях реанимации и интенсивной терапии является организация рационального вскармливания, недавно на кафедре неонатологии РГМУ был разработан новый вид функционального питания специально для вышеназванного контингента детей. Данный тип функционального питания представляет собой лиофилизированное грудное молоко, содержащее B. bifidum 791 в концентрации 10 8 КОЕ/мл (Ю. Г. Мухина, 2000). Функциональное питание не относится к категории лекарственных препаратов, используется для улучшения здоровья человека в целом.
Диета у детей с проявлениями дисбактериоза должна быть полноценной по калорийности и содержанию основных физиологических ингредиентов. Прием пищи необходимо осуществлять в одни и те же часы, желательно восстановить эндогенный биоритм пищеварения. Питание должно быть как можно более разнообразным. При этом желательно исключить или ограничить употребление продуктов, агрессивных в отношении аутофлоры, таких как макароны и вермишель из муки высшего сорта, консервы и полуфабрикаты из мяса, рыбы, бобовых, все виды свинины, баранины, печень, почки, мозги, тугоплавкие животные жиры, цельное и сгущенное молоко, сладкие йогурты, консервированные овощи и фрукты, сладости, лимонад, мороженое, шоколад. К группе рекомендуемых продуктов, стимулирующих рост индигенной микрофлоры кишечника, относятся чечевица, изделия из пшеницы, ржи, кукурузы, гречихи, проса, некоторые овощи — капуста, морковь, кабачки, тыква, артишок, топинамбур, свежие фрукты, неконсервированные фруктовые и овощные соки, орехи, мясо и рыба нежирных сортов, кисломолочные продукты, растительные жиры.
В комплексной диетотерапии больных дисбактериозами можно использовать и кобылий кумыс. Под его влиянием у больных уменьшаются гнилостные процессы в кишечнике, снижается количество гнилостных бактерий и улучшаются биологические свойства E. coli и других представителей индигенной микрофлоры. Е. А. Толмачевой разработана технология изготовления кумыса из коровьего молока, изучено его действие на кишечную микрофлору. Применение коровьего кумыса приводило к резкому уменьшению роста в кишечнике спороносных анаэробных бактерий, главным образом B. putrificus, B. perfringens и B. sporogenes.
Важное значение имеет также наличие в питании овощей, фруктов и растений, обладающих антимикробной активностью. Многие антибактериальные вещества, выделенные из растений, стимулируют иммунобиологические реакции организма, инактивируют бактериальные экзотоксины и гиалуронидазу.
Представляется уместным подчеркнуть, что только комплексная коррекция дисбиоза дает более выраженный стойкий клинический и микробиологический эффект. Одной из главных составляющих этого комплексного подхода является заместительная терапия.
Важнейшим методом терапии дисбиоценоза (дисбактериоза) кишечника является применение лекарственных средств биологического происхождения, способных регулировать равновесие микрофлоры кишечника. С целью ликвидации дефицита индигенной флоры используют пробиотики — препараты живых микроорганизмов (представителей индигенной микрофлоры кишечника), которые обладают способностью целенаправленно регулировать кишечную микроэкологию и восстанавливать эубиоз. Это кисломолочные бактерии, бифидобактерии, кисломолочные стрептококки.
Препараты-пробиотики на основе этих микроорганизмов широко используются в западноевропейских странах, Канаде и США в качестве пищевых добавок, а также в йогуртах и других молочных продуктах. Микроорганизмы, входящие в состав пробиотиков, непатогенны, нетоксигенны, сохраняют жизнеспособность при хранении. Пробиотики не считаются лекарственными препаратами, а рассматриваются как средства, благоприятно влияющие на состояние здоровья людей. В педиатрической практике получили широкое распространение такие пробиотики, как Бифидумбактерин, Лактобактерин, Колибактерин, Бификол, Бифидумбактерин-форте, Ацилакт, Примадофилюс, Линекс, Бифиформ и др.
Линекс — комплексный препарат, состоящий из живых лиофилизированных бактерий B. infantis v. liberorum, L. acidophilus и Enterococcus faecium, устойчивых к антибиотикам и химиотерапевтическим средствам. Входящие в состав Линекса живые бифидобактерии, лактобациллы и нетоксигенный кисломолочный стрептококк группы D (выделенные из кишечника здорового человека) поддерживают и регулируют физиологическое равновесие кишечной микрофлоры во всех отделах кишечника. Выпускается в капсулах. В 1 капсуле содержится 1,2 x 107 живых кисломолочных бактерий (бифидо- и лактофлора). При его приеме создаются неблагоприятные условия для развития патогенной и условно-патогенной кишечной микрофлоры за счет продукции кисломолочной флорой уксусной, молочной и пропионовой кислот, что снижает рН кишечного содержимого. Прием препарата: взрослым по 2 капсулы 3 раза в день, детям — по 1 капсуле 3 раза в день. Хотя бактерии Линекса обладают кислотоустойчивостью, следует помнить, что при рН менее 3,5 они могут потерять свою жизнеспособность — соответственно препарат потеряет свои свойства. Поэтому принимать его рекомендуется после еды. Курс лечения зависит от степени выраженности дисбактериоза; в любом случае заместительная терапия должна быть продолжительной. Штаммы микроорганизмов, входящих в состав Линекса, являются специально выведенными, антибиотикоустойчивыми. Именно поэтому препарат можно назначать даже на фоне антибиотикотерапии. Как правило, микроорганизмы, входящие в состав пробиотиков, выполняют функцию временного заполнения экониши микрофлоры, которую со временем занимают колонии штаммов, изначально населяющих слизистую оболочку кишечника. В зависимости от степени дисбактериоза это замещение происходит в различные временные промежутки. Именно поэтому заместительная терапия пробиотиками должна носить достаточно длительный интермиттирующий характер.
Для усиления действия пробиотиков рекомендуется дополнительно назначать средства, обладающие противовоспалительными и иммуномодулирующими свойствами: Ф (Иммунал, Echinacea with Golden Seal), комплексные иммуномодулирующие препараты и витаминно-минеральные комплексы.
Оптимизация диагностики, индивидуализация лечения и проведение профилактики дисбактериоза кишечника позволят повысить эффективность терапии и обеспечат устойчивый бактериологический фон кишечника человека, что будет способствовать поддержанию хорошего качества жизни.
П. Л. Щербаков, доктор медицинских наук, профессор
НЦЗД РАМН, Москва
Нарушения микробиоценоза кишечника у детей и его коррекция
Рассмотрена проблема дисбиоза кишечника и подходы к восстановлению микроэкологической структуры кишечника после агрессивных воздействий, используя пробиотики и средства, способствующие адаптации колоний симбионтных бактерий на слизистой оболочке кишечника
The article represents the issue of intestinal dysbiosis and approaches to restoration of intestinal microbiological structure after aggressive exposures using probiotics and preparations which contribute to adaptation of symbiont bacteria colonies at the intestinal mucous membrane — the products of natural metabolism of microorganisms.
Важнейшую роль в жизнедеятельности организма человека играет микробиоценоз кишечника — микроэкологическая система организма, которая сложилась в процессе филогенетического развития в пищеварительном канале человека. На значение микробной флоры для здорового человека впервые обратил внимание в 1907 году И. И. Мечников. Процесс взаимодействия микроорганизмов, обитающих в кишечнике, и собственно слизистой оболочки достаточно сложен и его изучению посвящено немало монографий и научных работ.
Всю микрофлору кишечника можно разделить на три группы: основная флора, среди которой наибольший интерес представляют бифидобактерии (Bifidobacterium bifidum, Bifidobacterium brevis, Bifidobacterium longum, Bifidobacterium adolescentis и др.) и лактобациллы (Lactobacillus acidophilus, Lactobacillus fermentum, Lactobacillus brevis, Lactobacillus lactis и др.), сопутствующая флора, представленная в основном кишечными палочками с типичными биологическими свойствами и энтерококками (Enterococcus fecalis, Enterococcus faecium), и остаточная флора, которая представлена условно-патогенными бактериями семейства энтеробактерий: клебсиеллами, цитробактерами, протеями и др., стафилококками (Staphylococcus epidermidis, Staphylococcus saprophyticus) и дрожжеподобными грибами.
Одна из основных функций нормальной микрофлоры — защитная, так как бактерии-симбионты человека обладают выраженной антагонистической активностью по отношению к патогенным и условно-патогенным микроорганизмам. Так, например, бифидобактерии образуют в процессе своей жизнедеятельности молочную, уксусную, муравьиную и янтарную кислоты, что снижает рН среды кишечника и препятствует колонизации его посторонними микроорганизмами, попавшими сюда извне. Лактобациллы в процессе брожения молочной кислоты образуют антибиотические вещества — лактолин, лактоцидин, ацидофилин. Полноценная кишечная палочка способна к синтезу колицинов и микроцинов — специфических белков, обладающих антибактериальной активностью. Таким образом, представители основной и сопутствующей микрофлоры кишечника тормозят рост и размножение гнилостных и патогенных микроорганизмов — кишечных палочек с атипичными биологическими свойствами, клебсиелл, протеев, некоторых видов сальмонелл и шигелл, золотистого стафилококка.
Присутствие микробных ассоциаций в кишечнике определяет состояние синтетической функции печеночных клеток путем участия в печеночно-кишечной циркуляции важнейших компонентов желчи — солей желчных кислот, холестерина и желчных пигментов.
Еще одной из важнейших функций микрофлоры организма человека является участие в формировании иммунобиологической реактивности макроорганизма. Показано, что в результате антигенной стимуляции аутофлорой иммунной системы в организме человека создается и поддерживается общий пул иммуноглобулинов.
Известно, что энтероциты кишечника, основная функция которых всасывать питательные вещества из просвета кишки, не всегда получают полноценное питание от самого организма, через базальную мембрану, к которой они фиксированы. Это объясняется тем, что процессы инфузии в клетках эпителия кишечника протекают как бы только в одну сторону — от верхушки энтероцитов к базальной мембране, а не наоборот. Вот и приходится энтероцитам «добывать пропитание» для себя также из просвета кишки. Эта питательная субстанция для клеток эпителия, называемая бутиратом, состоит из различных продуктов жизнедеятельности симбионтной флоры, обитающей в просвете кишки, которая представляет собой смесь короткоцепочечных жирных и летучих кислот, моносахаров и липидов.
При подавлении симбионтной флоры условно-патогенными и патогенными бактериями, выработка бутирата снижается или прекращается вовсе, энтероциты в состоянии дефицита питания атрофируются и процессы пищеварения нарушаются. Известны работы, описывающие механическое повреждение условно-патогенной кишечной палочкой в таких условиях кишечных ворсинок. Эшерихии буквально «обгрызают» энтероциты, ослабленные из-за дефицита питания.
Таким образом, нормальная микрофлора с ее специфическими функциями — защитной, обменной и иммуноиндуцирующей, питательной — определяет микробную экологию пищеварительного тракта и участвует в поддержании гомеостаза макроорганизма. Нарушение любой из функций приводит к нарушению различных видов метаболизма, возникновению дефицита микронутриентов: витаминов, микроэлементов, минеральных веществ в организме человека, снижению его иммунного статуса.
Нарушения состава и количественного соотношения в микробиоценозе кишечника возникают от разнообразных причин: характера питания, возраста, проведения антибактериальной, гормональной или лучевой терапии, наличия хронических заболеваний желудочно-кишечного тракта, измененной иммунобиологической реактивности организма и состояния окружающей среды и наступают задолго до клинических проявлений — они служат предвестником отклонений в клинико-физиологическом статусе организма. Эти изменения нормальной микрофлоры получили название дисбактериоза или дисбиоза, который со временем проявляет себя клиническими местными симптомами, а затем и общими нарушениями, которые отягощают течение различных заболеваний человека и затрудняют его лечение. Преобладание роста каких-либо представителей микробной флоры кишечника, происходящее в силу перечисленных выше обстоятельств, получило название синдрома избыточного бактериального роста (СИБР) и является одним из вариантов проявления дисбактериоза. Следовательно, вместе с лечением человека от той или иной болезни надо оздоровить и его кишечник.
Для характеристики дисбактериоза кишечника в разные годы были предложены различные классификации, учитывающие вид микробной флоры, тип нарушений, тяжесть течения и клинические формы и т. д., но ни одна из известных на сегодня классификаций не может полностью удовлетворить врача при решении практических задач нормализации и коррекции микробиоценоза кишечника и рационально построить лечение и профилактику дисбактериоза у пациентов. Мы использовали классификацию, С. Д. Митрохина (1998), которая позволяет охарактеризовать степени тяжести дисбактериоза толстой кишки с позиций оптимизации современных подходов к лечению и профилактике дисбактериозов.
Микроэкологическая классификация степеней тяжести дисбиоза кишечника (С. Д. Митрохин, 1998)
I степень тяжести — увеличено или уменьшено общее количество кишечных палочек. Кишечные палочки с атипичными биологическими свойствами отсутствуют. Количество бифидобактерий и лактобацилл не изменено. Изменения в общих показателях микробного метаболитного паспорта фекалий характерны лишь в отношении пула летучих жирных кислот, содержания фенилпропионовой кислоты, скатола и метиламина. Общее содержание летучих жирных кислот у больных с I степенью тяжести дисбактериоза может быть меньшим или большим аналогичного у здоровых лиц. Будет снижено содержание скатола. Напротив, содержание фенилуксусной кислоты и метиламина будет повышено. Будут отмечатся изменения удельного веса щавелевоуксусной кислоты в профиле других карбоновых кислот (ДКК). Дисбактериоз латентный, компенсированный, кишечные дисфункции не регистрируются.
II степень тяжести — незначительно снижено количество бифидобактерий и лактобацилл. Наблюдаются количественные и качественные (появление форм с атипичными биологическими свойствами) изменения кишечных палочек. Высеваются в умеренном количестве условно-патогеннные кишечные микроорганизмы. Отмечаются изменения как в общих, так и в специфических показателях микробного метаболитного паспорта фекалий. Что выражается в снижении величины экскреции с фекалиями фенольных соединений: п-крезола и индола. В десятки раз уменьшается количество скатола в испражнениях. Обратная картина наблюдается в отношении фенилпропионовой кислоты, количество которой на порядок превышает таковое у здоровых лиц. Профиль фенольных соединений (ФС) также меняется: удельный вес индола возрастает более чем в 2 раза, несколько снижался удельный вес п-крезола и более чем в десять раз снижен удельный вес скатола. В целом экскреция с фекалиями карбоновых и ароматических аминокислот, фенольных и индольных соединений (за исключением фенилаланина) при II степени тяжести дисбиоза снижена. Снижается экскреция с фекалиями гистамина и серотонина. Изменен аминный профиль: удельный вес гистамина и серотонина ниже, удельный вес представителя простых аминов — метиламина выше. Дисбактериоз локальный (местный), субкомпенсированный, кишечные дисфункции, как правило, не наблюдаются.
III степень тяжести — существенное снижение количества бифидобактерий (10 5 –10 6 ) в сочетании со снижением количества лактобацилл и резким изменением типичных свойств кишечных палочек (значительное преобладание гемолитических, лактозонегативных форм). Значительное увеличение количества условно-патогенных бактерий с патогенными свойствами (гемолитических форм) и патогенных дрожжеподобных грибов (родов Candida, Geotrichum и др.). Характерны еще более выраженные изменения как в общих, так и в специфических показателях микробного метаболитного паспорта фекалий. Снижена величина экскреции с фекалиями фенольных соединений: п-крезола и индола. В фекалиях практически отсутствует скатол. Напротив, содержание фенилпропионовой кислоты в каловых массах резко увеличивается. Профиль ФС меняется таким образом, что существенно увеличивается удельный вес индола и значительно снижается удельный вес п-крезола. Существенно изменяется величина экскреции аминов: содержание в фекалиях гистамина и серотонина может быть выше или ниже по сравнению с нормой (зависит от нозологической формы основного заболевания). Содержание карбоновых кислот в фекалиях больных с III степенью дисбиоза меняется следующим образом: резко уменьшается пул летучих жирных кислот, практически не обнаруживается щавелевоуксусная кислота и значительно возрастает экскреция с каловыми массами альфа-кетоглутаровой кислоты. Изменен профиль летучих жирных кислот. При нарушениях стула по типу диареи удельный вес уксусной кислоты ниже, удельный вес пропионовой и масляной кислот, наоборот, повышен, при констипации наблюдается противоположная картина. Отмечается снижение или увеличение удельного веса молочной и аналогичные изменения удельного веса альфа-кетоглутаровой кислот в профиле ДКК. Дисбактериоз локальный (местный), декомпенсированный, кишечные дисфункции, как правило, наблюдаются.
IV степень тяжести — резкое снижение или отсутствие бифидобактерий, значительное уменьшение количества лактобацилл, резкое уменьшение количества или отсутствие кишечных палочек с типичными свойствами, значительное возрастание количества как облигатных, так и факультативных видов (в норме не встречающихся) кишечных бактерий и дрожжеподобных грибов с патогенными свойствами. Выявляются патогенные кишечные бактерии (сальмонеллы, шигеллы, йерсинии). Качественные изменения в микробном метаболитном паспорте остаются такими же, как и при третьей степени, но их количественные характеристики еще более изменены, характерна глубокая разбалансировка биохимических регуляторных механизмов микробной экосистемы, сочетающаяся с аналогичной разбалансировкой микробной инфраструктуры кишечника. Дисбактериоз распространенный (с бактериемией), декомпенсированный (с угрозой генерализации инфекции, сепсиса или септикопиемии), наблюдаются выраженные кишечные дисфункции.
Лечением дисбиоза врачи всех уголков мира занимаются давно. В результате многолетнего кропотливого поиска наиболее действенных мер и способов к настоящему времени образовалось большое количество лекарственных препаратов и биологических активных добавок, которые в той или иной степени влияют на состояние микрофлоры и используются для восстановления нарушенного равновесия кишечной экоструктуры.
Большое разнообразие на российском рынке лекарственных средств, необходимость рационального выбора лечебных воздействий и их сочетаний убедительно свидетельствуют о необходимости некоторой систематизации и схематизации лечения дисбактериоза кишечника, не исключая при этом опыта и творческого характера в работе лечащего врача и индивидуального подхода к коррекции и профилактике дисбактериоза кишечника.
В настоящее время разработаны следующие основные принципы комбинированной коррекции микроэкологического дисбаланса кишечника:
Чрезвычайно важными элементами лечения и профилактики дисбактериоза кишечника также являются следующие моменты:
При построении тактики рационального, индивидуального лечения и профилактики дисбактериоза кишечника, особенно у детей различного возраста, у которых процессы формирования собственной экосистемы продолжаются до 10–12 летнего возраста, врачу необходимо решить следующие задачи:
Для нормализации работы кишечника используются и индивидуально подбираются средства с учетом нарушений функций толстой кишки и особенностей действия препаратов с наиболее вероятным воздействием на причину имеющегося нарушения работы кишечника (констипация, диарея) и адсорбирующих свойств, а также ферментативной недостаточности. В последнее время уделяется много внимания проблемам дисбиоза, избыточному бактериальному росту, обусловленному самыми разными факторами, — нарушение макро- и микроэкологии кишечника на фоне антибиотикотерапии, химиотерапии, пищевых отравлений и пр. В этих работах довольно подробно останавливаются и на этиопатогенетических механизмах развития дисбиоза и его последствий и на методах лечения с использованием кишечных антисептиков, антибиотиков и различных моно- или мультиштаммовых пробиотиков. К пробиотикам относятся биологические активные средства, содержащие колонии живых или лиофилизированных микроорганизмов, основная функция которых заместительная, то есть при их приеме необходимо заместить патогенную и условно-патогенную флору штаммами специально выведенных культур бифидо-, лакто- и других бактерий, сходных по своим свойствам со штаммами, обитающими в кишечнике человека. Особенно актуально звучит тема заместительной терапии именно для детей различного возраста. Как уже было сказано, кишечная микрофлора начинает формироваться с первого дня жизни ребенка и заканчивается, по данным разных авторов, к 10–12 годам. Сформированные к этому возрасту соотношения различных групп бактерий индивидуальны для каждого человека и сохраняются в его кишечнике на протяжении практически всей жизни с небольшими колебаниями, зависящими от внешних и внутренних (возрастных) факторов. И если у взрослого человека происходит, по каким-либо причинам, нарушение экосистемы, то в этом случае можно с меньшей оглядкой назначать больным людям антибиотики широкого спектра действия, с последующим курсом пробиотиков. Смысл такого лечения заключается в уничтожении с поверхности кишечника болезнетворных микроорганизмов. Конечно же, в этот период значительно страдает и симбионтная микрофлора. Однако под прикрытием пробиотиков, которые, как правило, назначаются после окончания антибиотикотерапии (а современные виды пробиотиков, имеющих устойчивые к некоторым антибиотикам штаммы, — и во время проведения антибиотикотерапии) в кишке раньше или позже, в зависимости от индивидуальных особенностей организма, поверхность слизистой оболочки кишки вновь заселят те первые «родные» штаммы симбионтов, которые заселились в организме человека при формировании биоценоза в первое десятилетие жизни макроорганизма. Отдельные их представители в любом случае выживут, даже под воздействием антибиотикотерапии, и дадут впоследствии рост новым колониям, которые под «прикрытием» пробиотических штаммов разовьются, и колонизируют всю поверхность слизистой оболочки. А штаммы пробиотиков, являющиеся проходной флорой, покинут организм. Транзиторность нахождения пробиотических микроорганизмов в кишечнике подтверждена исследованиями, которые оценивали длительность их выявления в стуле. По результатам этих работ, уже через 1–4 недели после окончания приема пробиотического средства данные штаммы не определялись в стуле (Ciorba, 2010). Другое дело обстоит с детьми, у которых собственная экосистема кишечника еще не сформировалась окончательно, хотя, конечно, основное соотношение микрофлоры уже определяется к концу первого года жизни. Назначение детям антибиотиков для санации кишечника может пагубно сказаться на дальнейшем формировании нормальной микрофлоры, и в этом случае пробиотики, пусть даже и содержащие нормальные бифидо- и лактобактерии и симбионтные энтерококки, могут создать конкуренцию «родным» штаммам кишечника. Назначение антибактериальной терапии чревато, особенно у детей, возможным быстрым развитием псевдомембранозного колита с преобладанием развития Clostridium difficile. В таком случае, по возможности, детям лучше назначать не антибиотики, а кишечные антисептики, например, нитрофуранового ряда, которые «мягче» действуют на микрофлору, подавляя рост преимущественно аэробных условно-патогенных и патогенных штаммов микроорганизмов. Но для скорейшего восстановления микроэкосферы не всегда бывает достаточно этих антисептиков, пусть даже и неагрессивных и мягко действующих. В настоящее время для детского возраста разработаны специальные наборы штаммов, вошедшие в прописи различных препаратов, которые направлены на скорейшее восстановление естественной микрофлоры ребенка. Однако и они не являются идеальным средством для стимуляции роста собственных, еще не окрепших колоний симбионтных микроорганизмов. В этом случае как раз для стимуляции роста симбионтной флоры бифидо- и лактобактерий и энтерококков и в первую очередь для стимуляции роста первичных, «естественно» заселенных штаммов рекомендуется использовать средства, являющиеся экстрактом жизнедеятельности симбионтной флоры. Т. е. по сути дела прообразом того бутирата, который является питательной средой для энтероцитов. К таким препаратам относится Хилак форте, являющийся метаболическим пробиотиком. Препарат представляет собой прозрачную светло-желтую или желто-коричневую жидкость с характерным кисловатым запахом. В состав препарата входят беззародышевые водные субстраты биосинтетических продуктов бактериального метаболизма четырех видов микроорганизмов, присутствующих в нормальной микрофлоре кишечника: Escherichia coli, Enterococcus faecalis, Lactobacillus acidophilus и Lactobacillus helveticus. Благодаря наличию в препарате естественных продуктов жизнедеятельности бактерий, аналогичных тем, которые имеются в просвете кишки при нормальной микрофлоре, он способствует поддержанию физиологических функций слизистой оболочки кишечника и его микробной экологии. Создает благоприятные условия, обеспечивающие питание ослабленных или поврежденных энтероцитов, восстанавливая тем самым цитомукопротективную способность слизистой оболочки. Ускоряет развитие нормальной кишечной микрофлоры, создавая оптимальную экологическую среду с определенным соотношением кислот. Препарат назначается детям в виде приема 20–40 капель 3 раза в день до или во время еды. Для младенцев дозировка составляет 15–30 капель 3 раза в день. Рекомендуется интермиттирующий ритм по 10–15 дней с перерывами 1–2 месяца.
Возможно, что при приеме препарата не только и не столько восстанавливается кислотность среды в тонкой кишке (так как доза приема препарата очень небольшая), но запускаются некоторые триггерные механизмы, регулирующие процесс цитомукопротекции и влияющие на микроэкологическую систему в кишечнике. Это одно из предположений, научные исследования над которым продолжаются до последнего времени. Однако налицо клиническая эффективность при приеме Хилака форте в случае развития дисбиоза у взрослых и детей различного возраста. На фоне приема этого препарата происходит скорейшее восстановление микроэкологического баланса в кишечнике и исчезают клинические проявления, сопровождающие дисбактериоз, — боли в животе, метеоризм и констипация, о чем свидетельствуют проведенные клинические исследования в разных странах.
Известно, что важную роль в положительном действии пробиотических микроорганизмов выполняют не сами бактериальные клетки, а их метаболиты (Н. И. Урсова, 2013). В этом отношении Хилак форте может быть более предпочтителен, чем лиофилизированные формы различных пробиотических препаратов, которым требуется 8–10 часов для активации и начала выработки продуктов метаболизма (С. К. Аджигайтканова, 2007). Этот вопрос приобретает особенную важность в случае диареи, которая часто сопровождает нарушения микрофлоры. Дело в том, что время нормального транзита содержимого по кишечнику как у взрослых, так и у детей позволяет лиофилизированным пробиотикам пройти активацию. Однако общекишечный транзит при диарее может быть значительно ускорен. Так, по результатам исследования у детей 3–18 месяцев с диареей время общекишечного транзита (Total gut transit time) составляло всего лишь 5 часов (Roy, 1991).
Важным вопросом является коррекция нарушений микрофлоры при приеме антибактериальной терапии. Препараты на основе метаболитов полезных бактерий, таких как Хилак форте, не содержат живых микроорганизмов. Поэтому их применение совместно с антибиотиками может быть более предпочтительным, т. к. последние никоим образом напрямую не уменьшают их эффективность.
В любом случае, для того чтобы не нарушить хрупкую микроэкологическую структуру кишечника или восстанавливать ее после каких-либо агрессивных воздействий, необходимо использовать весь арсенал средств, доступных в настоящее время в медицине в целом и в детской гастроэнтерологии в частности, сочетающий использование наряду с пробиотиками средств, способствующих скорейшей адаптации колоний симбионтных бактерий на слизистой оболочке кишечника, — продуктов естественного метаболизма микроорганизмов, к которым относится и Хилак форте.
В таблице приводятся биохимические критерии состояния микробной экологии кишечника, полученные при обследовании практически здоровых людей — доноров крови [37].
Литература
П. Л. Щербаков, доктор медицинских наук, профессор
ГБУЗ МКНЦ ДЗМ, Москва
Дисбактериоз
При нарушении баланса находящихся в организме бактерий развивается такое неприятное заболевание, как дисбактериоз. Оно более относится к функциональному расстройству, однако при несвоевременном принятии мер могут последовать осложнения в работе организма, в частности, в работе желудочно-кишечного тракта. Дисбактериоз может проявиться как самостоятельный недуг, а, может быть последствием или признаком другого заболевания, связанного с работой желудка и кишечника.
Чаще «борьба бактерий» наблюдается у детей, особенно у грудничков, однако, ввиду различных обстоятельств взрослые также могут пострадать от этого заболевания. Лечение дисбактериоза кишечника у взрослых должно проводиться только после диагностирования заболевания и под наблюдением лечащего врача и при необходимости, смежных специалистов. Лекарство от дисбактериоза подбирается на основании того, насколько критично состояние здоровья пациента.
Причины дисбактериоза у взрослых и его симптомы
Дисбактериоз у взрослых может развиться по нескольким причинам: нарушение режима питания, а также несбалансированное питание и употребление в пищу некачественных продуктов: например, мясо относится к тяжелой пище и прием его в больших количествах может привести к его застою и образованию гнилостных процессов в кишечнике; кроме этого, еда не должна быть перенасыщена консервантами и нитратами; хронические и незалеченные до конца заболевания желудка или кишечника: такое состояние организма провоцирует размножение микробов; послеоперационный период, период после перенесенной химии или после прохождения курса лечения антибиотиками: антибиотики должны назначаться исключительно врачом и только в особой необходимости, это связано с тем, что грамотный их подбор влияет на тот факт, поспособствуют они уничтожению определенной группы бактерий или же будут «уничтожать» все подряд; также и химиотерапия влечет за собой гибель многих групп полезных бактерий; прием неподходящих определенному организму гормональных препаратов.
Определить развитие дисбактериоза у взрослых можно по следующим симптоматическим признакам: нарушение стула, чаще запоры; скопление газов и затрудненный их выход; тошнота и отрыжка, сопровождаемая неприятными запахами изо рта; слабость и высокая потливость; бессонница или повышенная сонливость.
При проявлении признаков дисбактериоза необходимо незамедлительно обратиться к врачу для точного диагностирования заболевания и назначения лечения.
Лечение дисбактериоза кишечника у взрослых
Лечение этого заболевания проводится в несколько последовательных этапов в зависимости от состояния пациента и других сопровождающих факторов. Лечение дисбактериоза кишечника у взрослых заключается в принятии следующих мер: уничтожение болезненных микробов, а также патогенных микроорганизмов – очищение микрофлоры; обогащение желудка и кишечника полезными бактериями; приведение в норму бактериального баланса и наблюдение за его состоянием определенный промежуток времени во избежание неблагоприятных последствий; иммунотерапия и витаминное обогащение в целях укрепления общего состояния здоровья.
Определяя, какое лекарство от дисбактериоза является наиболее эффективным, специалисты сходятся во мнении, что в каждом конкретном случае все зависит от особенностей организма. Зачастую дисбактериоз требует комплексного и довольно длительного лечения, которое может включать несколько или все возможные и допустимые для организма приемы. Каждый случай проявления дисбактериоза у взрослых индивидуален.
Коррекция дисбиоза кишечника: современные подходы
В последнее время коррекция дисбиоза кишечника вошла в практику клинициста как важная часть в плане ведения больных с различными заболеваниями. Термин «дисбиоз» хотя и существует уже более 90 лет, не всеми признан, и, что особенно важно, не всеми понимае
В последнее время коррекция дисбиоза кишечника вошла в практику клинициста как важная часть в плане ведения больных с различными заболеваниями. Термин «дисбиоз» хотя и существует уже более 90 лет, не всеми признан, и, что особенно важно, не всеми понимается одинаково.
Дисбактериоз подразумевает устойчивое снижение числа нормальных бактерий «открытых систем» человека, т. е. слизистых оболочек и кожи. Однако известно, что вслед за освобождением данных экологических ниш от нормальных бактерий, как правило, возникает колонизация оппортунистической микробиотой. В кишечнике этот процесс может быть представлен избыточным ростом не только оппортунистических бактерий, но и небактериальной микробиотой — например, грибами рода Candida. Таким образом, с этих позиций понятие «дисбиоз» более полно отражает характер нарушений микробного равновесия в кишечнике.
В Российском отраслевом стандарте «Протокол ведения больных. «Дисбактериоз кишечника»» (ОСТ 91500.11.0004–2003) под дисбактериозом кишечника понимают клинико-лабораторный синдром, связанный с изменением качественного и/или количественного состава микрофлоры кишечника с последующим развитием метаболических и иммунологических нарушений с возможным развитием желудочно-кишечных расстройств.
За рубежом для обозначения проблем дисбиоза кишечника чаще используют другие термины, например «антибиотик-ассоциированная диарея» или «синдром интестинального избыточного микробного роста». Согласно данным J. Wistrom et al. (2001), антибиотик-ассоциированная диарея развивается у 4,9% пациентов, получавших антибиотикотерапию. По другим данным, антибиотик-ассоциированная диарея встречается приблизительно у 5–10% пациентов, получавших ампициллин, 10–25% — комбинацию амоксициллина с клавулановой кислотой, 15–20% — цефиксим и 25% — другие антибиотики.
Об актуальности обсуждаемых проблем свидетельствуют два факта: масса микробиоты кишечника достигает 3,5 кг, резорбирующая площадь кишечника — 200 кв. м. С учетом этого очевидна важность характера биомассы, персистирующей на столь значительной площади.
С целью коррекции дисбиоза кишечника традиционно используют диетотерапию и биотерапевтические средства, которые можно подразделить на две группы.
Пробиотики — живые микроорганизмы из родов, входящих в состав нормобиоты кишечника человека (например, Bifidobacterium spp., Lactobacillus (L.) spp., E. coli Nissle, Enterococcus faecium, Streptococcus thermophilus). Внутри пробиотиков принято выделять подгруппу биоэнтеросептиков — живых микроорганизмов, не встречающихся в составе микробиоты человека, но способных элиминировать оппортунистическую микробиоту кишечника (например, Bacillus subtilis, Saccharomyces boulardii, Saccharomyces cerevisiae).
Пребиотики — стимуляторы размножения нормобиоты кишечника человека (например, лактулоза, растительная клетчатка, пектин, низкомолекулярные органические кислоты, витамины).
Причины дисбиоза многочисленны и подробно описаны в литературе. Главными же являются антибиотикотерапия, кишечные инфекции и ферментопатии первичного (лактазная, глютеновая недостаточность) и вторичного (при многих гастроэнтерологических заболеваниях) характера.
Клинические последствия дисбиоза кишечника обусловлены в первую очередь утратой полезных свойств нормобиоты: она участвует в терминальном (толстокишечном) пищеварении, синтезирует биологически активные вещества, осуществляет колонизационную резистентность (сдерживает рост оппортунистической микробиоты) и вызывает позитивные иммуномодуляторные эффекты. Поэтому при определенной продолжительности дисбиоза возникает кишечная диспепсия (бродильная и гнилостная), метаболические нарушения, бактериальная и микотическая эндогенная интоксикация и сенсибилизация, отягощенное течение иммунодефицитных, аллергических и аутоиммунных синдромов [2, 3, 12, 28].
Нарушение состава кишечной микробиоты способствует (по С. В. Бельмеру, 2004) [4]: повреждению энтероцитов; повышению кишечной проницаемости для макромолекул; снижению защитных свойств слизистого барьера; созданию условий для развития патогенных микроорганизмов; нарушению физиологических процессов в кишечнике; изменению моторики кишечника.
Устойчивый дисбиоз кишечника способствует клинической манифестации иммунозависимых синдромов, в частности атопического и аутоиммунного. Было показано, что использование пероральных антибиотиков в первые два года жизни независимо от действия других факторов повышало распространенность астмы, поллиноза и экземы в 4–6 раз [22]. Антибиотики, применяемые внутрь, подавляют бактериобиоту кишечника, которая играет важнейшую роль в формировании нормального иммунного ответа и его развитии в раннем детском возрасте [22]. Одна из первых работ по клиническому эффекту коррекции дисбиоза (M. Kalliomaki et al., 2003) показала, что назначение пробиотиков беременным и новорожденным существенно уменьшает риск ранних атопических заболеваний (астмы и атопического дерматита) [20].
Есть данные об осложненном течении воспалительных (аутоиммунных) заболеваний кишечника в результате нарушения дифференцировки нативных Т-хелперов из-за нарушенной стимуляции последних дендритными клетками кишечника при дисбиозе [9, 28]. По данным В. М. Абрамова и соавт., пробиотический штамм L. plantarum 8P-A выделяет низкомолекулярный пептидный фактор, участвующий в регуляции апоптоза и воспаления [1].
Основная задача нормобиоты кишечника заключается в поддержке неспецифических защитных реакций и стимуляции ассоциированной с кишечником иммунной системы (GULT) [25].
По данным И. Н. Ручкиной и соавт., после назначения в течение 3 нед пробиотического продукта, содержащего лактобактерии, отмечали увеличение содержания секреторного иммуноглобулина А в слюне более чем в 2 раза, а также снижение уровня провоспалительных цитокинов il-b и ферритина сыворотки крови [13].
Т. Н. Николаевой и соавт. установлено, что L. acidophilus, L. plantarum, L. fermentum и компоненты их микробной стенки вызывают комплексную активацию иммунокомпетентных Т- и В-лимфоцитов, зависимую от вида лактобактерий. Показано, что виды L. plantarum и L. fermentum при приеме внутрь стимулируют пролиферацию В-клеток, а L. acidophilus вызывает преимущественную индукцию Т-клеточного иммунного ответа [11].
Диарея в детском возрасте характеризуется значительными показателями заболеваемости и смертности. Многочисленные исследования свидетельствуют о том, что пробиотические препараты, содержащие лактобациллы, могут обладать антидиарейными свойствами. По данным C. W. Van Neil et al., контролируемые рандомизированные исследования показали снижение продолжительности диареи на 0,7 дня (95%, ДИ: 0,3–1,2 дня) и сокращение ее частоты на второй день лечения в 1,6 раза (95%, ДИ: 0,7–2,6 дня) у пациентов, получавших лактобациллы, по сравнению с группой плацебо. Субанализ подтвердил наличие дозозависимого эффекта. Авторы делают вывод, что применение пробиотиков, содержащих лактобациллы, является безопасным и эффективным методом лечения детей с острой инфекционной диареей [29].
По последним данным, нормобиота уменьшает риск возникновения злокачественных опухолей, улучшает состояние больных с лактазной недостаточностью, нормализует липидный обмен [2, 9, 12, 23, 28].
Нужно подчеркнуть, что устойчивый дефицит нормобиоты является одним из слагаемых дисбиотического состояния, а второй его компонент — избыточный рост оппортунистической микробиоты. Кишечный дисбиоз от колита отличает отсутствие инвазии возбудителя в слизистую оболочку. Известно, что дисбиоз с избыточным ростом Clostridium difficile приводит к псевдомембранозному колиту, с избыточным ростом Staphilococcus aureus — к стафилококковому колиту и т. д. Таким образом, дисбиоз кишечника может быть своего рода предколитом.
Клиницистам хорошо известно, что после применения антибактериальных средств возможно развитие кандидоза слизистых оболочек, в частности — кандидоза кишечника. В своих работах мы показали хороший эффект профилактики кандидозного дисбиоза при антибиотикотерапии в группах риска с помощью назначения полиенового антимикотика — натамицина [16].
Наиболее опасны в аспекте развития кишечного дисбиоза следующие группы антибиотиков: широкоспектральные антибиотики (пенициллины широкого спектра, особенно «защищенные» — амоксициллин/клавуланат, ампициллин/сульбактам и др.), линкозамиды; цефалоспорины, особенно 3 генерации (цефотаксим, цефаперазон, цефтриаксон, цефтазидим, цефтибутен, цефподоксим, просектил); тетрациклины; антибиотики с интенсивной концентрацией в собственной пластинке кишечника; сульфаниламиды, действующие в просвете кишечника (фталазол, сульгин, фтазин).
Отметим, что макролидные антибиотики, в целом мало влияющие на нормальную микробиоту, довольно часто вызывают антибиотик-ассоциированную диарею за счет мотилиноподобного эффекта.
Показано, что применение фторхинолоновых антибиотиков (ципрофлоксацин, норфлоксацин, спарфлоксацин) имеет относительно низкий риск развития антибиотик-ассоциированной диареи [5]. Впрочем, последнее не относится к фторхинолонам, имеющим антимикробную активность в отношении анаэробной микробиоты (моксифлоксацин и др.).
Симптомы, возникающие вследствие дисбиоза после перенесенной и пролеченной острой кишечной инфекции, в зарубежной литературе чаще называют постинфекционным синдромом раздраженного кишечника (СРК). В Великобритании было проведено проспективное популяционное исследование по принципу «случай-контроль» среди 128 пациентов основной группы и 129 — контрольной. СРК был диагностирован в 16,7% случаев через 6 мес после перенесенного гастроэнтерита и в 1,9% в контрольной группе (95%, ДИ: 3,32–30,69). Функциональная диарея имела место в 5,6% случаев в основной группе и отсутствовала в контрольной. [26]. Эти результаты подтверждают существование постинфекционного СРК и дают точную оценку его частоты.
По данным Н. Н. Щербина и соавт., при отдельных вариантах СРК отмечаются достоверно более выраженные изменения микробиоценоза кишечника. Особенностями СРК с преобладанием диареи по результатам микробиологического исследования кала явились нормальные показатели содержания бифидо- и лактобактерий. В то же время при болевом варианте СРК отмечается преобладание бактероидов и достоверно большее (р 3 на протяжении более десяти дней); СПИД; длительное (более 3 нед) использование системных глюкокортикостероидов (преднизолон более 0,3 мг/кг/сут); недавнее или текущее использование иммуносупрессантов (циклоспорин, такролимус, сиролимус и др.); реакция «трансплантат против хозяина» у реципиентов аллотрансплантатов кроветворных стволовых клеток; первичные иммунодефициты.
Добавим: у пациентов с лактазной недостаточностью и аллергией к молоку возможны нежелательные явления как ответ на пробиотик, недостаточно хорошо «очищенный» от компонентов производственной среды.
Указанные выше особенности легли в основу международных требований к свойствам пробиотических продуктов. Согласно требованиям FAO/WHO (организация пищевого и сельскохозяйственного контроля ВОЗ; 2001), пробиотики должны быть [19]: способны к выживанию при пассаже через желудок и кишечник (т. е. резистентны к воздействию желудочного сока и желчи); чувствительны к антибиотикам; тестированы на продукцию токсина, метаболическую и гемолитическую активность; тестированы на инфекционность у иммунодефицитных подопытных животных; проверены в отношении побочных эффектов и нежелательных явлений у человека.
Очевидно, что осуществить качественный и, главное, постоянный контроль за соблюдением этих требований может только крупный производитель.
Примером современного пробиотического комплекса, отвечающего всем требованиям FAO/WHO и прошедшего клинические испытания в странах Европы, является BION®3. Содержание пробиотических «донорских» культур (Bifidobacterium bifidum MF 20/5, Bifidobacterium longum SP 07/3, Lactobacillus gasseri PA 16/8) в нем достигает 107 КОЕ/г. Таблетки покрыты специальной оболочкой, защищающей пробиотические культуры от воздействия агрессии пищеварительных ферментов и обеспечивающей последовательное высвобождение витаминов, минералов и микробных штаммов. BION®3 — пробиотик последнего поколения. Еще одна особенность состоит в том, что BION®3 содержит не только пробиотики, но и пребиотические вещества (витамины и микроэлементы), необходимые как для нормального роста, размножения и метаболической активности резидентной микробиоты кишечника, так и для самого организма человека.
Для усиления эффекта пробиотика могут быть одновременно назначены пребиотические средства. Хороший эффект наблюдается при назначении пребиотического средства лактулозы (Нормазе). Лактулоза повышает осмотическое давление в просвете кишечника, тем самым предотвращая образование «травмирующего» стула и способствует нормализации стула при запорах. Другой эффект лактулозы — «подкисление» рН толстой кишки: это, как известно, стимулирует рост нормобиоты. Немаловажно и то, что назначение лактулозы способствует дезинтоксикации. По данным И. В. Хамагановой и соавт., эффективность терапии атопического дерматита (как у взрослых, так и у детей) значительно повышается при назначении Нормазе 5–15 мл/сут курсами по 10–14 дней [14].
В заключение можно сделать несколько выводов. Во-первых, применение пробиотиков при целом ряде заболеваний имеет существенные преимущества, в частности для коррекции и профилактики побочных эффектов антибактериальной терапии. Во-вторых, для успеха пробиотической терапии необходимо, чтобы пробиотик был «защищен» от внешних воздействий специальной лекарственной формой, применялся (по показаниям) на фоне селективной деконтаминации и представлял собой штаммы нормобиоты, максимально совместимые с резидентными штаммами и местной иммунной системой пациента. В-третьих, эффективность пробиотиков будет усиливаться за счет комбинирования с пребиотическими средствами.
Литература
М. А. Шевяков, доктор медицинских наук, профессор
СПбМАПО, Санкт-Петербург
Подходы к медикаментозному лечению дисбактериоза кишечника
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Под общим понятием «дисбактериоз» подразумевается клинико–лабораторный синдром, возникающий при ряде заболеваний и клинических ситуаций, характеризующийся изменением качественного и/или количественного состава нормальной микрофлоры, метаболическими и иммунными нарушениями, сопровождающимися у части больных клиническими проявлениями [1]. Таким образом, дисбактериоз – это не диагноз, а состояние.
При дисбактериозе кишечника появляется значительное количество микробов в тонкой кишке и изменение микробного состава толстой кишки. В толстой кишке меняется общее количество и свойства микроорганизмов, усиливается их инвазивность и агрессивность [11].
Причин дисбактериоза кишечника может быть несколько: это гипо– и ахлоргидрия желудка (особенно при нарушении эвакуации из него), синдром приводящей петли после резекции желудка по Бильрот–2, тощекишечные и дуоденальные дивертикулы, синдром слепой петли при тонко–толстокишечных анастомозах конец в бок, непроходимость кишечника, хронический панкреатит, иммунодефициты, бездумное и бесконтрольное применение антибиотиков, приводящее к гибели значительной части представителей нормальной микрофлоры, чувствительных к препарату, и размножению устойчивой к нему микрофлоры, в т.ч. патогенной и условно–патогенной, нарушения питания, употребление алкоголя и др. Известно, что этиотропная терапия острых и хронических желудочно–кишечных заболеваний, особенно квадритерапия хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, ассоциированных с Helicobacter pylori, в 100% случаев ведет к усугублению дисбиотических явлений [13].
Дисбактериозами страдают пациенты практически всех стационаров и амбулаторных служб, жители экологически неблагоприятных регионов, нарушения нормальной микрофлоры которых формируются в результате воздействия на организм физических, химических, радиационных и других факторов [4,10].
С современных позиций нормальную флору рассматривают как совокупность микробиоценозов различных частей тела. Для полного здоровья человека характерно состояние равновесия микроэкологии организма. Кишечник здоровых людей представляет собой пример сбалансированного взаимодействия между защитными силами макроорганизма и микробными ассоциациями. В состав флоры содержимого толстого кишечника входят анаэробные и аэробные бактерии. Нормальная микрофлора на 95% состоит из анаэробных видов бактерий, главными из которых являются бифидобактерии и лактобактерии. Функции полезной микрофлоры в организме человека неоценимы. Перечислим наиболее важные из них.
Ферментопродуцирующая функция: нарушение и гибель полезной микрофлоры в организме ведет к тому, что нарушается метаболизм разнообразных субстратов растительного, животного и микробного происхождения – глюкозы, фруктозы, лактозы, а также более сложных соединений, содержащих углеводы. Лактобактерии нейтрализуют действие фенольных ферментов, поддерживающих разрастания раковых клеток в кишечнике, препятствуя тем самым развитию рака молочной железы и толстого кишечника. Важную роль микрофлора кишечника играет в метаболизме белков. Бактериальные протеазы гидролизуют белки и пептиды, а последние под действием бактероидов гидролизуются до аминокислот и пептидных остатков. Одним из свойств нормофлоры является метаболизм азот– и углеродосодержащих соединений за счет микробных ферментов. Метаболизм мочевины в кишечнике происходит за счет микробных уреаз. Микрофлора кишечника участвует в деградации липидов и в их синтезе. Нормальная микрофлора принимает участие в рециркуляции желчных кислот и активно влияет на холестериновый и билирубиновый метаболизм.
Защитная функция: нормальная микрофлора кишечника в процессе эволюции приобрела исключительно важную роль в формировании колонизационной резистентности организма. Одним из главных механизмов защиты от колонизации условно–патогенными и патогенными бактериями является присутствие в организме достаточного количества собственной полезной микрофлоры, к которой, в первую очередь, относятся лакто– и бифидобактерии. Очень важным фактором защиты является то, что представители нормофлоры продуцируют бактериоцины, лизоцим и другие антибиотикоподобные вещества, обуславливающие антагонистическую активность этих бактерий. Представители нормофлоры в кишечнике конкурируют с патогенной флорой за аргинин, треонин, аспарагиновую кислоту, серин, за область обитания – экологические ниши.
Синтетическая функция: бактерии кишечной флоры синтезируют витамины, необходимые для метаболических реакций. Бифидобактерии синтезируют витамины группы В, в частности, никотиновую, фолиевую кислоты, тиамин, биотин, цианокобаламин, а также аминокислоты и белки, обеспечивающие их всасывание. Лактобактерии образуют молочную кислоту, продуцируют лизоцим, леколин, низин, ацидофилин и др. Кишечная палочка способствует синтезу иммуноглобулинов, что препятствует развитию инфекции, вырабатывает канцеролитические вещества. Продуцируя молочную кислоту, бифидо– и лактобактерии создают в кишечнике кислую среду, подавляя гнилостную флору и способствуя всасыванию кальция, витамина Д и железа. Большое значение имеет продуцирование анаэробами биологически активных соединений – летучих жирных кислот, которые принимают участие в рециркуляции и абсорбции ионов натрия, калия, хлора, воды, а также кальция, магния и цинка. Кишечная нормофлора способна разлагать белки до конечных продуктов распада (индол, фенол, скатол), утилизировать непереваренные пищевые субстраты, образуя органические кислоты, аминокислоты и другие соединения, которые нормализуют обмен веществ в организме. Микрофлора кишечника, в конечном счете, поддерживает водный, электролитный и кислотно–щелочной балансы в организме.
Иммунногенная функция: нормальная микрофлора способствует пролиферации плазматических клеток. Бифидобактерии стимулируют синтез антител к овальбумину, лактобактерии повышают активность фагоцитов и лимфоцитов. Повышение численности бифидо– и лактобактерий при их недостатке приводит к положительному эффекту в уменьшении воспалительных процессов слизистой кишечника и увеличении В–лимфоцитов в периферической крови. Иммуностимулирующий эффект под воздействием нормофлоры проявляется усилением фагоцитарной активности макрофагов, моноцитов, увеличением специфического А, синтезом цитокинов, стимуляцией клеточных иммунных механизмов защиты. К сожалению, не до конца оправдывают себя фагопрофилактика и фаготерапия дисбактериоза. Тому есть ряд причин: слишком узкая специфичность, быстрое появление фагорезистентных штаммов патогенных бактерий, а также возможность сенсибилизации организма этим видом чужеродного белка. Кроме того, фаги плохо сорбируются в коллоидной среде, так что трудно представить возможность их бактерицидности в толстом кишечнике, где бактерии окутаны слизью и перемешаны с фекальными массами. Проблемой является доставка фагов к «месту назначения». В частности, практикуемое введение препаратов при помощи клизмы не обеспечивает поступления фагов в проксимальные отделы толстого кишечника, где может быть локализован основной дисбиотический процесс, то же касается и введения фагов в виде ректальных свечей. Даже высокая эффективность бактериофагов не гарантирует его эффективности при введении в организм.
Симптомы дисбактериоза напрямую связаны с заболеванием или состоянием, которое вызвало дисбактериоз, и являются неспецифичными и разнообразными: снижение или отсутствие аппетита, тошнота, рвота, металлический привкус во рту, боли в животе (тупые или схваткообразные), возникающие спонтанно и при пальпации, отрыжка, метеоризм, чувство неполного опорожнения кишечника, императивные позывы на дефекацию, запоры, понос, заеды, зуд кожи и слизистых, высыпания на коже (при развитии аллергических реакций), утомляемость.
Необходимо помнить о том, что дисбактериоз всегда усугубляет течение хронических болезней пищеварительного тракта, а потому это состояние всегда требует своевременной диагностики и лечения. Лечение патологических состояний, связанных с дисбактериозом, должно быть комплексным и направленным на устранение избыточного бактериального обсеменения кишечника условно–патогенной микрофлорой, восстановление нормальной микрофлоры и нарушенной моторики толстого кишечника, улучшение кишечного пищеварения и всасывания, стимулирование реактивности организма.
В связи с этим в лечении дисбактериоза кишечника используются следующие группы препаратов: антибактериальные средства и антисептики, пробиотики, пребиотики, синбиотики, пищеварительные ферменты, регуляторы моторики кишечника, стимуляторы реактивности организма.
Применение антибиотиков должно быть оправданным, т.к. они сами могут оказывать губительное влияние на симбионтную микробную флору толстого кишечника. Антибактериальные средства желательно применять при наличии абсолютных показаний, таких как бактериемия и угроза энтерогенного сепсиса, причиной которых является дисбактериоз. Достаточно часто антибиотики применяют при избыточном обсеменении тонкой кишки условно–патогенной флорой, при заболеваниях, сопровождающихся нарушением всасывания и моторики кишечника [15]. Применяются препараты фторхинолоновой группы (офлоксацин или норфлоксацин по 400 мг 2 раза в сутки в течение 5–7 дней), пенициллины (амоксициллин по 500 мг 3 раза в сутки в течение 5–7 дней), тетрациклины (доксициклин по 100 мг 2 раза в сутки в течение 3–5 дней).
Наиболее предпочтительными препаратами при дисбактериозе кишечника являются антимикробные препараты, такие как ко–тримоксазол (по 480 мг 2 раза в сутки в течение 7 дней), налидиксовая кислота (по 1 г 4 раза в сутки в течение 7 дней), нифуроксазид (по 200 мг 4 раза в сутки в течение 5–7 дней), фуразолидон (по 100 мг 4 раза в сутки в течение 7 дней), антисептики – интетрикс (по 2 капс. 2 раза в сутки в течение 7 дней).
Препараты, применяемые для восстановления нормальной микрофлоры кишечника, принято подразделять на 3 группы: пробиотики, пребиотики и синбиотики [4,6,7,9,14,18].
Пробиотики – это живые микроорганизмы и вещества микробного происхождения, оказывающие при естественном способе введения позитивные эффекты на физиологические, биохимические и иммунные реакции организма хозяина через стабилизацию и оптимизацию функции его нормальной микрофлоры [2,3,14,16,17].
В России зарегистрировано несколько бифидосодержащих препаратов, которые применяются для лечения дисбактериоза в течение 2–3 недель.
Составляющим этих препаратов являются живые бифидобактерии, которые обладают антагонистической активностью против широкого спектра патогенных и условно–патогенных бактерий, основное назначение – обеспечение быстрой нормализации микрофлоры кишечного тракта. Быстрое заселение кишечника бифидобактериями способствует нормализации количественного и качественного состава микрофлоры и стимулирует репаративный процесс слизистой оболочки кишечника [1–6,9]. Ряд преимуществ имеет препарат бифиформ. Первое из них заключается в том, что капсула препарата кислотоустойчива, т.е. не растворяется соляной кислотой и пепсином. Это обеспечивает высвобождение в кишечнике высоких концентраций содержащихся в препарате бактерий практически без их инактивации на уровне желудка. Вторым важным преимуществом и особенностью бифиформа является наличие в его капсуле специфических факторов, которые, освобождаясь в кишечнике, ускоряют и усиливают его колонизацию бифидобактериями и энтерококками, причем бифидобактерии колонизируют толстую, а энтерококки – и толстую, и тонкую кишку.
Не менее важное место занимают лактосодержащие препараты. Длительность лечения зависит от причины развития дисбактериоза и индивидуальных особенностей (от 2 недель до 1,5 месяцев). Действующим началом этих препаратов являются живые лактобациллы, обладающие широким спектром антагонистической активности за счет продукции органических кислот, микробного лизоцима, перекиси водорода и различных антибиотических веществ. Лактобациллы синтезируют различные ферменты и витамины, принимающие участие в пищеварительной деятельности желудочно–кишечного тракта, обладают иммуномодулирующим действием, важным для восстановления естественных иммунных факторов защиты организма [2–6,9,17,18].
Коли–содержащие препараты применяются в течение 1–3 месяцев. Они обладают антагонистической активностью в отношении широкого спектра патогенных и условно–патогенных микроорганизмов, включая шигеллы, сальмонеллы, протей; оказывают корригирующее воздействие на нарушенный микробиоценоз; стимулируют местные репаративные процессы в кишечнике; способствуют улучшению пищеварения и обмена веществ; стимулируют естественные факторы защиты. Могут применяться для лечения больных хроническими колитами разной этиологии, реконвалесцентов острых кишечных инфекций при наличии дисфункций кишечника, протекающих на фоне дисбактериоза.
Сухие препараты достаточно долго хранятся при комнатной температуре. Но есть существенный недостаток – после процесса лиофилизации бактерии ослаблены и плохо приживаются в кишечнике, так как требуется 8–10 часов для их перехода от анабиоза к активному физиологическому состоянию, но к этому времени большая их часть уже элиминируется из кишечника.
Жидкие препараты представляют собой микробную массу бактерий в живой активной форме и имеют ряд преимуществ перед сухими: бактерии находятся в активном состоянии и способны к колонизации ЖКТ уже через 2 часа после попадания в организм; жидкие препараты кроме бактерий содержат продукты их жизнедеятельности – незаменимые аминокислоты, органические кислоты, интерферонстимулирующие вещества.
Пребиотики – это препараты немикробного происхождения, способные оказывать позитивный эффект на организм хозяина через селективную стимуляцию роста или усиления метаболической активности нормальной микрофлоры кишечника [1–4,8–9]. В эту группу входят препараты, относящиеся к различным фармакотерапевтическим группам, но обладающие общим свойством – стимулировать рост и развитие нормальной микрофлоры кишечника.
Из пребиотиков чаще всего используется Хилак форте. Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочную кислоту, аминокислоты и жирные кислоты. Препарат способствует восстановлению нарушенной нормальной микрофлоры кишечника биологическим путем, вызывая сдвиг рН в ЖКТ в границах физиологической нормы, что создает неблагоприятные условия для развития патогенной и условно–патогенной микрофлоры, обеспечивает санацию кишечника. Продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. Хилак форте назначают по 40–60 капель 3 раза в сутки на срок до 4 нед. в сочетании с препаратами антимикробного действия или после их применения.
По данным, приведенным в литературе, на сегодняшний день известно, что применение капель Хилак форте у больных хроническими заболеваниями органов пищеварения, осложненных дисбактериозом, способствовало уменьшению частоты дефекаций примерно вдвое уже через 3–5 суток после начала приема препарата. Больные отмечали также значительное уменьшение клинических проявлений. Использование препарата способствовало положительной динамике копрологических показателей: содержание перевариваемой клетчатки, внутриклеточного крахмала и йодофильной микрофлоры, определявшихся в значительном количестве у подавляющего числа больных до начала лечения Хилак форте, существенно уменьшалось в среднем через 2 недели от начала лечения, а к концу курса терапии в фекалиях практически не определялись крахмальные зерна и непереваренные мышечные волокна.
Использование Хилак форте улучшало микробное содержание толстой кишки. В процессе лечения у большинства больных 1 и 2 стадии дисбактериоза кишечника достигалась полная нормализация микробиоценоза. У больных с тяжелыми нарушениями кишечной микрофлоры (дисбактериоз 3 и 4 стадии), хотя и не был полностью достигнут эубиоз, наблюдалось уменьшение относительного количества эшерихий, стафилококков и бактерий рода клебсиелл и протея в фекалиях, что свидетельствовало о положительном влиянии препарата на состав кишечной микрофлоры. Кроме того, Хилак форте прекрасно переносился больными. Не было зарегистрировано побочных эффектов, которые бы потребовали его отмены.
Нами Хилак форте использовался у больных хронической алкогольной интоксикацией, у которых отмечались клинические проявления дисбактериоза. При длительном применении нормализовался стул, уменьшались диспесические явления.
В качестве пребиотиков также используют такие средства, как лактулоза, кальция пантотенат, лизоцим и др.
Синбиотики – это препараты, полученные в результате рациональной комбинации пробиотиков и пребиотиков. Часто это биологически активные добавки, входящие в состав функционального питания, обогащенные одним или несколькими штаммами представителей родов Lactobacillus и Bifidobacterium. В России известны несколько препаратов, содержащих бифидогенные факторы и биомассу B. bifidum, B. adolescentis, L. plantarum, мальтодекстрин, L. acidоphilus, L. bulgaricus, фруктоолигосахариды из топинамбура в комбинации и количестве, наиболее характерных для определенного возраста ребенка, подростка и взрослых лиц.
Регуляторы пищеварения и моторики кишечника назначаются в зависимости от наличия заболевания, явившегося причиной дисбактериоза.
Для повышения реактивности организма ослабленным больным также применяют иммуностимулирующие средства.
Таким образом, дисбактериоз является сложным симптомокомплексом, возникающим на фоне различных факторов и заболеваний. Лечение дисбактериоза достаточно сложное, требующее большого вклада сил и средств. В связи с этим необходимо проведение вторичной профилактики дисбактериоза: осторожно применять антибактериальные препараты, пытаться своевременно диагностировать и лечить хронические заболевания желудочно–кишечного тракта.
Дисбактериоз кишечника, как побочный эффект антихеликобактерной терапии и новый способ его коррекции
МЕДИКАМЕНТЫ И ФАРМПРЕПАРАТЫ
Предлагаемая статья является продолжением темы фармакотерапии дисбактериоза кишечника, которую авторы подняли в 7-м номере «Медицинской картотеки». Верткин А.Л., Артамонов В.Е., Багатурия И.Ф., Машарова А.А., Габуева-Джигкаева Ж.В.
Кафедра клинической фармакологии и внутренних болезней Московского медицинского стоматологического института
Оценка воздействия и коррекция нарушений антихеликобактерной терапии на микрофлору кишечника явилась целью нашей работы.
У всех больных диагноз язвенной болезни подтвержден эндоскопически. Уреазный и микробиологический тест на Helicobacter Pylori был положителен также у всех больных. Для контроля за динамикой микрофлоры кишечника использовалось микробиологическое исследование кала, которое выполнялось после антихеликобактерной терапии и после применения эубиотиков. Кроме этого, также двукратно, проводилось копрологическое исследование кала.
Оценка результатов лечения проводилась по следующим критериям:
У больных во второй группе после применения Биофлора урчание в животе купировано на 2,5+/-1,7 (р
Клинические особенности различных форм ДИСБАКТЕРИОЗОВ
Термин кандидамикоз (или кандидоз) был предложен на III Международной конференции микробиологов в 1939 году. Случаи поражения кожи, слизистых оболочек и внутренних органов дрожжеподобным грибом рода Candida были известны задолго до эры антибиотиков. Однако значительное увеличение числа случаев развития кандидамикозов связано с применением антибиотиков, которые не только подавляют нормальную микрофлору, но и могут стимулировать рост дрожжеподобных грибов, вызывать обменные нарушения в организме и другие изменения, способствующие понижению сопротивляемости организма. То же самое относится и к последействию гормонов, иммунодепрессантов, цитостатиков и других препаратов. Возникновению кандидамикозов способствуют и многие эндогенные факторы, в том числе различные эндокринопатии, генетические дефекты, иммунологическая недостаточность и другие. Некоторые авторы считают, что кандидамикоз может развиваться в качестве внутрибольничной инфекции [2].
Несмотря на то что кандидамикоз давно известен, Лещенко В. М. (1987) совершенно справедливо относит его к современным болезням цивилизации, в числе которых так называемые “болезни от лечения”, ибо первичный кандидамикоз встречается очень редко — обычно это состояние развивается вторично на фоне имеющейся патологии. В последние два десятилетия появилось большое количество публикаций, не только микробиологического, но и клинического характера; описаны различные варианты течения кандидамикоза вплоть до развития сепсиса, усовершенствовались методы лабораторных исследований, а также лечения и профилактики.
Чаще других встречаются поражения слизистых оболочек, в первую очередь ротовой полости, а также желудочно-кишечного тракта. Диагноз в этих случаях, как правило, не представляет трудности, за исключением поражений недоступных осмотру слизистых оболочек, например мочевого пузыря. Описаны случаи, когда больному неоднократно назначали различные химиотерапевтические средства, считая, что затяжное течение цистита связано с развитием устойчивости флоры. И только после цистоскопии, обнаружив на слизистой мочевого пузыря белый налет в большом количестве и проведя микроскопическое исследование, уточнившее его характер, больному правильно поставили диагноз и назначили соответствующее лечение.
 |
| Рисунок 1. “Черный волосатый язык” |
Нередко появление кандидамикотических поражений на языке (так называемой “молочницы”) сочетается с “черным волосатым языком”, который также может встречаться в процессе лечения антибиотиками, в основном тетрациклинового ряда (рис. 1). В литературе имеются лишь единичные описания этого осложнения, хотя небольшие изменения окраски языка (желтоватого, коричневого цвета), металлический привкус во рту беспокоят больных довольно часто. “Черный волосатый язык” описан впервые в 1835 году французким врачом Рейо вне всякой связи с антибиотикотерапией. Автор полагал, что указанные изменения на языке зависят от резкой витаминной недостаточности (особенно тиамина и рибофлавина).
| Чаще дрожжеподобным грибом поражается слизистая желудочно-кишечного тракта, причем в клинике обнаруживаются изменения только ротовой полости и иногда ошибочно считается, что этим ограничивается процесс. Очень часто наложения молочницы отмечаются в слизистой оболочке нижележащих отделов желудочно-кишечного тракта |
Описаны также случаи кандидамикоза легких, протекающие по типу бронхогенного рака. Подобное течение мы наблюдали в клинике у больной О., 69 лет, которая поправилась только после проведения соответствующего лечения противокандидными средствами (леворин, низорал) в комплексе с общеукрепляющими. Никифоров Н. Ф. (1994) наблюдал больных с кандидамикозом легких, клиника которых напоминала милиарный тубуркулез, сепсис, гангрену. Иногда наблюдался выпот, наклонность к бронхоспазмам.
Кандидамикозный сепсис встречается нечасто, но протекает всегда тяжело и нередко заканчивается смертью больных. В литературе описаны лишь единичные случаи развития кандидасепсисов. Так, Ибрагимов Г. Г. (1990) наблюдал развитие кандидасепсиса у больной с подострой формой вирусного гепатита В; Фомина А. А., Осташевская Т. Г., Хоминская М. В. (1990) — у больного с хроническим персистирующим гепатитом. Данное заболевание сопровождалось наличием микотических тромбов в сосудах и дрожжеподобных грибов рода Candida в ткани легких, печени, почек, трахеи, диффузного миокардита, энцефалита. Больной скончался при явлениях резко выраженной интоксикации и легочно-сердечной недостаточности.
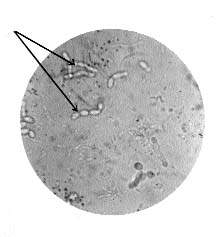 |
| Рисунок 3. Микроскопическое исследование осадка мокроты. Почкующиеся клетки (отмечены стрелками) и мицелий дрожжеподобного гриба |
При диагностике кандидамикозов помимо клинических данных необходимо учитывать обнаружение дрожжеподобных грибов в соскобах со слизистых (почкующихся клеток и мицелия), в нативных препаратах осадков мочи, в кале, мокроте и т. д. (рис. 3), а также комплекс серологических исследований (РА и РСК с дрожжевыми антигенами), реакцию иммунофлюоресценции.
До настоящего времени в литературе имеется небольшое количество сообщений о клинико-морфологических особенностях развития аспергиллезов вследствие дисбактериоза. Лабораторные методы исследования, терапия и профилактика аспергиллезов разработаны еще недостаточно.
Аспергиллез принадлежит к так называемым плесневым микозам. Вследствие дисбактериоза чаще других развиваются пенициллиозы и очень редко мукорозы. В настоящее время описано свыше 300 видов аспергиллов, 15 из них могут вызвать заболевание (рис. 4).
 |
| Рисунок 4. Аспергиллы. Сегментированный мицелий, на поверхности которого образуется множество одноклеточных конидиеносцев |
Различные виды плесневых грибов, чаще других аспергиллы, способны поражать наружные покровы и внутренние органы человека: ткани мозга, глаз, ухо, придаточные полости носа, бронхи, легкие, мочеполовую систему, лимфатические узлы, кости, все элементы опорно-двигательного аппарата. Помимо поражения внутренних органов и наружных покровов, аспергиллы могут вызывать сильную интоксикацию — микотоксикозы, так как обладают способностью выделять ядовитые вещества.
Аспергиллез чаще возникает как вторичное заболевание у сильно ослабленных, истощенных больных на фоне общего, чаще всего хронического, заболевания легких (туберкулез, пневмонии, бронхит, бронхоэктазы и др.), болезней крови, хронических заболеваний желудочно-кишечного тракта и т. д., в процессе длительного применения антибиотиков (особенно тетрациклина), и является следствием развившегося дисбактериоза и суперинфекции. Аспергиллез может возникать экзогенно, как профессиональное заболевание у рабочих в цехах по изготовлению спиртного, на фермах и др.
Среди различных клинических форм аспергиллеза человека поражение органов дыхания встречается наиболее часто. Клиническая картина аспергиллеза легких в общем сходна с той, которая наблюдается при поражениях, обусловленных банальными патогенными микробами. При остром бронхопульмональном аспергиллезе, помимо общих явлений, характерных для пневмоний, врача настораживает появление повторного, чаще по утрам, кровохарканья; появление в мокроте (последняя, как правило, без запаха) серовато-зеленоватых комочков, отхаркиваемых при приступах кашля и представляющих собой скопления мицелия и спор плесневого гриба. В мокроте, наряду с грибковыми нитями, нередко обнаруживаются эозинофилы. При хроническом аспергиллезе чаще происходит “наслаивание” этого поражения на имеющийся туберкулезный процесс; диагностика таких поражений чрезвычайно трудна.
Котов В. С. (1990) выделяет аллергический бронхолегочный аспергиллез как самостоятельную форму заболевания вследствие развития аллергических реакций к аспергиллам. В основе этого заболевания, по мнению автора, лежит развитие сенсибилизации к антигенам аспергилл (или продуктам их жизнедеятельности) с развитием аутоиммунной альтерации различных структур бронхолегочной системы. Кинсвер О. Б., Плахотная Т. А. (1989), Стрепетова Т. Н. (1993) выделяют три формы аспергиллезного поражения легких: бронхит, пневмония, аспергиллема. Караев З. О. (1990) помимо аллергического бронхолегочного аспергиллеза наблюдал хронический некротическй аспергиллез легких, редкую форму болезни, обычно заканчивающуюся летально, и аспергиллему, представляющую собой опухолевидные образования, одну из разновидностей микомы. Аспергиллы, размножаясь, образуют “грибной шар”, диагностировать который можно только при хирургическом вмешательстве, ибо он не связан с бронхом.
Наряду с поражениями легких может встречаться и другая локализация аспергиллезной инфекции. Проникновение плесневого гриба в мозг происходит из придаточных полостей или гематогенно, в результате чего могут развиться абсцессы или поражения мозговых оболочек. О частоте этих поражений центральной нервной системы аспергиллезом можно судить по данным Хмельницкого Б. С. — из 1193 обнаруженных на секции случаев заболеваний центральной нервной системы поражение аспергиллезом отмечено в двух.
Аспергиллез желудочно-кишечного тракта чаще развивается у больных с предшествующими заболеваниями желудка или кишечника, особенно при гастритах с повышенной кислотностью. Заболевание начинается с диспептических явлений тошноты, рвоты, болей в подложечной области, горьковатого плесневого вкуса во рту, афтозных высыпаний на слизистой рта, зева и глотки, а также пенистого стула с большим количеством слизи и плесневым запахом, иногда с примесью крови.
Генерализованные формы аспергиллеза, в том числе аспергиллезный сепсис, встречаются очень редко. Известно, что этот сепсис всегда протекает крайне тяжело и, как правило, заканчивается летальным исходом.
К лабораторным методам исследования должны быть отнесены микроскопические исследования патологического материала как в нативных, так и в окрашенных препаратах, получение чистой культуры, идентификация вида гриба в микологической лаборатории при повторном получении культур одного и того же вида аспергилл, а также серологические исследования (РСК и РА). При наличии аспергилловой вакцины можно поставить внутрикожную пробу. В настоящее время налажена ИФА (определение IgG-антител к аспергиллезному антигену).
По стафилококковым заболеваниям, которые по большей части являются следствием лекарственного дисбактериоза, развивающегося на фоне измененной реактивности организма и понижения барьерной функции эндотелиально-макрофагальной системы, имеется в настоящее время большое количество публикаций, посвященных как изучению патогенеза и клиники стафилококковых инфекций в целом, так и отдельных форм течения последних. Помимо латентно протекающих форм стафилококкового дисбактериоза, могут иметь место стафилококковые бактериемии, локализованные поражения кожи и внутренних органов (стафилококковая пневмония, энтероколит и другие), с генерализацией и без таковой, а также развитие стафилококкового сепсиса.
| Аспергиллы — аэробы, биохимически активны, образуют протеолитический, сахаролитический и липолитический ферменты, что особенно надо учитывать при заболеваниях, вызванных этим грибом, поскольку в клинической картине могут иметь место состояния опьянения, как и при кандидамикозах, особенно после употребления в пищу большого количества углеводов |
Стафилококковая бактериемия, как известно, может сопровождать любую форму стафилококкового заболевания или присоединяться к болезням нестафилококковой этиологии. В одних случаях стафилококковая бактериемия является составным патогенетическим звеном (при стафилококковых сепсисах), в других не имеет до определенного времени важного патогенетического значения и клинически никак не проявляется. В литературе имеются указания на то, что наиболее часто встречаются стафилококковые бактериемии у больных, у которых имели место аллергические проявления лекарственной болезни; это подтверждается и нашими данными. Так, анализируя клинический материал по брюшному тифу за 1970–1972 годы, мы выявили, что из 377 больных брюшным тифом у 90 (29,9%) был выделен стафилококк из крови. Развитие аллергических проявлений лекарственной болезни имело место у 41 больного, причем у 14 из них был выделен стафилококк из крови. Как показала статистическая обработка материала, в группе больных с аллергическими проявлениями лекарственной болезни стафилококковая бактериемия встречалась чаще. Кроме того, наблюдения за больными с различными заболеваниями показали, что там, где имело место развитие аллергических проявлений лекарственной болезни, чаще возникала генерализация стафилококковой инфекции.
В организме больного в процессе развития дисбактериоза, как и при аллергической форме лекарственной болезни, происходит глубокая перестройка, развитие аутоиммунных процессов, сопровождающееся изменениями иммунобиологического состояния, в том числе и появлением антител как к аутоштаммам микроорганизмов, так и к различным тканям организма, что имеет и свои клинические проявления. Помимо изменений в органах и системах организма, связанных с развитием инфекционного процесса, особенно при генерализованных формах дисбактериоза, обращают на себя внимание клинические признаки гиперчувствительности замедленного типа. Они проявляются в виде поражения внутренних органов аллергического генеза, особенно миокарда, а также кишечника, печени и других. Именно с этих позиций рассматривают в настоящее время происхождение аллергических миокардитов у больных с генерализованными формами стафилококкового дисбактериоза, а также до последнего времени такого тяжелого заболевания, как псевдомембранозный колит.
Псевдомембранозный колит (ПМК) в настоящее время большинством авторов рассматривается как острое заболевание, характеризующееся быстрым течением с летальным исходом в 50-75% случаев. Различные этиологические факторы, так же как нарушение кишечной микрофлоры в процессе лечения антибиотиками, особенно клиндамицином (или синтетическим его производным линкомицином), тетрациклинами и другими антибиотиками, аутоиммунные процессы, действие токсинов, вирусов, — были предложены для объяснения причин возникновения ПМК. Действительно, при ПМК часто обнаруживали различные условно-патогенные микробы, особенно стафилококки, вирусы. Однако сравнительно недавно рядом авторов было установлено, что токсины, продуцируемые бактериями рода клостридий, вовлечены в патогенез ПМК и в настоящее время рассматриваются как наиболее вероятная причина возникновения этого заболевания. Лечение этого заболевания всегда представлялось очень сложным. В комплекс лечебных мероприятий, помимо отмены препарата, предположительно вызвавшего развитие ПМК, включают гормональные средства (преднизолон, дексаметазон), симптоматические средства, а также антибактериальную терапию в зависимости от выделенного возбудителя.
Наибольшую опасность в настоящее время представляет развитие сепсиса, в том числе и стафилококкового. “Болезнью века” называл сепсис Билибин А. Ф. (1978), много занимавшийся изучением этого недуга. В развитии сепсиса решающую роль играет падение резистентности организма — иначе говоря, сепсис развивается лишь в тех случаях, когда нарушение экологического равновесия микрофлоры (дисбактериоз, наивысшим проявлением которого собственно и является сепсис) развивается на фоне резкого снижения защитно-приспособительных механизмов организма. Поэтому сепсис считают проблемой не микробиологической, а макробиологической. Этот фактор тем более важен, что во многом определяет тактику лечения больных сепсисом, а именно: при комплексном лечении необходимо учесть и назначить в первую очередь средства, повышающие резистентность организма. С этой целью больным сепсисом, наряду с химотерапевтическими препаратами, которые нужны лишь в определенные фазы течения болезни, и десенсибилизирующей терапией, должны назначаться биологические стимуляторы, такие как трансфузия крови и ее заменителей, антистафилококковая плазма или гамма-глобулин, стафилококковый анатоксин, продигиозан, лизоцим и другие препараты, индивидуально выбираемые в каждом конкретном случае.
Обычно сепсис развивается из местных очагов инфекции. Если до появления антибиотиков при сепсисе наиболее часто выделялись стрептококки, то сегодня они уступили место стафилококкам. Последние приобрели устойчивость к большинству известных антибиотиков. В зависимости от остроты и длительности течения выделяют молниеносные, острейшие, острые и затяжные формы сепсиса, а по характеру изменений, обнаруживаемых во внутренних органах, сепсис с метастазами (пиемия, септикопиемия) и сепсис без метастазов (септицемия). Клиническая диагностика сепсиса вызывает подчас большие затруднения, в связи с чем, по данным ряда авторов, до 30% случаев сепсиса остаются при жизни нерасшифрованными. В качестве первичных септических очагов или входных ворот сепсиса могут выступать различные местные инфекционные процессы. Генерализация инфекции из первичного очага приводит к образованию метастатических септических очагов, проявляющихся в виде гнойников и септических инфарктов во всех органах и частях тела. Чаще всего септические очаги при септикопиемии наблюдаются в почках, легких, реже в головном мозге, печени, селезенке, надпочечниках и скелетных мышцах. В ряде случаев в процессе лечения сепсиса может развиться картина бактериального (эндотоксического) шока.
К лабораторным методам исследования при стафилококковом дисбактериозе, помимо бактериологического, относится комплекс серологических реакций, в том числе реакция аутоагглютинации с выделенным штаммом стафилококка, определение стафилококкового антитоксина и т. д. Однако клиническое значение их невелико, сепсис обычно диагностируется на основании клинической картины болезни в каждом конкретном случае.
В заключение по разделу клинических особенностей течения дисбактериозов и различных видов суперинфекций хотелось бы привести высказывания академика Билибина А. Ф. (1970): “В мире природы все непрерывно взаимосвязано, и равновесие, которое на этой основе существует, играет решающую роль в поддержании жизни на Земле. Поэтому всякую акцию нужно совершать с расчетом и с полным вниманием к закону равновесия”.
Литература
1. Ариевич А. М., Степанцева З. Г. Кандидамикозы как осложнения антибиотикотерапии
2. Лещенко В. М. и др. Клиника, диагностика, лечение и профилактика висцерального кандидамикоза. М., 1987.
3. Антонов В. Б., Яробкова Н. Д. Варианты кандидасепсисов и их лечение // Вестник дерматологии и венерологии. 1994. № 2. С. 8-9.
4. Быков В. Л. Дискуссионные вопросы развития кандидозных гранулем в печени // Архив патологии. 1991. 53. №6. С. 66-67.
5. Стрепетова Т. Н. Бронхолегочный аспергиллез // Вестник рентгенологии и радиологии. 1993. №3. С. 23.
6. Караев З. О. Микозы в легких, вызванные грибами // Терапевтический архив. 1990. №11. С. 137.
7. Пиличук Н. С. Микозы легких // Врачебное дело. 1990. №11. С. 5-11.
Избыточный бактериальный рост в тонкой кишке, патофизиология и вопросы терапии
Рассмотрены клинические проявления синдрома избыточного бактериального роста (СИБР) в тонкой кишке и терапия СИБР, направленная на коррекцию факторов риска развития заболевания и проведение адекватной антибиотикотерапии.
Clinical manifestations of small intestine bacterial overgrowth (SIBO) are viewed. Therapy is targeted at correction of the risk factors that predispose to SIBO and providing appropriate antibiotic therapy.
Желудочно-кишечный тракт (ЖКТ) является местом обитания огромного количества бактерий, общая масса которых превышает 1 кг. Это сообщество можно рассматривать как самостоятельный орган — микробиом, выполняющий множество жизненно важных функций для человека [1]. Состав микрофлоры каждого биотопа пищеварительного тракта является постоянным, что связано со способностью микроорганизмов фиксироваться к строго определенным рецепторам эпителиальных клеток слизистой оболочки (СО). В СО тонкой кишки имеются рецепторы для адгезии только аэробных бактерий, в то время как в толстой кишке преобладают рецепторы для фиксации анаэробных штаммов [2]. Количественные и качественные колебания состава микробиоты определяются возрастом человека, характером его питания, образом жизни, эпидемиологическими особенностями региона проживания, временем года и даже временем суток [3, 4].
В двенадцатиперстной, тощей и начальных отделах подвздошной кишки общее число бактерий составляет 10 2 –10 4 колониеобразующих единиц на 1 г содержимого (КОЕ/г), которые локализуются преимущественно пристеночно. Важно отметить, что в данном биотопе практически отсутствуют облигатно анаэробные бактерии, а также представители семейства энтеробактерий и, в первую очередь, кишечная палочка. В дистальных отделах тонкой кишки концентрация микроорганизмов возрастает и составляет 10 5 –10 9 КОЕ/г, появляются анаэробные бактерии (бактероиды, бифидобактерии и др.). Толстая кишка является основным местом обитания нормальных кишечных бактерий, содержание которых составляет 10 11 –10 12 КОЕ/г, что приблизительно равно 1/3 сухой массы фекалий. В данном биотопе обнаруживаются бактероиды, бифидобактерии, энтерококки и клостридии, лактобациллы, кишечные палочки, стрептококки, стафилококки, кандиды и ряд других бактерий. В последнее время с использованием молекулярно-генетических методов было показано, что микробиота кишечника включает около 400 различающихся между собой типов бактерий, большинство из которых относятся к родам Firmicutes и Bacteroides, объединенных в три различных энтеротипа, и требуются дальнейшие исследования для уточнения их структуры и функции [5].
Нормальные кишечные бактерии не проникают во внутреннюю среду организма благодаря существованию барьерной функции слизистых оболочек ЖКТ. Кишечная цитопротекция включает преэпителиальный, эпителиальный и постэпителиальный защитный слизистый барьер. Основными компонентами преэпителиального защитного барьера являются слизь, связанные с гликопротеинами слизи иммуноглобулины А1 и А2; гликокаликс, ряд низкомолекулярных кишечных метаболитов, обеспечивающих резистентность эпителия в отношении условно-патогенных и частично патогенных микроорганизмов, а также некоторых химических агентов. Эпителиальный (внутренний) защитный барьер включает апикальные клеточные мембраны и тесные межклеточные соединения, блокирующие пассаж в клетку макромолекул и препятствующие их межклеточному проникновению. В состав постэпителиального барьера входит кровоток, обеспечивающий фагоцитоз, гуморальные иммунные реакции и другие механизмы защиты, а также функционирование преэпителиального и эпителиального барьеров [6, 7].
Микробиом ЖКТ выполняет ряд важных функций в организме человека, включая повышение колонизационной резистентности СО в отношении условно-патогенных и патогенных бактерий, синтез витаминов, метаболизм желчных кислот, деградация ксенобиотиков, поддержание энергетического гомеостаза и др. [8]. Безусловно, при нарушении нормального состава кишечных бактерий в различных биотопах нарушаются функции микробиома ЖКТ, с развитием клинических симптомов и метаболических последствий, а также с транслокацией бактерий во внутреннюю среду.
Одним из наиболее частых и клинически значимых нарушений микробиоты кишечника является избыточный рост как нормальных для данного биотопа бактерий, так и бактерий толстой кишки, а также условно-патогенных бактерий в проксимальном отделе тонкой кишки. Это нарушение, при наличии у пациента соответствующих симптомов, принято обозначать современным термином «синдром избыточного бактериального роста» (СИБР) в тонкой кишке, вместо используемых ранее «синдром слепой петли», «синдром приводящей петли» и др. [9].
В организме здорового человека имеется многофакторные механизмы, предупреждающие избыточный бактериальный рост в кишечнике, основными из которых являются соляная кислота желудка, которая ингибирует или разрушает проглоченные микроорганизмы, и очистительный эффект кишечной моторики. Другие важные защитные факторы включают наличие иммуноглобулинов в кишечном секрете и интактный илеоцекальный клапан [10, 11]. Основные факторы риска развития избыточного бактериального роста представлены в табл. 1.
Следует отметить, что дисбиоз кишечника, включая избыточный бактериальный рост в тонкой кишке, не является самостоятельным заболеванием, но сопровождается развитием ряда симптомов и синдромов, которые вносят свою лепту в клиническую картину болезней, на фоне которых он формируется. В то же время в последние годы доказана этиологическая роль кишечного дисбиоза в развитии ряда заболеваний, включая некротизирующий энтероколит, язвенный колит, антибиотик-ассоциированную диарею, ожирение, атопические заболевания, в частности бронхиальную астму [13].
Клинические проявления СИБР складываются из местных (кишечных) симптомов, а также системных нарушений, обусловленных транслокацией кишечных бактерий и их токсинов во внутреннюю среду макроорганизма, нарушением процессов всасывания, иммунологическими расстройствами и др. Местные симптомы СИБР включают абдоминальную боль, метеоризм, диарею, падение массы тела, а при микробной контаминации двенадцатиперстной кишки (ДПК) появляется горечь во рту, чувство быстрого насыщения, мучительная тошнота. При пальпации определяются болезненность, урчание и шум плеска по ходу ДПК и петель тонкой кишки. Нередко, преимущественно при транслокации кишечных бактерий за пределы кишки и при развитии реактивного мезаденита, выявляется выраженная болезненность при пальпации в зоне дуоденоеюнального изгиба (слева выше пупка) и по ходу брыжейки тонкой кишки. Патогенетической основой формирования большинства местных клинических проявлений СИБР является мальабсорбция, обусловленная метаболическими эффектами размножающихся бактерий и повреждением энтероцитов. При морфологическом исследовании слизистой оболочки тонкой кишки при СИБР выявляется характерная микроскопическая картина в виде уплощения ворсинок, структурных повреждений щеточной каймы энтероцитов, нарушений целостности эпителиоцитов и наличия воспалительного инфильтрата в собственной пластинке.
При СИБР отмечается снижение содержания и активности внутрипросветных и пристеночных ферментов за счет их разрушения бактериями, падения внутрикишечного уровня рН, снижения их концентрации в результате разведения кишечного содержимого, что сопровождается развитием мальдигестии, а при наличии структурных повреждений энтероцитов и мальабсорбции основных ингредиентов пищи. Одним из наиболее частых последствий является формирование дисахаридазной недостаточности вследствие повреждения щеточной каемки энтероцитов. В результате данные углеводы расщепляются ферментами бактерий до короткоцепочечных органических кислот, которые повышают осмолярность кишечного содержимого и снижают внутрипросветный уровень рН, что приводит к задержке жидкости в просвете кишки и развитию осмотической диареи, которая уменьшается или купируется после 24- или 48-часового голодания.
Наличие большого количества бактерий в проксимальных отделах тонкой кишки приводит к преждевременной бактериальной деконъюгации желчных кислот, с которой связано не только нарушение гидролиза и всасывания жира, но и стимуляция интестинальной секреции воды и электролитов, а также химические повреждения СО кишечника [2, 14]. В результате развивается секреторная диарея, которая не купируется после 24-часового голодания, и могут выявляться признаки воспаления и эрозии в СО ДПК и тонкой кишки. Значительно реже, как следствие мальабсорбции жиров, может возникать дефицит жирорастворимых витаминов (витамины А, D, Е, К). Утилизация бактериями пищевых белков, снижение уровня олигопептидаз с последующим нарушением образования и всасывания аминокислот, а также формирование катаболической энтеропатии в результате повреждения СО кишки лежат в основе мальабсорбции протеинов [12, 15].
Транслокация кишечных бактерий — явление, часто обнаруживаемое при СИБР. К факторам риска ее развития относятся присутствие условно-патогенных микроорганизмов и их токсинов; прием нестероидных противовоспалительных препаратов, глюкокортикостероидов, цитостатиков, нарушающих основные механизмы преэпителиальной защиты и снижающих иммунологическое звено защитного барьера; нарушение кровотока (абдоминальная ишемия, портальная гипертензия) и целостности слизистой оболочки кишечника и др. [7, 16]. Основными органами-мишенями, которые вовлекаются в патологический процесс при транслокации кишечных бактерий, являются лимфатические узлы (развитие мезаденитов и наличие лимфангиэктазий СО кишки, например, «симптом манной крупы» в СО ДПК); мочевыводящая система (возникновение бактериурии, острых и хронических пиелонефритов, мочекаменной болезни); печень и билиарная система (формирование неалкогольного стеатоза, стеатогепатита и даже цирроза печени, а также воспалительных процессов внепеченочного билиарного тракта). Большое значение придается циркуляции в крови и накоплению в тканях бактериальных токсинов, что вызывает активацию гуморальных иммунных реакций и формирование перекрестной иммунологической реактивности с развитием полиартралгий, реже — реактивных артритов, миалгий, аллергических дерматозов, пищевой псевдоаллергии.
Определенная роль в формировании клиники СИБР отводится развитию полигиповитаминозов и нарушению обмена макро- и микроэлементов. Так, у значительной части пациентов с наличием СИБР выявляется снижение в сыворотке крови уровня витамина В12, обусловленное преждевременным отщеплением его от внутреннего фактора и утилизацией анаэробными кишечными бактериями, и высокое содержание фолатов, связанное с повышенным бактериальным синтезом [12].
Для выявления СИБР используются микробиологические методы (посевы полостной и пристеночной микробиоты ДПК и тонкой кишки), водородный дыхательный тест с различными субстратами (глюкоза, лактулоза и др), определение аэробных и анаэробных бактерий и грибов и их метаболитов в различных биологических средах с использованием газовой хроматографии и масс-спектрометрии, полимеразная цепная реакция для выявления в крови бактериальных ДНК и РНК при транслокации кишечных бактерий [8]. Определенная роль в диагностике СИБР отводится положительному терапевтическому эффекту на прием антибиотиков [12].
Целью терапии СИБР является купирование клинических проявлений и связанных с ним метаболических расстройств. Лечебные мероприятия при СИБР включают: 1) воздействие на этиологические факторы развития СИБР; 2) в случае невозможности ликвидировать факторы риска формирования СИБР проведение курсов антибактериальной терапии; 3) восстановление нормальной моторики тонкой кишки; 4) нутритивная поддержка у пациентов с дефицитом массы тела и гиповитаминозами [16]. Несмотря на то, что ликвидация факторов риска развития СИБР кажется оптимальным направлением в ведении данных пациентов, практически лишь у незначительной части из них этого возможно достигнуть. Как правило, указанные выше факторы сохраняются пожизненно, что лежит в основе рецидивирования или персистенции симптомов и метаболических последствий СИБР.
Ведущая роль в терапии СИБР отводится антибиотикам, назначение которых преследует цель не стерилизации тонкой кишки, а модификации состава тонкокишечных бактерий, максимально приблизив его к норме. Антибактериальная терапия должна быть направлена на удаление грамнегативных и анаэробных бактерий. Подход к назначению антибактериальных средств в основном эмпирический, но в то же время необходимо учитывать, что при избыточном бактериальном росте в тонкой кишке и при транслокации бактерий за пределы кишечника приоритетными являются всасывающиеся, а при нарушении микробиоты толстой кишки — невсасывающиеся препараты. С этой целью используются несколько групп антибиотиков, которые представлены в табл. 2.
Продолжительность курса антибактериальной терапии составляет 7–10 дней. Повторные курсы терапии проводятся при рецидивировании симптомов СИБР со сменой препаратов в очередном курсе [12].
Что касается пробиотиков и пребиотиков, то назначение их при толстокишечном дисбиозе является, несомненно, обоснованным, в то же время при СИБР — спорным. Вероятнее всего, любое увеличение бактериальной нагрузки в тонкой кишке является нежелательным у пациентов с наличием факторов риска развития СИБР, не говоря о больных с уже имеющимся СИБР. Проведенные исследования эффективности терапии пробиотиками при СИБР не выявили положительных результатов — как ближайших, так и отдаленных [17]. Одновременно с антибактериальной терапией необходимо парентеральное введение витаминов для коррекции их дефицита, а также проведение лечебных мероприятий, для купирования электролитных нарушений.
Прокинетические средства, назначение которых препятствует избыточному бактериальному росту в тонкой кишке, являются важным дополнением к антибиотикотерапии СИБР. Исследования, проводимые на животных, подтвердили, что прокинетики, в частности цизаприд, снижают избыточный рост бактерий в тонкой кишке [18], однако в связи с токсичностью данный препарат в настоящее время не используется. В то же время у значительной части пациентов с СИБР моторные нарушения носят разнонаправленный характер. При этом наблюдается значительное многообразие сочетаний гипер- и гипокинетических дискинезий в различных отделах пищеварительного тракта, что создает значительные трудности в выборе адекватной терапии, когда для нормализации моторных нарушений в одной зоне требуется спазмолитик, а в другой — прокинетик. Наиболее частыми сочетанными нарушениями при СИБР являются гипомоторная дискинезия двенадцатиперстной и тонкой кишки со спазмом сфинктера Одди и/или спастической дискинезией толстой кишки. Для купирования сочетанных моторных нарушений и связанного с ними болевого синдрома перспективным является использование препаратов, способных нормализовать моторику, независимо от ее исходного состояния, а также влияющих на висцеральную чувствительность ЖКТ и участвующих в антиноцецептивных механизмах контроля боли. В данной ситуации особое место принадлежит тримебутину (Тримедату), обладающему уникальными фармакологическими свойствами. Тримебутин, являясь агонистом периферических µ-, δ- и κ-опиоидных рецепторов, расположенных на гладкомышечных клетках и ганглиях энтеральной нервной системы (ЭНС), в зависимости от исходной функциональной активности миоцитов оказывает спазмолитическое или прокинетическое действие, а также восстанавливает функциональную активность интерстициальных клеток Каяла, которые выполняют функцию водителя собственного, автономного физиологического ритма гладкомышечных волокон ЖКТ. Так, при гиперкинетических состояниях препарат связывается с κ-рецепторами, блокирует возбуждающие импульсы нейронов ЭНС и угнетает моторику ЖКТ. При гипокинетических нарушениях тримебутин имеет тропность к µ- и δ-рецепторам, что приводит к блокаде тормозных стимулов из нейронов ЭНС и, как следствие, стимуляции моторики органов пищеварения [19]. В терапии СИБР показано курсовое назначение тримебутина по 200 мг 3 раза в день не менее 30 дней.
С практических позиций наиболее целесообразной является представленная ниже схема ведения пациентов с СИБР, которая согласуется со стандартами, предложенными рядом других авторов [12, 16, 20, 21].
Примерная схема ведения пациентов с СИБР:
Таким образом, при ведении пациентов с наличием СИБР следует учитывать, что воздействие на этиологический фактор у многих пациентов остается невыполнимой задачей. Большинство предрасполагающих состояний являются труднообратимыми, а чаще совсем необратимыми. Поэтому, как и при других хронических состояниях, лечение СИБР должно быть многофакторным и, как правило, длительным, сконцентрированным, в первую очередь, на эрадикации бактерий, нормализации моторики кишечника и коррекции проявлений мальнутриции.
Литература
* ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
** ФГБУ КБ УД Президента РФ, Москва
Дисбактериоз кишечника
Описание
Симптомы
Формы
Выделяют следующие клинические формы патологии:
Причины
Экзогенные (внешние) факторы: дефицит ряда важнейших нутриентов (белков, углеводов, витаминов, растительной клетчатки), нефизиологичные формы питания, стресс (травма, ожоговая болезнь, оперативные вмешательства), лекарственные воздействия (антибиотики, гормоны, цитостатики), влияние радиации.
Эндогенные (внутренние) факторы: функциональные или воспалительные заболевания органов пищеварения (секреторные, моторные, воспалительные нарушения ЖКТ), онкологические заболевания, острые и хронические инфекции ЖКТ, урогенитальные инфекции, инфекционно-аллергические заболевания, иммунодефицитные состояния.
Методы диагностики
Диагноз дисбактериоза кишечника основывается на данных анамнеза, результатах клинического обследования пациента и микробиологического исследования кала.
При наличии дисбактериоза у детей необходимо выяснить: наличие вагинальный дисбактериоз и мастита у матерей, позднее прикладывание к груди, ранний переход на искусственное вскармливание, перенесенные кишечные инфекции, диспепсические нарушения, наличие аллергических реакций, рахита, гипотрофии.
При наличии дисбактериоза у взрослых необходимо выяснить наличие: хронических заболеваний желудочно-кишечного тракта (холецистита, панкреатита, язвенной болезни желудка, колита), заболеваний эндокринной системы, онкологических заболеваний, иммунодефицитных состояний, гипо- или авитаминоза, антибиотикотерапии, приема гормональных препаратов, химиотерапии (приема цитостатиков), изменения ритма и структуры питания, наличие частых стрессов.
Решающее значение в диагностике дисбактериоза принадлежит микробиологическому исследованию кала, которое заключается в качественном и количественном подсчете нормальной и условно-патогенной флоры кишечника. Микробиологическими критериями диагноза являются:
Микробиологическое исследование кала проводят повторно через 14 дней после окончания терапии с целью оценки динамики показателей микробиоценоза кишечника и определения чувствительности к фагам и антибиотикам условно-патогенных микроорганизмов.
Дифференциальную диагностику чаще проводят с острыми кишечными инфекциями – сальмонеллез, иерсиниоз, инфицирование энтеропатогенными кишечными палочками, стафилококковая и другие пищевые токсикоинфекции (энтерококки, протей, клебсиелла).
Основные используемые инструментальные исследования:
Дополнительные используемые лабораторные исследования:
Лечение
Лечение дисбактериоза кишечника назначает гастроэнтеролог или врач-инфекционист. В первую очередь устраняют основную причину, вызвавшую дисбактериоз: инфекционное заболевание, отравление, прием антибиотиков. После устранения этой причины проводится компенсация дефицита компонентов микрофлоры бактериологическими препаратами: лактобактерин, бифидумбактерин, бификол, линекс, энтерол и т.д. Помимо самих бактериологических культур, назначают препараты, представляющие собой метаболиты облигатных бактерий (Хилак – форте), при помощи которой создается благоприятная среда для размножения нормальной флоры. Для подавления размножения грибов назначают антигрибковые препараты, если же преобладает стафилококковая флора, то назначают антибактериальные препараты: палин, метронидазол (трихопол), бисептол-480, невиграмон. Для восстановления нормального пищеварения назначаются ферментные препараты: креон, панзинорм и др. Кроме того необходимо восстановить реактивную функцию организма, с этой целью назначаются иммуностимуляторы и витамины.
Осложнения
Возможны аллергические проявления, анемия, гиповитаминозы, неврологические нарушения, энтероколит, интоксикация.
Профилактика
С целью профилактики дисбактериоза рекомендуется обязательно включать в рацион питания кисломолочные продукты, как можно больше овощей и фруктов. Очень полезно соблюдать режим питания – есть в одно и то же время. Желательно полное исключение алкоголя и курения, а также ограничение газированных напитков. Антибиотики должны назначаться только по строгим показаниям. Обязательно – совместно с противогрибковыми препаратами.
Какие вопросы следует задать врачу
С чем связана имеющаяся симптоматика?
Нужно ли вносить изменения в рацион питания, если «да», то какие?
Нужен ли прием препаратов и каких?
Советы пациенту
При наличии дисбактериоза нужно сократить употребление жирной пищи и продуктов с высоким содержанием клетчатки, таких как орехи, семена и кукуруза. Если есть предположение, что какой-либо еще продукт провоцирует симптоматику, нужно исключить и его из рациона питания на несколько дней и оценить динамику клинических проявлений. Следует избегать употребления в пищу любых напитков и продуктов, при употреблении которых отмечено ухудшение симптоматики.
Питаться следует небольшими порциями. Нужно употреблять в пищу больше кисломолочных продуктов. Но люди с непереносимостью лактозы должны исключить молочные продукты из своего рациона.









_575.gif)
.gif)
.gif)

