Аденокарцинома толстого кишечника код мкб 10
Аденокарцинома толстого кишечника код мкб 10
С15-C26 Злокачественные новообразования органов пищеварения. V. 2016
Международная классификация болезней 10-го пересмотра (МКБ-10)
C15-C26 Злокачественные новообразования органов пищеварения
C15 Злокачественное новообразование пищевода
предлагаются две альтернативные субклассификации:
.0-.2 по анатомическому описанию
.3-.5 по третям органа
Эти отклонения от принципа, согласно которому рубрики должны быть взаимоисключающими, является преднамеренным, поскольку употребляются обе терминологические формы, однако выделенные анатомические области не являются сходными
Использовать дополнительный код (U85), если необходимо отметить резистентность, отсутствие реакции и изменение свойств опухоли при применении противоопухолевых препаратов.
C15.0 Шейного отдела пищевода
C15.1 Грудного отдела пищевода
C15.2 Абдоминального отдела пищевода
C15.3 Верхней трети пищевода
C15.4 Средней трети пищевода
C15.5 Нижней трети пищевода
C15.8 Поражение пищевода, выходящее за пределы одной и более вышеуказанных локализаций
C15.9 Злокачественное новообразование пищевода неуточненное
C16 Злокачественное новообразование желудка
C16.0 Кардии желудка
Кардиального отверстия
Кардиально-пищеводного соединения
Гастропищеводного соединения
Пищевода и желудка
C16.1 Дна желудка
C16.2 Тела желудка
C16.3 Преддверия привратника
Малой кривизны желудка, не классифицированное в подрубриках С16.1-С16.4
Большой кривизны желудка, не класифицированное в подрубриках С16.0-С16.4
C17 Злокачественное новообразование тоной кишки
C17.0 Двенадцатиперстной кишки
C17.1 Тощей кишки
C17.2 Подвздошной кишки
Исключено: илеоцекального клапана (C18.0)
C17.3 Дивертикула Меккеля
C17.8 Тонкой кишки, выходящее за пределы одной и более вышеуказанных локализаций
C17.9 Тонкой кишки неуточненной локализации
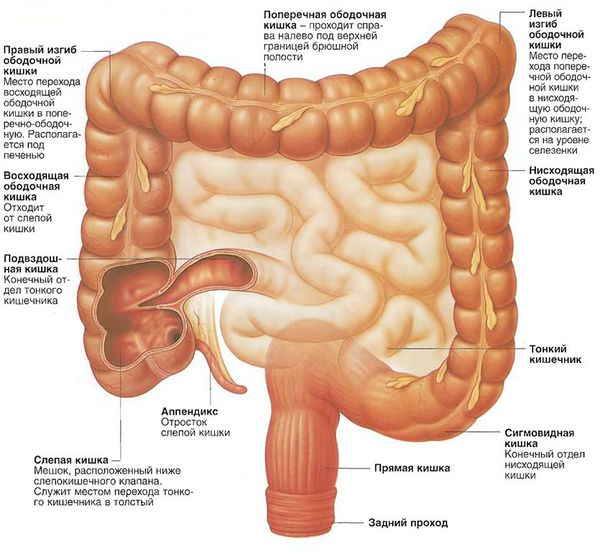
C18 Злокачественное новообразование толстой кишки
C18.0 Слепой кишки
C18.1 Червеобразного отростка
C18.2 Восходящей ободочной кишки
C18.3 Печёночного изгиба ободочной кишки
C18.4 Поперечной ободочной кишки
C18.5 Слезёночного изгиба ободочной кишки
C18.6 Нисходящей ободочной кишки
C18.7 Сигмовидной кишки
Исключено: ректосигмоидного соединения (С19)
C18.8 Поражение толстой кишки, выходящее за пределы одной и более вышеуказанных локализаций
C18.9 Толстой кишки неуточненной локализации
C19 Злокачественное новообразование ректосигмоидного соединения
Включено:
Толстой и прямой кишки
Ректосигмоидного отдела (толстой кишки)
C20 Злокачественное новообразование прямой кишки
Включено: ампулы прямой кишки
C21 Злокачественное новообразование заднего прохода [ануса] и анального канала
C21.0 Злокачественное новообразование заднего прохода неуточненной локализации
Исключено:
C21.2 Злокачественное новообразование клоакогенной зоны
C21.8 Поражение прямой кишки, заднего прохода [ануса] и анального канала, выходящее за пределы одной и более вышеуказанных локализаций
[см. Примечание 5 к описанию Класса II]
Аноректального соединения
Аноректальной области
Злокачественное новообразование прямой кишки, заднего прохода [ануса] и анального канала, которое по месту возникновения не может быть отнесено ни к одной из рубрик С20-С21.2
C22 Злокачественное новообразование печени и внутрипечёночных желчных протоков
желчных путей БДУ (C24.9)
вторичное злокачественное новообразование печени (C78.7)
C22.3 Ангиосаркома печени
C22.4 Другие саркомы печени
C22.7 Другие уточненные раки печени
C22.9 Злокачественное новообразование печени неуточненное
C23 Злокачественное новообразование желчного пузыря
C24 Злокачественное новообразование других и неуточненных частей желчевыводящих путей
Исключено: внутрипечёночного желчного протока (C22.1)
Желчного протока или прохода БДУ
Общего желчного протока
Пузырного протока
Печёночного протока
C24.1 Ампулы фатерова сосочка
C24.8 Поражение желчных путей, выходящее за пределы одной и более вышеуказанных локализаций
[см. Примечание 5 к описанию Класса II]
Злокачественное новообразование, захватывающее внутрипеченочные и внепеченочные желчные протоки
Злокачественное новообразование желчных путей, которое по месту возникновения не может быть отнесено ни к одной из рубрик С22.0-С24.1
C24.9 Желчных путей неуточненное
C25 Злокачественное новообразование поджелудочной железы
C25.0 Головки поджелудочной железы
C25.1 Тела поджелудочной железы
C25.2 Хвоста поджелудочной железы
C25.3 Протока поджелудочной железы
C25.4 Островковых клеток поджелудочной железы
C25.9 Поджелудочной железы неуточненное
C26 Злокачественное новообразование других и неточно обозначенных органов пищеварения
Исключено: брюшины и забрюшинного пространства (C48.-)
C26.0 Кишечного тракта неуточненной части
фолликулярная лимфома (C82.-)
болезнь Ходжкина (C81.-)
периферическая NK/T-клеточная лимфома (C84.-)
нефолликулярная [диффузная неходжкинская] лимфома (C83.-)
неходжкинская лимфома, другого и неуточнённого типов (C85.-)
[см. Примечание 5 к описанию Класса II]
Злокачественное новообразование органов пищеварения, которое по месту возникновения не может быть отнесено ни к одной из рубрик С15-С26.1
Исключено: кардиально-пищеводного соединения (C16.0)
C26.9 Неточно обозначенные локализации в пределах пищеварительной системы
Пищеварительного канала или тракта БДУ
Желудочно-кишечного тракта БДУ
Примечания. 1. Данная версия соответствует версии 2016 года ВОЗ (ICD-10 Version:2016), некоторые позиции которой могут отличаться от утверждённой Минздравом России версии МКБ-10.
2. БДУ — без дополнительных уточнений.
4. Звёздочкой помечены факультативные дополнительные коды, относящиеся к проявлению болезни в отдельном органе или области тела, представляющей собой самостоятельную клиническую проблему.
5. Класс II «Новообразования» содержит следующие блоки:
Что такое аденокарцинома кишки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Мешечкиной Виктории Геннадьевны, онколога со стажем в 9 лет.
Определение болезни. Причины заболевания
Аденокарцинома толстой кишки — это самая распространённая форма рака прямой кишки, опухоль развивается в толстой кишке и может метастазировать, как и большинство злокачественных новообразований.
Распространённость аденокарциномы толстой кишки
Факторы риска
Основной фактор риска аденокарциномы толстой кишки — возраст старше 65 лет. Риск развития аденокарциномы толстой кишки также возрастает при наличии некоторых наследственных синдромов:
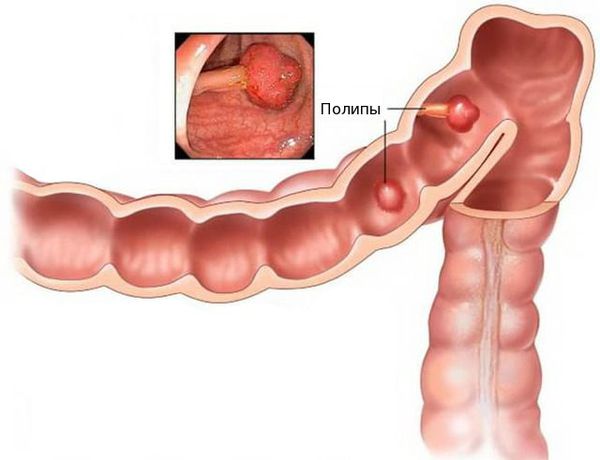
Благоприятным фоном для злокачественного перерождения клеток являются единичные или множественные полипы толстой кишки. Высокий риск перерождения в раковую опухоль имеют аденоматозные полипы. Отказ от их удаления может привести к развитию аденокарциномы.
Хронические воспалительные заболевания толстой кишки, такие как неспецифический язвенный колит и болезнь Крона, также повышают риск развития аденокарциномы.
К дополнительным факторам риска относят:
Симптомы аденокарциномы кишки
Клинические проявления аденокарциномы толстой кишки зависят от расположения опухоли, её типа, темпа роста и наличия сопутствующей патологии. Ранние формы рака являются случайной находкой, так как могут никак себя не проявлять. Их выявляют при эндоскопическом исследовании кишечника по поводу других заболеваний (например, колита, дивертикулита, холецистита, гастрита и др.) или при полостных или гинекологических операциях — аппендэктомии, миомэктомии и кесаревом сечении.
Наиболее частые симптомы аденокарциномы толстой кишки:
Опухоли левого фланка (сигмовидной и прямой кишки, селезёночного угла, нисходящего отдела) чаще манифестируют с запоров, примеси прозрачной или розоватой слизи и тёмной крови в кале, болезненных позывов, отдающих в промежность.
Поиск причины анемии невыясненной этиологии часто приводит к обнаружению рака правой половины толстой кишки.
Патогенез аденокарциномы кишки
Аденокарцинома — это злокачественная опухоль, возникающая из железистых клеток и способная образовывать метастазы (вторичные очаги опухолевого роста). Чаще всего заболевание развивается на фоне длительно существующих полипов, или разрастаний слизистой.
При хроническом повреждении полипов плотными каловыми массами и воспалении развивается дисплазия эпителия (нарушение деления и дифференцировки клеток), переходящая в рак. У кого-то этот процесс может занять десятки лет, у других развивается за два-три года.
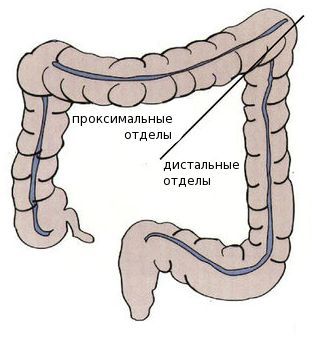
Среди пациентов с раком проксимальных отделов толстой кишки преобладают женщины — вероятно, это связано с наличием гормональных рецепторов эстрогенов в этих отделах. Дистальный рак толстой кишки более характерен для мужчин.
Классификация и стадии развития аденокарциномы кишки
Виды аденокарциномы толстой кишки в зависимости от локализации:
Согласно последней классификации ВОЗ, гистологически выделяют две степени злокачественности аденокарциномы толстой кишки, опираясь на долю железистых структур в составе опухоли: высокую и низкую.
Стадирование новообразований толстой кишки по системе TNM-8 (2017 г.) представлено схемой:
Исходя из этих данных, опухоли присваивают определенную стадию, и далее она уже не меняется. Дальнейшее распространение процесса обозначается как прогрессирование.
Осложнения аденокарциномы кишки
Также среди частых причин осложнений выделяют перфорацию и кровотечение из повреждённой опухоли. Это может явиться первым симптомом заболевания. Часто таких пациентов экстренно оперируют в условиях многопрофильного стационара, а не специализированного учреждения, и только при обследовании органов брюшной полости становится понятна причина перфорации.
Диагностика аденокарциномы кишки
Сбор анамнеза
Помимо описанных выше жалоб, с которыми первично обращаются пациенты, важны данные анамнеза. На первичном осмотре терапевту или онкологу следует отметить наличие наследственных синдромов, ассоциированных с раком толстой кишки, и хронических неспецифических воспалительных процессов толстой кишки, например неспецифического язвенного колита или болезни Крона.
Физикальное обследование
При физикальном обследовании, помимо общего осмотра и пальпации брюшной полости, обязательно проведение ректального пальцевого исследования, выявляющего изменения в области прямой кишки. Это один из самых простых диагностических приёмов, не требующий дополнительной подготовки и оборудования.
Лабораторная диагностика
Лабораторная диагностика включает:
Это анализы необходимы для исключения возможной сопутствующей патологии.
Биопсия
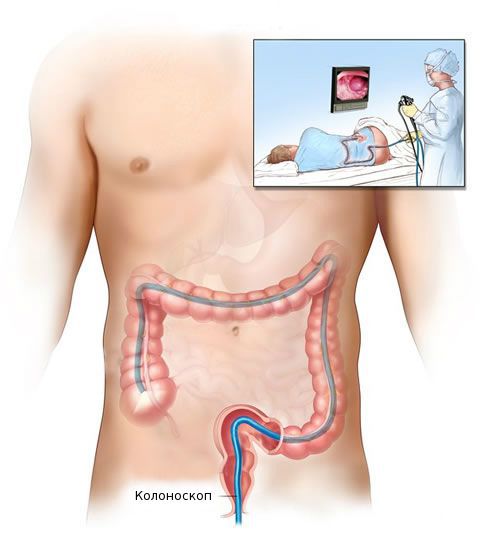
После общеклинического обследования проводят уточняющее исследование (биопсию) для определения гистологической структуры опухоли. Чаще всего биопсия выполняется во время колоноскопии — процедуры, при которой врач с помощи эндоскопа осматривает внутреннюю поверхность толстой кишки.
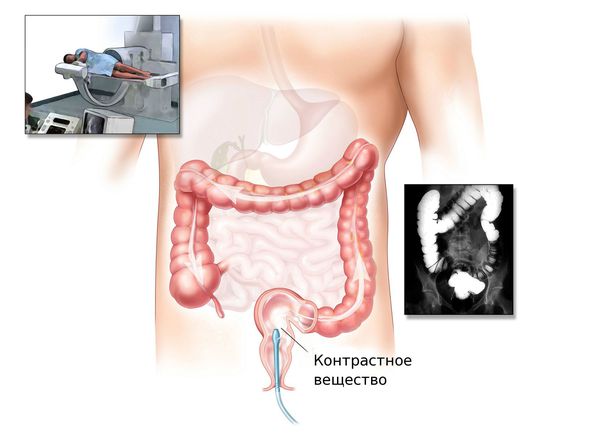
Ирригоскопия и КТ-колонография
При невозможности проведения колоноскопии врач может назначить ирригоскопию или КТ-колонографию.
Ирригоскопия — это рентгенологический метод обследования толстого кишечника с помощью контрастного вещества, вводимого через прямую кишку.
КТ-колонография — разновидность компьютерной томографии, проводимая при помощи компьютерного томографа.
Компьютерная томография (КТ)
КТ органов грудной клетки и брюшной полости с контрастом — стандарт обследования при раке ободочной кишки. Компьютерную томографию проводят для исключения метастазов в лёгких, лимфоузлах средостения, брюшной полости, канцероматоза (переноса раковых клеток из первичного очага), асцита (скопления жидкости в брюшной полости) и вторичного поражения печени.
Магнитно-резонансная томография (МРТ)
МРТ органов брюшной полости с внутривенным контрастированием применяют для планирования операции на печени при её вторичном поражении.
Для точной оценки размеров опухоли перед операцией и правильного стадирования по TNM проводится МРТ малого таза c применением контраста.
Дополнительно, при наличии болевого синдрома или изменений по КТ, проводится остеосцинтиграфия (ОСГ) — исследование состояния костей скелета.
При подозрении на вторичное поражение головного мозга (исходя из жалоб, осмотра и анамнеза) назначается МРТ головного мозга с внутривенным контрастированием.
Позитронно-эмиссионная томография, совмещённая с компьютерной томографией (ПЭТ/КТ)
ПЭТ-КТ не применяется как рутинный метод при первичной диагностике. Обследование проводят при подозрении на вторичные изменения по данным КТ или МРТ для получения дополнительных данных.
Лечение аденокарциномы кишки
Выбор метода лечения аденокарциномы толстой кишки обусловлен стадией онкологического процесса и наличием или отсутствием соматической патологии.
0-I стадия
На ранних стадиях рака ободочной кишки проводятся органосохраняющие операции, например эндоскопическую резекцию слизистой с удалением в подслизистом слое. При поражении краёв резекции, сосудистой, лимфатической или периневральной инвазии (проникновении раковых клеток в периневрий — слои соединительной ткани, образующие оболочку вокруг пучков нервных волокон), как факторах неблагоприятного прогноза, рекомендуется проведение расширенной операции — повторной резекции краёв.
II–III стадия
При резектабельном (c возможностью удаления) локализованном и местнораспространённом раке ободочной кишки II–III стадий на первом этапе предпочтительно оперативное лечение. Объём хирургического вмешательства определяется индивидуально.
Химиотерапия проводится при поражении лимфатических узлов, прорастании опухолью серозной оболочки и соседних органов, наличии факторов риска.
При распространённом раке ободочной кишки с резектабельными или потенциально резектабельными синхронными метастазами в печени или лёгких выполняют R0-резекцию (в пределах здоровых тканей).
Радиочастотная абляция и стереотаксическая лучевая терапия применяются как дополнительные методы к резекции печени и как самостоятельные методы лечения. Действие радиочастотной абляции основано на нагревании с помощью радиоволн поражённых тканей до высоких температур (90–100 °С).
Стереотаксическая лучевая терапия — это один из видов радиохирургии, который состоит в применении высокоточного излучения, воздействующего на опухоли.
При резектабельных очагах рекомендуется их одномоментное хирургическое удаление.
На послеоперационном этапе при резектабельных метастатических очагах показано проведение адъювантной (следующей за операцией) химиотерапии. Также возможно проведение дооперационной химиотерапии до шести циклов, удаление метастазов и первичной опухоли с дальнейшим продолжением химиотерапии до достижения шестимесячной суммарной продолжительности лечения.
IV стадия
Основная цель лечения на IV стадии заболевания — перевод при помощи химиотерапии нерезектабельных метастазов в резектабельные. Хороший эффект даёт добавление к основному лечению таргетной терапии ( целенаправленно воздействующей на специфические мишени в опухолевых клетках) и иммунотерапии.
При проведении нерадикальной резекции возможно продолжение терапии предоперационной комбинацией химиопрепаратов и моноклональных антител (препаратов, избирательно воздействующих на определённую молекулу, от которой зависит развитие болезни ) до достижения суммарной шестимесячной продолжительности лечения.
При генерализованном раке ободочной кишки с нерезектабельными метастазами применяют комбинацию химиопрепаратов. Возможно добавление таргетных препаратов. Цель лечения — максимально долго контролировать развитие заболевания при сохранении качества жизни.
При проведении химиотерапии каждые 1,5-2 месяца оценивают резектабельность опухоли (по данным КТ, МРТ). При преобладании метастатического поражения печени проводят:
Прогноз. Профилактика
Меры профилактики:
Аденокарцинома толстой кишки
Аденокарцинома толстой кишки – это злокачественное новообразование, развивающееся из клеток железистого эпителия. На ранних стадиях протекает со стертой клинической симптоматикой. При прогрессировании наблюдаются слабость, боли в животе, ощущение неполного опорожнение кишечника, нарушения стула, тенезмы, отсутствие аппетита, снижение веса, повышение температуры до субфебрильных цифр, слизь и кровь в кале. Возможна кишечная непроходимость. Диагноз устанавливают на основании жалоб, данных объективного осмотра и результатов инструментальных исследований. Лечение – хирургическое удаление опухоли.
МКБ-10
Общие сведения
Аденокарцинома толстой кишки – рак, развивающийся из эпителиальных клеток. Составляет около 80% от общего количества злокачественных опухолей толстого кишечника. В 40% случаев поражает слепую кишку. Занимает четвертое место по распространенности среди онкологических заболеваний у женщин и третье – у мужчин, уступая только раку желудка, легкого и молочной железы. Чаще возникает в возрасте после 50 лет.
Вероятность возникновения аденокарциномы увеличивается при различных состояниях и заболеваниях, сопровождающихся нарушением перистальтики и ухудшением кровоснабжения толстого кишечника. На начальных стадиях болезнь обычно протекает бессимптомно или с неярко выраженной неспецифической клинической симптоматикой, что затрудняет диагностику и снижает процент выживаемости. Лечение осуществляют специалисты в области онкологии.
Причины
Предполагают, что аденокарцинома толстой кишки развивается в результате сочетания нескольких неблагоприятных факторов, основными из которых являются соматические заболевания, особенности диеты, некоторые параметры внешней среды и неблагоприятная наследственность. Повышенная вероятность возникновения злокачественных опухолей отмечается при полипах толстой кишки. В число соматических заболеваний, провоцирующих аденокарциному, включают язвенный колит, болезнь Крона, а также патологии, сопровождающиеся хроническими запорами и отложением каловых камней.
Многие исследователи указывают на важность диетических факторов. Вероятность возникновения аденокарциномы толстой кишки возрастает при недостатке в пище растительной клетчатки и употреблении большого количества мясных продуктов. Ученые считают, что растительная клетчатка увеличивает объем каловых масс и ускоряет их продвижение по кишечнику, ограничивая контакт кишечной стенки с канцерогенами, образующимися при расщеплении жирных кислот. Эта теория очень близка к теории развития аденокарциномы под влиянием канцерогенов, появляющихся в пище при неправильной термической обработке продуктов.
К факторам внешней среды относят слишком активное использование средств бытовой химии, профессиональные вредности, сидячую работу и малоподвижный образ жизни. Аденокарцинома толстой кишки нередко возникает при наследственно обусловленном семейном раковом синдроме (после 50 лет заболевает каждый третий носитель гена), при наличии злокачественных новообразований у близких родственников и при некоторых неонкологических наследственных заболеваниях (например, синдроме Гарднера).
Патогенез
Опухоль развивается по общим законам роста и распространения злокачественных новообразований. Для нее характерны тканевый и клеточный атипизм, снижение уровня дифференцировки клеток, прогрессия, неограниченный рост и относительная автономность. Вместе с тем, аденокарцинома толстой кишки имеет свои особенности. Она растет и развивается не так быстро, как некоторые другие злокачественные опухоли, и долго остается в пределах кишки.
Развитие новообразования часто сопровождается воспалением, распространяющимся на расположенные рядом органы и ткани. Раковые клетки проникают в эти органы и ткани, образуя близлежащие метастазы, при этом отдаленное метастазирование может отсутствовать. Неоплазия чаще всего метастазирует в печень и лимфатические узлы, хотя возможна и другая локализация отдаленных метастазов. Еще одной особенностью заболевания является частое одновременное либо последовательное образование нескольких опухолей в толстом кишечнике.
Классификация
С учетом уровня дифференцировки клеток различают три вида аденокарциномы толстой кишки: высокодифференцированная, умеренно дифференцированная и низкодифференцированная. Чем ниже уровень дифференцировки клеток – тем агрессивнее рост опухоли и тем выше склонность к раннему метастазированию. Для оценки прогноза при аденокарциноме толстой кишки врачи-онкологи используют международную классификацию TNM и традиционную российскую четырехстадийную классификацию. Согласно российской классификации:
Симптомы аденокарциномы
На ранних стадиях аденокарцинома толстой кишки протекает малосимптомно. Поскольку патология часто развивается на фоне хронических заболеваний кишечника, больные могут трактовать симптомы, как очередное обострение. Возможны нарушения стула, общая слабость, периодические боли в животе, ухудшение аппетита, появление примесей слизи или крови в каловых массах. При поражении нижних отделов толстого кишечника кровь алая, находится преимущественно на поверхности фекальных масс.
При расположении аденокарциномы в левой половине кишечника кровь темная, смешанная со слизью и каловыми массами. При локализации новообразования в правой половине кишечника кровотечения нередко носят скрытый характер. По мере роста опухоли симптомы становятся более яркими. Пациентов с аденокарциномой толстой кишки беспокоят интенсивные боли. Развивается выраженная утомляемость. Наблюдаются анемия, повышение температуры до субфебрильных цифр и отвращение к мясной пище.
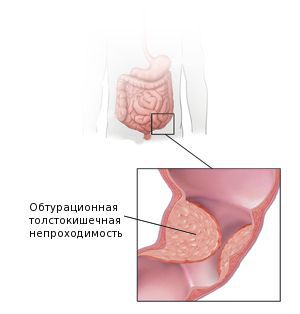
Поносы и запоры становятся постоянными, не проходят при использовании лекарственных препаратов. Аденокарцинома толстой кишки создает механическое препятствие движению каловых масс и вызывает частые тенезмы. Давление кала на опухоль становится причиной ее изъязвления, а образование язв приводит к учащению кровотечений и развитию воспаления. В кале появляется гной. Температура поднимается до фебрильных цифр. Обнаруживаются признаки общей интоксикации.
У многих больных наблюдаются желтушность кожи и иктеричность склер. При распространении воспалительного процесса на забрюшинную клетчатку возникают боли и напряжение мышц в поясничной области. Возможна кишечная непроходимость (особенно – при аденокарциномах с экзофитным ростом). На поздних стадиях выявляются асцит и увеличение печени. Иногда абдоминальные симптомы отсутствуют, опухоль долго проявляется только слабостью, повышенной утомляемостью, снижением веса и ухудшением аппетита.
Диагностика
Диагноз аденокарциномы толстой кишки устанавливают специалисты в сфере клинической онкологии на основании жалоб, анамнеза, данных общего осмотра и пальцевого исследования прямой кишки и результатов инструментальных исследований. Более половины опухолей располагаются в нижних отделах толстого кишечника и выявляются при проведении пальцевого исследования или ректороманоскопии. При высокой локализации новообразования необходима колоноскопия. В процессе эндоскопии врач берет образец опухолевой ткани для последующего гистологического исследования, позволяющего верифицировать опухоль.
Для оценки размеров, формы и распространенности аденокарциномы используют рентгенконтрастное исследование толстого кишечника (ирригоскопию). Для выявления метастазов и при наличии противопоказаний к проведению эндоскопических исследований, например, при кровотечении, применяют ультразвуковые методики. В сложных случаях больного с подозрением на аденокарциному толстой кишки направляют на МСКТ брюшной полости. Пациенту назначают общие анализы крови и мочи, биохимический анализ крови и анализ кала на скрытую кровь. Окончательный диагноз выставляют после изучения биоптата.
Лечение аденокарциномы толстой кишки
Лечение неоплазии оперативное. Важным элементом лечения является предоперационная подготовка, позволяющая обеспечить возможность восстановления непрерывности толстого кишечника и минимизировать количество осложнений. Пациенту назначают бесшлаковую диету и слабительные средства. За несколько дней до операции начинают выполнять очистительные клизмы. В последние годы часто применяют промывание ЖКТ с использованием специальных препаратов.
Объем радикального хирургического вмешательства при аденокарциноме определяют с учетом размера и расположения злокачественного новообразования, наличия или отсутствия регионарных метастазов:
При отдаленных метастазах также проводят паллиативные хирургические вмешательства для профилактики осложнений (кровотечения, кишечной непроходимости, интенсивного болевого синдрома).
Прогноз и профилактика
При выявлении аденокарциномы толстой кишки на 1 стадии пятилетняя выживаемость составляет около 90%. Если лечение начинают на 2 стадии, пятилетний порог выживаемости преодолевают 80% больных. На 3 стадии выживаемость снижается до 50-60%. При поражении прямой кишки прогноз ухудшается.
После операции больных помещают под наблюдение, рекомендуют регулярно осматривать кал на наличие крови и слизи. Ежеквартально проводят ректороманоскопию или колоноскопию. Раз в 6 месяцев пациентов направляют на УЗИ внутренних органов для выявления отдаленных метастазов. Около 85% рецидивов аденокарциномы толстой кишки возникают в первые два года после оперативного вмешательства.
Аденокарцинома прямой кишки
Рак прямой кишки имеет код по МКБ 10 – С18. Одной из разновидностей рака прямой кишки является аденокарцинома. Опухоль развивается из эпителиальных клеток и располагается в конечной части пищеварительного тракта. Чаще всего данное заболевание диагностируют у людей старшей возрастной группы. Точные причины рака прямой кишки не установлены. Риск развития патологии значительно увеличивается после достижения пятидесятилетнего возраста.
Преимуществами лечения пациентов по поводу злокачественной опухоли прямой кишки в Юсуповской больнице, являются:
Комфорт палат клиники онкологии соответствует европейскому уровню. Пациенты обеспечены индивидуальными средствами личной гигиены и диетическим питанием. Все сложные случаи рака обсуждаются на заседании Экспертного Совета, в работе которого принимают участие профессора и врачи высшей категории. Ведущие онкологи Москвы составляют индивидуальную схему лечения каждому пациенту, страдающему ректальным раком. Если у пациента выявлен рак прямой кишки 4 степени с метастазами, ему обеспечивают паллиативную медицинскую помощь.
Симптомы аденокарциномы и саркомы прямой кишки
Наиболее часто пациенты, страдающие злокачественной опухолью прямой кишки, предъявляют следующие жалобы:
Пациентов, страдающих карциномой прямой кишки, беспокоит общая слабость. Отмечается бледность кожных покровов.
Саркома прямой кишки встречается приблизительно в1 % случаев ректального рака. Они могут исходить из соединительнотканных элементов, лимфатической ткани, эндотелия кровеносных сосудов. Исходя из различных элементов стенки кишки и располагаясь под эпителиальным покровом, саркома в начальном периоде роста представляет собой различной величины узлы, покрытые неповреждённой слизистой оболочкой. При пальпации они безболезненны, при давлении – не спадаются.
Располагаясь в толще стенки прямой кишки, простые саркомы в течение длительного времени не причиняют больным неудобств. Симптомы сарком прямой кишки зависят от локализации, формы роста и гистологического строения опухоли. Основными симптомы сарком являются:
Это признаки, которые характеризуют рак прямой кишки.
Диагностика аденокарциномы прямой кишки
Как определить рак прямой кишки? Диагноз рак прямой кишки в Юсуповской больнице устанавливают на основании результатов комплексного обследования пациентов, страдающих ректальными злокачественными новообразованиями. В случае аденокарциномы прямой кишки лечение начинается с подробной диагностики. В зависимости от особенностей клинической картины у каждого пациента используется набор тех или иных диагностических методик:
Компьютерную, магнитно-резонансную, позитронно-эмиссионную компьютерную томографию, сцинтиграфию используют для уточнения особенностей строения и расположения опухоли относительно других органов и тканей, выявления признаков метастазирования рака. Онкомаркеры рака кишечника и прямой кишки позволяют заподозрить злокачественное новообразование до появления первых симптомов рака.
Как выглядит рак прямой кишки
Врачи Юсуповской больницы производят забор материала из опухоли прямой кишки во время эндоскопического обследования или операции и отправляют его в гистологическую лабораторию. Лаборанты по тому, как выглядит рак прямой кишки, определяют гистологический тип опухоли.
Аденокарцинома прямой кишки состоит из атипичных клеток, которые происходят из железистой эпителиальной ткани и сформированы в тубулярные, папиллярные и иные структуры. Клеточная структура может обладать различной степенью дифференцировки: высокодифференцированные новообразования обладают цитологическими признаками материнской эпителиальной ткани, а малодифференцированные аденокарциномы лишь отдалённо напоминают исходный материал. Они отличаются высокой агрессивностью, быстрее растут и распространяются.
Слизистая аденокарцинома представляет собой группы клеток, которые окружены слизью. Опухоли слизистого типа могут быть низкодифференцированными и высокодифференцированными. Слизь скапливается в структурах опухоли в виде «озёр» различной величины
Перстневидноклеточный рак получил своё название благодаря форме клеток, которые ввиду переизбытка в них слизи и смещению ядер к мембранам приобретают вид перстня. Слизистое вещество, занимающее пространство клеток, представляет собою специфический белок муцин. Перстневидноклеточные опухоли прямой кишки довольно агрессивны.
Плоскоклеточный рак прямой кишки состоит из атипичных клеток. Они принадлежат к плоскому кишечному эпителию. В патологических очагах присутствуют межклеточные мостики и кератин. Плоскоклеточные опухоли ректального отдела могут быть ороговевающими и неороговевающими.
Железисто-плоскоклеточная аденокарцинома относится к редким разновидностям ректального отдела. Такие новообразования представлены аденокарциномой, в сочетано с плоскоклеточным раком. Гистологи под микроскопом видят мелкие фрагменты плоскоклеточной трансформации.
Недифференцированные опухоли прямой кишки состоят из атипичных клеток эпителиальной ткани, которые не формируют структур железистого типа и не вырабатывают слизи. Эти клетки представляют собой различные цитологические структуры. Они формируют пласты или тяжи, которые разделяет скудная строма из соединительной ткани.
Скирром называется раковая опухоль, в которой соединительная ткань преобладает над стромой. Цитологические структуры в скирре представляют собой кубические клетки, собранные в тяжи или небольшие ячейки. Иногда в прямой кишке встречаются новообразования, которые не подходят ни к одному гистологическому типу. В этом случае онкологи говорят о не классифицируемом ректальном раке.
Нейроэндокринные опухоли прямой кишки происходят из клеток диффузной нейроэндокринной системы. Они имеют хорошо развитую фиброзную строму, гистологически отличаются от аденокарцином.
Отличие геморроя от рака прямой кишки
Геморрой и рак прямой кишки – проктологические заболевания, которые встречаются чаще всего. Как отличить геморрой от рака прямой кишки? Самостоятельно определить характер болезни можно по симптомам, но лучше всего обратиться за консультацией к врачам Юсуповской больницы. Онкологи проведут комплексное обследование и дифференциальную диагностику.
Геморрой и рак прямой кишки имеют очень похожую симптоматику и отлично маскируются. Длительный период времени они никак себя не проявляют. Характерным отличием является цвет крови. При геморроидальном кровотечении кровь яркого алого цвета, практически не смешивается с каловыми массами. В случае рака прямой кишки во время дефекации появляется тёмная кровь. Она равномерно распределена в кале.
Рак и геморрой проявляются характерными выделениями. При патологическом воспалении геморроидальных вен слизь прозрачная и не имеет резкого запаха. Признаком рака прямой кишки является наличие в кале зловонной, гнойной субстанции, которая появляется не только при дефекации.
При геморрое кал не меняет формы. Рост злокачественной опухоли, постепенное сужение просвета заднего прохода способствует формированию лентовидной каловой массы. При геморрое пациенты сознательно отказываются от приёма пищи из-за боли при запоре или дефекации, при этом они испытывают голод и вялость. При онкологическом заболевании прямой кишки больной кишки не жалуется на плохой аппетит, но стремительно теряет массу тела.
Доброкачественные опухоли прямой кишки
Тубулярная аденома прямой кишки представляет собой доброкачественное новообразование. Опухоль развивается из железистых клеток кишечника. Данный вид аденомы незначительного размера с гладкой ровной поверхностью. Аденома большого размера имеет дольчатое строение.
Выделяют 3 степени дисплазии при тубулярных аденомах кишечника. Умеренная дисплазия характеризуется утолщением базального слоя кишечного эпителия. Ядро клеток содержи мало хроматина, количество митозов (клеточного деления) повышено. Тубулярная аденома толстой кишки с дисплазией 2 степени имеет особенности: слой эпителия размыт, наблюдается выраженная пролиферация в ростковой зоне клеток. Сами элементы различаются между собой по форме и размеру. Выраженная степень дисплазии является терминальной стадией. Клетки при этом отличаются повышенным содержанием хроматина и разнообразием формы. Количество изменённых элементов варьирует от 0,5 до 1% ткани эпителия.
Ворсинчатая опухоль прямой кишки является доброкачественным новообразованием. Она представляет собой губчатое розовато-красное образование на толстой ножке или широком основании, четко отграниченное от неизмененных окружающих тканей. Поверхность покрыта тонкими бахромчатыми ворсинками, которые состоят из волокон соединительной ткани, покрытых слоем эпителиальных клеток. Строма ворсинчатой опухоли толстой кишки представлена соединительной тканью, которая пронизана большим количеством тонкостенных кровеносных сосудов.
Лечение аденокарциномы прямой кишки
При аденокарциноме прямой кишки метастазы появляются довольно рано. По этой причине после установления точного диагноза онкологи Юсуповской больницы немедленно начинают лечение. Чем раньше будет выявлено заболевание, тем лучше прогноз для пациента. Дифференцированная аденокарцинома прямой кишки лучше поддается лечению. Последствия недифференцированного рака являются более тяжёлыми. Каждому пациенту с таким диагнозом в клинике онкологии обеспечивают индивидуальный подход и качественную медицинскую помощь.
В настоящее время предпочтение отдаётся комбинированному лечению аденокарциномы прямой кишки. Во время операции хирурги устраняют основной очаг опухолевого роста. С помощью других методик воздействия уничтожают сохранившиеся раковые клетки.
В зависимости от распространённости опухолевого процесса определяют объём хирургического вмешательства. Экстирпация и резекция прямой кишки дополняются иссечением регионарных лимфатических узлов и мягких тканей. При выполнении таких операций хирурги-онкологи соблюдаю все принципы абластики и антибластики. Это позволяет значительно снизить риск распространения раковых клеток по организму. У некоторых пациентов оперативное вмешательство выполняется в несколько этапов. Пациенты, которым выведена колостома при раке прямой кишки, снабжаются всеми необходимыми материалами. Медицинский персонал проводит гигиенический уход за ней.
Применяемые в лечении рака прямой кишки методики лучевой терапии в некоторых случаях позволяют подавить прогрессирование опухолевого процесса. Сеансы радиотерапии проводят ослабленным пациентам, у которых выявлены противопоказания к хирургическому лечению или диагностирована неоперабельная опухоль.
Применение для химиотерапии современных цитостатических препаратов даёт возможность уничтожать раковые клетки во всех тканях организма пациента. Уменьшается риск развития рецидивов патологического процесса и улучшается прогноз для пациентов с опухолями прямой кишки. Получить консультацию онколога, проктолога можно, записавшись на приём по телефону Юсуповской больницы.
Злокачественные новообразования ободочной кишки
Общая информация
Краткое описание
Определение: Рак ободочной кишки — злокачественное новообразование ободочной кишки.
Название протокола: Злокачественные новообразования ободочной кишки.
Код протокола:
Код(ы) МКБ-10:
C 18 Злокачественное новообразование ободочной кишки
Сокращения, используемые в клиническом протоколе:
Дата разработки протокола: 2015 год.
Категория пациентов: взрослые.
Пользователи протокола: врачи-онкологи, химиотерапевты, хирурги, врачи общей практики, врачи скорой неотложной медицинцской помощи.
Оценка на степень доказательности приводимых рекомендаций.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
| GPP | Наилучшая фармацевтическая практика. |
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, «Атакент»
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
Клиническая классификация опухолей ободочной кишки: [9]
Т – размеры первичной опухоли и степень ее инвазии в стенку кишки
Тх – недостаточно данных для оценки первичной опухоли
Т0 – первичная опухоль не определяется
Tis – интраэпителиальная – преинвазивная карцинома (carcinoma in situ): внутрислизистая или инвазия в собственную пластинку слизистой оболочки (включает раковые клетки до базальной мембраны или в слизистом слое без распространения в подслизистый слой).
Т1 – опухоль инфильтрирует подслизистую основу
Т2 – опухоль инфильтрирует мышечный слой стенки кишки
Т3 – опухоль инфильтрирует в субсерозную основу или в не покрытые брюшиной ткани вокруг толстой либо прямой кишки
Т4 – опухоль распространяется на соседние органы или структуры/ткани и/или в висцеральную брюшину
Т4а – опухоль прорастает в висцеральную брюшину
Т4b – опухоль прорастает в другие органы или структуры *
N – региональные лимфатические узлы
Nх – недостаточно данных для оценки региональных лимфатических узлов N0 Нет метастазов в региональных лимфатических узлах
N0 – нет признаков метастатического поражения регионарных лимфатических узлов
N1 – метастазы в 1-3 региональных лимфатических узлах
N1а – метастаз в 1 региональном лимфатическом узле
N1b – метастазы в 2-3 региональных лимфатических узлах
N1с – опухолевые депозиты* в подсерозной основе или в не покрытых брюшиной мягких тканях вокруг толстой кишки и прямой кишки без метастазов в региональных лимфатических узлах
N2 – метастазы в 4 и более региональных лимфатических узлах
N2a – метастазы в 4-6 региональных лимфатических узлах
N2b – метастазы в 7 и более региональных лимфатических узлах
* Опухолевые депозиты (сателлиты) — макроскопически или микроскопически выявляемые гнезда или очаги опухолевой ткани в жировой ткани вокруг толстой и прямой кишки, находящейся в области лимфатического дренирования от первичной карциномы, при отсутствии ткани лимфатических узлов в этих участках, подтверждаемом при гистологическом исследовании, могут рассматриваться как прерывистое распространение опухоли, инвазия в венозные сосуды с внесосудистым распространением (V1/2) или полное замещение лимфатических узлов (N1/2). Если такие депозиты выявляют при наличии опухоли, то их следует классифицировать.
Примечание. Опухолевые узлы размерами более 3 мм в диаметре в околоободочной и околопрямокишечной жировой ткани с гистологическим обнаружением остатков лимфоидной ткани узла расцениваются как регионарные метастазы в околоободочных или околопрямокишечных лимфатических узлах. Однако опухолевые узлы до 3 мм в диаметре классифицируются как Т-категория, как перемежающееся распространение Т3.
М – отдаленные метастазы
Мх – недостаточно данных для определения отдаленных метастазов
М0 – нет отдаленных метастазов
М1 – есть отдаленные метастазы
рTNM патоморфологическая классификация
Категории pT, pN и рМ отвечают категориям Т, N и М.
Гистологически должны быть исследованы не менее 12 регионарных лимфатических узлов. Если исследованные лимфоузлы без опухолевого роста, то категория N классифицируются как pN0.
Группировка по стадиям рака ободочной кишки.
| Стадия | TNM | Распространенность | ||
| Стадия 0 | Tis | N0 | M0 | Carcinoma in situ |
| Cтадия I | T1 | N0 | M0 | Слизистая или подслизистая |
| T2 | N0 | M0 | Собственная мышечная оболочка | |
| Cтадия II | T3 | N0 | M0 | Брюшина/ткани вокруг кишки |
| T4 | N0 | M0 | Перфорация или инвазия в другие органы | |
| Cтадия IIIА | Т1, T2 | N1 | M0 | ≤3 пораженных лимфоузлов |
| Cтадия IIIВ | T3, T4 | N1 | M0 | ≤3 пораженных лимфоузлов |
| Cтадия IIIС | Любая T | N2 | M0 | ≥4 пораженных лимфоузлов |
| Cтадия IV | Любая T | Любая N | M1 | Отдаленные метастазы |
Диагностика
Перечень основных и дополнительных диагностических мероприятий:
Характеристика скрининга.
· Вид скрининга: Популяционный скрининг
· Методы скрининга: иммунохимическое исследование кала на скрытую кровь – iFOBT-тест, тотальная колоноскопия.
· Интервал: 1 раз в 2 года
· Срок действия: постоянно
· Целевая группа: мужчины и женщины 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70 лет, за исключением лиц, состоящих на диспансерном учете по поводу КРР.
Обследование по данной схеме проводится не только в целевой группе, но и при любом подозрении на заболевание.
Методы исследования:
1. Иммунохимическое исследование кала на скрытую кровь – iFOBT, именуемый в дальнейшем гемокульт-тест.
— всем мужчинам и женщинам целевой группы проводят иммунохимическое исследование кала на скрытую кровь экспресс-методом. Это позволяет получить результат в течение 10 минут, без участия медицинского работника. Оценка теста проводится только медицинским работником! Положительная проба должна быть проверена врачом ПМСП.
2. Тотальная колоноскопия.
— при положительном анализе кала на скрытую кровь в условиях ОД или в ДЦ проводится эндоскопическое обследование толстой кишки – тотальная колоноскопия.
3. Патоморфологическое (гистологическое) исследование.
— исследование материала биопсии толстой кишки, полученного в результате эндоскопического исследования проводится патоморфологами по месту взятия в соответствии с общепринятыми международными стандартами и классификацией ВОЗ.
При формировании целевой группы следует учитывать отсутствие тяжелых сопутствующих заболеваний. Под тяжелыми сопутствующими заболеваниями подразумеваются заболевания, которые с высокой вероятностью приведут к смерти в ближайшие 10 лет, например, распространенное ЗН, инфаркт миокарда с застойной сердечной недостаточностью, сахарный диабет с сосудистыми осложнениями, цереброваскулярные заболевания в стадии декомпенсации, хроническая обструктивная болезнь легких с дыхательной недостаточностью, цирроз печени и т.д.
На рисунке представлен алгоритм скрининга КРР.
Колоректальный скрининг входит в перечень ГОБМП и все его этапы являются бесплатными для населения, включая обеспечение лекарственными препаратами для подготовки кишечника к колоноскопическому исследованию.
Рисунок. Схема скрининга КРР в Казахстане.
На подготовительном этапе скрининга средний медицинский работник организации ПМСП/доврачебного кабинета отделения профилактики и социально-психологической помощи организации ПМСП информирует пациентов целевой группы о требованиях к прохождению скрининга: не следует проводить исследование в период менструации, при наличии кровоточащего геморроя, крови в моче или после значительных усилий при дефекации. Результаты теста должны быть доведены до среднего медицинского работника организации ПМСП/доврачебного кабинета отделения профилактики и социально-психологической помощи организации ПМСП в течение 1-3 дней после их получения;
Иммунохимическое (иммунохроматографическое) исследование кала на скрытую кровь (гемокульт-тест, iFOBT)проводится преимущественно в домашних условиях после получения теста и разъяснения правил проведения исследования средним медицинским работником ПМСП:
Для исследования используется небольшая часть стула, помещенного в чистой, сухой емкости; забор материала проводить с использованием наконечника контейнера путем введения в разные места стула; после забора материала закрутить крышку и несколько раз встряхнуть контейнер; нанести 3 капли раствора с взвешенными частицами кала в специальное окошко тест-карты; через 3-10 минут (или как указано производителем теста) провести интерпретацию теста.
Оценка результата теста проводится непосредственно (через 3-10 минут или как указано производителем теста) после проведения исследования самим пациентом, если тест проводится в домашних условиях, либо медицинским работником, если исследование проводится в поликлинике:
— появление двух полосок на уровне Т (тест) и С (контроль) расценивается как положительный результат (наличие крови в кале);
— появление одной полоски на уровне С (контроль) расценивается как отрицательный результат (отсутствие крови в кале);
— появление одной полоски на уровне Т (тест) расценивается как ошибочный результат;
— отсутствие полоски на уровне С (контроль) расценивается как ошибочный результат (в т.ч. вообще отсутствие полосок).
Если тест проводится в домашних условиях, просят пациента или его родственников перерисовать появление полосок с указанием уровней Т и С или сфотографировать на камеру, телефон для подтверждения достоверности результата.
В случае некорректного результата тест следует повторить. Положительный результат гемокульт-теста необходимо подтвердить врачом ПМСП/отделения (кабинета) профилактики и социально-психологической помощи организации ПМСП.
В случае положительного гемокульт-теста пациент направляется на тотальную колоноскопию. При этом врач ПМСП/отделения (кабинета) профилактики и социально-психологической помощи организации ПМСП:
— вносит результаты гемокульт-теста в Журнал учета пациентов, подлежащих колоректальному скринингу;
— информирует пациента о необходимости проведения исследования, методике исследования, подготовке к колоноскопии;
— направляет на тотальную колоноскопию в отделение эндоскопии ОД/КДЦ.
При проведении тотальной колоноскопии врач отделения эндоскопии:
— проводит биопсию образований, слизистой по показаниям;
— проводит одномоментную полипэктомию с клипированием или электрокоагуляцией при выявлении полипов на тонкой ножке при наличии соответствующего инструментария либо «холодную» биопсию при полипах размерами до 0,3-0,5 см;
— вносит результаты (непосредственные после колоноскопии и после получения гистологического заключения) в бланк колоноскопического исследования;
— осуществляет комплекс санитарно-гигиенических мероприятий по безопасному проведению эндоскопических процедур с целью исключения инфицирования лиц, проходящих эндоскопическое исследование.
В случае использования одного эндоскопического аппарата интервал между предыдущим и последующим эндоскопическими исследованиями составляет не менее 20 минут с учетом проведения очистки, дезинфекции высокого уровня, промывки и продувки эндоскопа с использованием аппарата автоматической обработки эндоскопического оборудования.
Медсестра отделения эндоскопии:
— регистрирует проведение исследования в журнале регистрации эндоскопических исследований толстой кишки, выполненных во время скрининга, с указанием даты проведения исследования, фамилии, имени, отчества пациента, возраста, адреса проживания;
— маркирует, регистрирует и направляет взятый биопсийный материал в патоморфологическую лабораторию ОД / патологоанатомическое бюро в соответствии с установленными правилами с указанием на сопроводительном бланке отметки «Материал взят по скринингу»;
— направляет результаты эндоскопического исследования в организацию ПМСП;
— гистологическое исследование биоптата слизистой толстой кишки, которое производится в патоморфологической лаборатории ОД / патологоанатомическом бюро. Морфологическая интерпретация биоптата осуществляется в соответствии с общепринятыми международными стандартами и классификацией Всемирной организации здравоохранения.
Заключительный этап включает в себя постановку на диспансерный учет лиц с выявленной патологией, завершение оформления учетно-отчетной статистической документации.
При отказе пациента от колоноскопии, подписанного пациентом и вклеенного в медицинскую карту амбулаторного пациента, или наличии медицинских противопоказаний к проведению эндоскопического исследования, врач отделения профилактики и социально-психологической помощи организации ПМСП проводит беседу с пациентом, включает в группу риска с контрольным проведением гемокульт-теста, направляет на консультацию к колопроктологу.
Основные (обязательные) диагностические обследования, проводимые на амбулаторном уровне:
· сбор жалоб и анамнеза;
· общее физикальное обследование;
· пальцевое исследование прямой кишки;
· ирригоскопия;
· тотальная фиброколоноскопия с биопсией опухоли;
· цитологическое исследование;
· гистологическое исследование;
· рентгенография обзорная органов грудной клетки в 2 проекциях;
· ультразвуковое исследование органов брюшной полости, забрюшинного пространства.
Дополнительные диагностические обследования, проводимые на амбулаторном уровне:
· компьютерная томография органов брюшной полости, забрюшинного пространства с контрастированием;
· ФЭГДС;
· рентгеноскопическое исследование желудка с контрастированием;
· экскреторная урография;
· сцинтиграфия костей скелета;
· Исследование блок-препарата опухолевой ткани иммуногистохимическим методом
· молекулярно-генетическое определение мутации гена KRAS;
· ПЭТ.
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию: согласно внутреннему регламенту стационара с учетом действующего приказа уполномоченного органа в области здравоохранения.
Основные (обязательные) диагностические обследования, проводимые на стационарном уровне (при экстренной госпитализации проводятся диагностические обследования не проведенные на амбулаторном уровне):
· сбор жалоб и анамнеза
· физикальное обследование
· пальцевое исследование прямой кишки;
· общий анализ крови;
· общий анализ мочи;
· биохимический анализ крови (общий белок, АЛТ, АСТ, мочевина, креатинин, билирубин, глюкоза);
· коагулограмма (ПТИ, Фибриноген, АЧТВ/АПТВ, МНО, этаноловый тест);
· ЭКГ;
· послеоперационное гистологическое исследование
Дополнительные диагностические обследования, проводимые на стационарном уровне (при экстренной госпитализации проводятся диагностические обследования не проведенные на амбулаторном уровне):
· колоноскопия с биопсией опухоли;
· рентгенография обзорная органов грудной клетки в 2 проекциях;
· ультразвуковое исследование органов брюшной полости, забрюшинного пространства;
· КТ ОБП с контрастированием
· Исследование блок-препарата опухолевой ткани иммуногистохимическим методом;
· ;молекулярно-генетическое определение мутации гена KRAS;
· экскреторная урография
· МРТ ОМТ
· ФЭГДС
· Цистоскопия
· Определение чувствительности к противомикробным препаратам выделенных культур ручным методом;
Диагностические мероприятия, проводимые на этапе скорой неотложной помощи: не проводятся.
Диагностические критерии постановки диагноза:
Жалобы и анамнез
· Боли в животе – от тупых, ноющих незначительных болей до сильных, приступообразных;
· Желудочный дискомфорт – потеря аппетита, отрыжка, иногда рвота, чувство тяжести в верхней половине живота;
· Кишечные расстройства – запоры, поносы, чередование запоров с поносами, урчание и вздутие живота;
· Патологические выделения в виде крови, слизи, гноя во время акта дефекации;
· Нарушение общего состояния больных – общее недомогание, повышенная утомляемость, слабость, похудание, лихорадка, бледность кожных покровов;
· Наличие пальпируемой опухоли.
Физикальное обследование:
Данные объективного исследования:
· Осмотр: бледность кожных покровов, ассиметрия живота, видимая перистальтика кишечника, участие передней брюшной стенки в акте дыхания;
· Пальпация живота: пальпаторное обнаружение опухоли, зависит от стадии заболевания, анатомической формы роста, напряжения брюшной стенки, степени заполнения кишечника содержимым.
· Перкуссия живота: притупление над опухолью, «шум плеска», тимпанит по ходу ободочной кишки выше расположения опухоли.
· Пальцевое исследование прямой кишки: возможна пальпация высоко расположенных опухолей прямой кишки и нижнего отрезка сигмовидной кишки, метастатические опухоли в дугласовом пространстве, переход опухоли слепой и сигмовидной кишки на женские половые органы и мочевой пузырь.
Лабораторные исследования:
· общий анализ крови – характерны гипохромная анемия, повышение СОЭ, лейкоцитоз;
· анализ кала на скрытую кровь – положительная реакция;
· коагулограмма – наблюдаются признаки гиперкоагуляции;
· анализ крови на онкомаркеры: АФП, РЭА, СА 242, СА19-9 – повышаются.
Инструментальные исследования:
· Ирригоскопия – информация о локализации новообразования, протяженности поражения, форме роста опухоли, подвижности опухоли. Признаки: изменение рельефа слизистой оболочки, сужение просвета, нарушение гаустрации, дефект наполнения, обтурация просвета;
· Эндоскопическое исследование (фиброколоноскопия) – визуализация злокачественной опухоли, получение материала для гистологического исследования;
· Компьютерная томография, магнитно-резонансная томография – с целью уточнения распространенности опухолевого процесса, выхода опухоли за пределы стенки кишки, выявления отдаленных метастазов в печени и забрюшинных лимфоузлах;
· Рентгеногафия грудной клетки в двух проекциях, при необходимости рентгеновская томография, компьютерная томография – для выявления метастазов в легких;
· ПЭТ – один из наиболее чувствительных и информативных методов выявления «маленьких» опухолей, рецидивов, микрометастазов.
Методы исследования:
1. Иммунохимическое исследование кала на скрытую кровь – iFOBT, именуемый в дальнейшем гемокульт-тест.
— всем мужчинам и женщинам целевой группы проводят иммунохимическое исследование кала на скрытую кровь экспресс-методом. Это позволяет получить результат в течение 10 минут, без участия медицинского работника. Оценка теста проводится только медицинским работником! Положительная проба должна быть проверена врачом ПМСП.
2. Тотальная колоноскопия.
— при положительном анализе кала на скрытую кровь в условиях ОД или в ДЦ проводится эндоскопическое обследование толстой кишки – тотальная колоноскопия.
3. Патоморфологическое (гистологическое) исследование.
— исследование материала биопсии толстой кишки, полученного в результате эндоскопического исследования проводится патоморфологами по месту взятия в соответствии с общепринятыми международными стандартами и классификацией ВОЗ.
При формировании целевой группы следует учитывать отсутствие тяжелых сопутствующих заболеваний. Под тяжелыми сопутствующими заболеваниями подразумеваются заболевания, которые с высокой вероятностью приведут к смерти в ближайшие 10 лет, например, распространенное ЗН, инфаркт миокарда с застойной сердечной недостаточностью, сахарный диабет с сосудистыми осложнениями, цереброваскулярные заболевания в стадии декомпенсации, хроническая обструктивная болезнь легких с дыхательной недостаточностью, цирроз печени и т.д.
На рисунке представлен алгоритм скрининга КРР.
Колоректальный скрининг входит в перечень ГОБМП и все его этапы являются бесплатными для населения, включая обеспечение лекарственными препаратами для подготовки кишечника к колоноскопическому исследованию.
Рисунок. Схема скрининга КРР в Казахстане.
На подготовительном этапе скрининга средний медицинский работник организации ПМСП/доврачебного кабинета отделения профилактики и социально-психологической помощи организации ПМСП информирует пациентов целевой группы о требованиях к прохождению скрининга: не следует проводить исследование в период менструации, при наличии кровоточащего геморроя, крови в моче или после значительных усилий при дефекации. Результаты теста должны быть доведены до среднего медицинского работника организации ПМСП/доврачебного кабинета отделения профилактики и социально-психологической помощи организации ПМСП в течение 1-3 дней после их получения;
Иммунохимическое (иммунохроматографическое) исследование кала на скрытую кровь (гемокульт-тест, iFOBT)проводится преимущественно в домашних условиях после получения теста и разъяснения правил проведения исследования средним медицинским работником ПМСП:
Для исследования используется небольшая часть стула, помещенного в чистой, сухой емкости; забор материала проводить с использованием наконечника контейнера путем введения в разные места стула; после забора материала закрутить крышку и несколько раз встряхнуть контейнер; нанести 3 капли раствора с взвешенными частицами кала в специальное окошко тест-карты; через 3-10 минут (или как указано производителем теста) провести интерпретацию теста.
Оценка результата теста проводится непосредственно (через 3-10 минут или как указано производителем теста) после проведения исследования самим пациентом, если тест проводится в домашних условиях, либо медицинским работником, если исследование проводится в поликлинике:
— появление двух полосок на уровне Т (тест) и С (контроль) расценивается как положительный результат (наличие крови в кале);
— появление одной полоски на уровне С (контроль) расценивается как отрицательный результат (отсутствие крови в кале);
— появление одной полоски на уровне Т (тест) расценивается как ошибочный результат;
— отсутствие полоски на уровне С (контроль) расценивается как ошибочный результат (в т.ч. вообще отсутствие полосок).
Если тест проводится в домашних условиях, просят пациента или его родственников перерисовать появление полосок с указанием уровней Т и С или сфотографировать на камеру, телефон для подтверждения достоверности результата.
В случае некорректного результата тест следует повторить. Положительный результат гемокульт-теста необходимо подтвердить врачом ПМСП/отделения (кабинета) профилактики и социально-психологической помощи организации ПМСП.
В случае положительного гемокульт-теста пациент направляется на тотальную колоноскопию. При этом врач ПМСП/отделения (кабинета) профилактики и социально-психологической помощи организации ПМСП:
— вносит результаты гемокульт-теста в Журнал учета пациентов, подлежащих колоректальному скринингу;
— информирует пациента о необходимости проведения исследования, методике исследования, подготовке к колоноскопии;
— направляет на тотальную колоноскопию в отделение эндоскопии ОД/КДЦ.
При проведении тотальной колоноскопии врач отделения эндоскопии:
— проводит биопсию образований, слизистой по показаниям;
— проводит одномоментную полипэктомию с клипированием или электрокоагуляцией при выявлении полипов на тонкой ножке при наличии соответствующего инструментария либо «холодную» биопсию при полипах размерами до 0,3-0,5 см;
— вносит результаты (непосредственные после колоноскопии и после получения гистологического заключения) в бланк колоноскопического исследования;
— осуществляет комплекс санитарно-гигиенических мероприятий по безопасному проведению эндоскопических процедур с целью исключения инфицирования лиц, проходящих эндоскопическое исследование.
В случае использования одного эндоскопического аппарата интервал между предыдущим и последующим эндоскопическими исследованиями составляет не менее 20 минут с учетом проведения очистки, дезинфекции высокого уровня, промывки и продувки эндоскопа с использованием аппарата автоматической обработки эндоскопического оборудования.
Медсестра отделения эндоскопии:
— регистрирует проведение исследования в журнале регистрации эндоскопических исследований толстой кишки, выполненных во время скрининга, с указанием даты проведения исследования, фамилии, имени, отчества пациента, возраста, адреса проживания;
— маркирует, регистрирует и направляет взятый биопсийный материал в патоморфологическую лабораторию ОД / патологоанатомическое бюро в соответствии с установленными правилами с указанием на сопроводительном бланке отметки «Материал взят по скринингу»;
— направляет результаты эндоскопического исследования в организацию ПМСП;
— гистологическое исследование биоптата слизистой толстой кишки, которое производится в патоморфологической лаборатории ОД / патологоанатомическом бюро. Морфологическая интерпретация биоптата осуществляется в соответствии с общепринятыми международными стандартами и классификацией Всемирной организации здравоохранения.
Заключительный этап включает в себя постановку на диспансерный учет лиц с выявленной патологией, завершение оформления учетно-отчетной статистической документации.
При отказе пациента от колоноскопии, подписанного пациентом и вклеенного в медицинскую карту амбулаторного пациента, или наличии медицинских противопоказаний к проведению эндоскопического исследования, врач отделения профилактики и социально-психологической помощи организации ПМСП проводит беседу с пациентом, включает в группу риска с контрольным проведением гемокульт-теста, направляет на консультацию к колопроктологу.
Дифференциальный диагноз
Лечение
Цели лечения:
· ликвидация опухолевого очага и метастазов;
· достижение полной или частичной регрессии, стабилизации опухолевого процесса.
Тактика лечения:
Общие принципы лечения в зависимости от стадии:
0 стадия:
· Операция.
I cтадия:
· Операция – широкая резекция с наложением анастомоза (объем операции в зависимости от локализации опухоли);
· Наблюдение.
II cтадия:
· Операция – широкая резекция с наложением анастомоза (объем операции в зависимости от локализации опухоли и распространенности опухолевого процесса);
· Послеоперационная химиотерапия или лучевая терапия (при степени местного распространения опухоли, соответствующей Т4, и/или высокий риск, молодой возраст);
· Наблюдение.
III cтадия
· Операция – широкая резекция с наложением анастомоза (объем операции в зависимости от локализации опухоли и распространенности опухолевого процесса);
· Послеоперационная лучевая терапия (при степени местного распространения опухоли, соответствующей Т4);
· Адъювантная химиотерапия;
· Наблюдение.
IV стадия
· Операция (чаще паллиативная; при резектабельной опухоли и наличии солитарных и единичных метастазов в отдаленных органах – операция с одномоментным или отсроченным удалением метастазов);
· После комбинированных операций:
1. послеоперационная химиотерапия или лучевая терапия (химио-лучевая) при степени местного распространения опухоли, соответствующей Т4;
2. Адъювантная химиотерапия (при солитарных и единичных метастазах в отдаленных органах);
3. Наблюдение.
· Симптоматическое лечение.
Примечание: при резектабельной опухоли и наличии одиночных и единичных метастазов в отдаленных органах – циторедуктивная операция с одномоментным или отсроченным удалением метастазов.
Критерии резектабельности метастазов в печени – отсутствие нерезектабельных экстрапеченочных метастазов, функциональная переносимость и отсутствие сопутствующих заболеваний в стадии суб – и декомпенсации), возможность удаления всех метастазов с клиренсом не менее 0,1 см без опухолевого роста и поражение менее 70% или 6 сегментов печени.
Критерии эффективности лечения:
Полный эффект – исчезновение всех очагов поражения на срок не менее 4х недель.
Частичный эффект – большее или равное 50% уменьшение всех или отдельных опухолей при отсутствии прогрессирования других очагов.
Стабилизация – (без изменений) уменьшение менее чем на 50% или увеличение менее чем на 25% при отсутствии новых очагов поражения.
Прогрессирование – увеличение размеров одной или более опухолей более 25% либо появление новых очагов поражения.
Немедикаментозное лечение.
Режим больного при проведении консервативного лечения – общий. В ранний послеоперационный период – постельный или полупостельный (в зависимости от объема операции и сопутствующей патологии). В послеоперационном периоде – палатный.
Диета безшлаковая, после хирургического лечения – №1, затем переход на стол № 2.
Медикаментозное лечение:
Химиотерапия
Патогенетическая тактика:
1) Проведение адъювантной полихимиотерапии после ранее проведённой радикальной операции. Обоснованием необходимости применения химиотерапии при раке ободочной кишки служит тот факт, что в момент выполнения 25–30% хирургических вмешательств, клинически оцениваемых как радикальные, уже имеются субклинические метастазы. В настоящее время фторурацил в комбинации с кальция или натрия фолинатом считается главным (базовым) химиотерапевтическим препаратом при колоректальном раке.
2) Проведение самостоятельной полихимиотерапии при наличии рецидива опухоли или метастазирования (прогрессирование, генерализация процесса).
3) Проведение самостоятельной химиотерапии при IV стадии заболевания (неоперабельные и генерализованные формы).
4) Клиническая тактика: химиотерапия при колоректальном раке применяется в качестве адъювантной терапии после хирургического или комбинированного лечения (операция + лучевая терапия), в комбинации с лучевой терапией и как самостоятельный метод лечения при распространённом процессе.
Адъювантная химиотерапия.
Химиотерапия должна начинаться сразу после восстановления пациента после операции, должна обязательно включать в себя фторпиримидины.
Схемы выбора: Режим клиники Мейо, режим Roswell Park, режим De Gramon, FOLFOX4, FOLFOX6, XELOX, FLOX, XELOX, кселода в монорежиме,тегафур, УФТ (см. «Схемы химиотерапии» );
Лечение в адъювантном периоде должно длиться не менее 6 месяцев и не должно включать в себя иринотекан, бевацизумаб, цетуксимаб.
Химиотерапия метастатического процесса
Выбор схемы химиотерапии для I линии терапии зависит от степени выраженности клинических симптомов: мало выраженные клинические симптомы–монотерапия фторпиримидинами либо оксалиплатин+фторпиримидины, иринотекан ± фторпиримидины; при выраженных клинических симптомах – оксалиплатин+фторпиримидины, иринотекан+фторпиримидины, иринотекан+оксалиплатин, оксалиплатин+иринотекан+фторпиримидины.
Режимы:
клиники Мейо, Roswell Park, De Gramont, Douillard, AIO, FOLFOX4, FOLFOX6, FLOX, XELOX, IFL, mIFL, FOLFIRI, FOLFOX7, mFOLFOX7, XELOX, CAPOX, XELIRI, IROX, FOLFOXIRI, МСАР, UFT/LV, в монорежиме капецитабин, тегафур, УФТ, иринотекан (см. «Схемы химиотерапии» ). 14, (УД А – В).
Примечание. При достижении резектабельности метастаза(ов), первичной или рецидивной опухоли хирургическое лечение может быть выполнено не ранее чем через 3 недели после последнего введения химиопрепаратов.
* В режимах, включающих в себя фторпимидины, наравне с кальция фолинатом возможно применение его биоэквивалента натрия фолината.
Таргетная терапия метастатического процесса
В лечении распространенного рака ободочной кишки, метастатического или рецидивного, оптимальным является сочетание цитостатиков с моноклональными антителами (таргетной терапией).
Анти-EGFR терапия (цетуксимаб): моноклональные антитела к EGFR (эпидермальный факор роста) эффективны в комбинации с химиотерапией или в форме монотерапии только у пациентов с отсутствием мутаций в генах RAS (RAS «дикого» типа).
Анти-VEGF терапия: применение моноклонального антитела к VEGF (эндотелиальный фактор роста) не зависит от мутационного статуса генов семейства RAS.
Ингибитор рецепторов VEGF, FGF, PDGF: пероральный мультикиназный таргетный ингибитор рецепторов VEGF, FGF, PDGF.
Первая линия лекарственной терапии:
RAS «дикого» типа:
цетуксимаб (моноклональное антитело к EGFR) длительно, до прогрессирования заболевания или до неприемлемой токсичности в сочетании с химиотерапией (см. таблица «Режимы сочетания химиотерапии и таргетной терапии с анти-VEGF»)
или
бевацизумаб (моноклональное антитело к VEGF) 5 мг/кг один раз в 2 недели или 7,5 мг/кг один раз в 3 недели в виде внутривенной инфузии, длительно, до прогрессирования заболевания или до неприемлемой токсичности в сочетании с химиотерапией (см. таблица «Режимы сочетания химиотерапии и таргетной терапии с анти-VEGF»).
RAS «мутированного» типа:
бевацизумаб 5 мг/кг один раз в 2 недели или 7,5 мг/кг один раз в 3 недели в виде внутривенной инфузии, длительно, до прогрессирования заболевания или до неприемлемой токсичности в сочетании с химиотерапией (см. таблица «Режимы сочетания химиотерапии и таргетной терапии с анти-VEGF»)
Примечание. При наличае индивидуальных противопоказаний к химиотерапии или таргетной терапии возможно применение либо только химиотерапии, либо только таргетной терапии.
Третья линия лекарственной терапии:
RAS «дикого» типа:
· цетуксимаб, если пациент не получали его в первой и во второй линиях; длительно, до прогрессирования заболевания или до неприемлемой токсичности в сочетании с химиотерапией (см. таблица «Режимы сочетания химиотерапии и таргетной терапии с анти- EGFR»)
или
· бевацизумаб в режиме, как в первой линии, если пациент не получали его в первой и во второй линиях; в режиме, как во второй линии, если пациент не получал бевацизумаб в первой линии
или
· регорафениб (ингибитор рецепторов VEGF, FGF, PDGF) при химиорезистентных формах рака ободочной кишки в монорежиме в дозе 160 мг 1 р/сут перорально, длительно, до прогрессирования.
RAS «мутированного» типа:
· бевацизумаб в режиме, как в первой линии, если пациент не получали его в первой и во второй линиях; в режиме, как во второй линии, если пациент не получал бевацизумаб в первой линии
или
· регорафениб (ингибитор рецепторов VEGF, FGF, PDGF) при химиорезистентных формах рака ободочной кишки в монорежиме в дозе 160 мг 1 р/сут перорально, длительно, до прогрессирования.
Таблица «Режимы сочетания химиотерапии и таргетной терапии с анти-VEGF»10 (УД –А – В):
| Схема химиотерапии | Схема таргетной тарпии |
| FOLFOX | бевацизумаб 5,0мг/кг, в/в, 30-90 минутная инфузия, 1 раз в 2 недели |
| FOLFIRI | |
| FOLFOXIRI | |
| IFL | |
| De Gramon | |
| Rosvell Park | |
| XELOX | бевацизумаб 7,5мг/кг, в/в, 30-90 минутная инфузия, 1 раз в3 недели |
| XELIRI | |
| FLOX |
Примечание. При достижении резектабельности метастаза(ов), первичной или рецидивной опухоли после лечения оперативное лечение может быть выполнено не ранее чем через 6 недель после последнего введения бевацизумаба.
Таблица «Режимы сочетания химиотерапии и таргетной терапии с анти- EGFR»:
Примечание 1. При достижении резектабельности метастаза(ов), первичной или рецидивной опухоли после лечения оперативное лечение не требует отсрочки после последнего введения цетуксимаба.
Примечание 2. Сочетание моноклональных антитела к EGFR и к VEGF ухудшает результаты лечения и допустимо только в рамках специальных исследований.
Таблица «Модификация дозы и введения препаратов»
| Препарат | Функция почек, клиренс креатинина, мл/мин | |||||||
| >60 | 30-60 | 10-30 | ||||||
| Капецитабин | 100% | 75% | отмена | отмена | ||||
| Иринотекан | Редукция дозы не требуется | |||||||
| Нарушение функции печени, билирубин >5 мг% (85,5 мкмоль/л) | ||||||||
| Фторурацил | отмена | |||||||
| Иринотекан | отмена | |||||||
| Кальция фолинат | редукция дозы не требуется | |||||||
| Капецитабин | редукция дозы не требуется | |||||||
| Кожная сыпь, III степень | ||||||||
| Цетуксимаб | Очередное введение откладывается на 1 нед., доза подбирается в зависимости от того, в который раз возникла сыпь III степени: впервые – 250 мг/м 2 во второй раз – 200 мг/м 2 в третий – 150 мг/м 2 в четвертый – отмена Интервал превышает 21 день – терапию отменяют | |||||||
| Гиперчувствительность, степень | ||||||||
| Цетуксимаб | I | II | III | III | ||||
| Уменьшение скорости инфузии на 50% | Прекращение инфузии, затем скорость инфузии должна быть снижена на 50% (см. Примечание) | Немедленное прекращение инфузии Дальнейшее лечение препаратом противопоказано. | ||||||
Примечание: при последующих введениях цетуксимаба скорость инфузии также должна быть 50%; снижение скорости инфузии производится только один раз; при повторном развитии аллергической реакции (на фоне сниженной скорости) – препарат отменяют.
Химиотерапия нейроэндокринных опухолей
Химиотерапия назначается при невозможности хирургического лечения, после циторедуктивных операций.
Функционирующие НЭО G1-G3: аналоги соматостатина (симптоматическая терапия):
Октреотид 0,1 мг п/к 3 раза в сутки в течение короткого периода времени (примерно 2 недели) с целью оценки его эффективности и общей переносимости
затем
Октреотид 20 мг внутримышечно 1раз/28 дней.
Если в течение 3 месяцев обеспечивается адекватный контроль клинических проявлений и биологических маркеров заболевания – октреотид 10 мг внутримышечно 1раз/28 дней.
Если в течение 3 месяцев обеспечивается только частичный контроль клинических проявлений и биологических маркеров заболевания – октреотид 30 мг внутримышечно каждые 4 недели.
Распространенные нейроэндокринные опухоли толстой кишки или с неизвестной локализацией первичной опухоли – октреотид 30 мг внутримышечно 1раз/28 дней до прогрессирования.
Нефункционирующие НЭО
Ki67 20%, G3:
1) карбоплатин/цисплаин+этопозид,
2) темозоломид+бевацизумаб,
3) темозоломид+капецитабин+бевацизумаб,
4) аналоги соматостатина
Хирургическое вмешательство:
Хирургическое вмешательство, оказываемое в амбулаторных условиях: нет.
Хирургическое вмешательство, оказываемое в стационарных условиях:
Основным методом лечения рака ободочной кишки является хирургический.
Виды хирургических вмешательств:
· правосторонняя гемиколэктомия;
· резекция поперечной ободочной кишки;
· левосторонняя гемиколэктомия;
· резекция сигмовидной кишки;
· частичная резекция толстой кишки.
Принципы радикальной операции:
· Дистальный и проксимальный края отсечения кишки должны быть на достаточном расстоянии от опухоли, чтобы при микроскопическом исследовании они не содержали опухолевых клеток;
· Вместе с опухолью должны быть удалены все регионарные лимфатические узлы.
· Объем и характер хирургического вмешательства зависят от ряда факторов, важнейшими из которых являются локализация опухоли, степень распространенности процесса, наличие или отсутствие осложнений основного заболевания.
· При расположении опухоли в правой половине ободочной кишки (червеобразный отросток, слепая кишка, восходящая ободочная кишка, печеночный изгиб, правая половина поперечной ободочной кишки) показана правосторонняя гемиколэктомия.
· Если опухоль локализуется в левой половине поперечной ободочной кишки, селезеночном изгибе, нисходящей ободочной кишке, проксимальной части сигмовидной кишки, выполняют левостороннюю гемиколэктомию.
· При небольших опухолях, локализующихся в средней части поперечной ободочной кишки, возможна ее резекция. При расположении опухоли в средней и нижней части сигмовидной кишки показана её резекция.
· При осложненном течении опухолевого процесса (кишечная непроходимость, перфорация опухоли и др.) может быть выполнена обструктивная резекция ободочной кишки с последующим возможным восстановлением непрерывности толстой кишки.
· При распространении опухоли толстой кишки в прилежащие органы и ткани, показано проведение комбинированных операций, а при наличии солитарных и единичных метастазов (в печени, легких, яичниках и т.д.) – одномоментное или отсроченное их удаление.
· Критерием радикально выполненной операции является гистологическое заключение об отсутствии злокачественного роста:
– в дистальном и проксимальном краях отсечения кишки;
– по окружности резецированного сегмента кишки (периферический клиренс).
· При нерезектабельных опухолях толстой кишки и множественных метастазах в отдаленных органах по показаниям необходимо выполнение паллиативных операций (формирование обходных анастомозов, наложение колостом).
Другие виды лечения:
Другие виды лечения, оказываемые на амбулаторном уровне: симптоматическое лечение, паллиативная помощь.
Другие виды, оказываемые на стационарном уровне:
Лучевая терапия:
· Послеоперационная лучевая терапия показана при степени местного распространения колоректального рака, соответствующей Т4 (распространение опухоли на стенки живота), через 3-4 недели после комбинированных операций.
· Лучевая терапия проводится в конвенциальном (стандартном) или конформном режиме облучения в статическом многопольном режиме РОД 2-2,5-3,0Гр до СОД 40–60Гр на зону врастания опухоли. При проведении лучевой терапии возможно применение препаратов, защищающих организм от лучевого повреждения.
· Облучение проводят на гамма-терапевтических аппаратах или линейных ускорителях.
Паллиативная помощь:
· При выраженном болевом синдроме лечение осуществляется в соответствии с рекомендациями протокола «Паллиативная помощь больным с хроническими прогрессирующими заболеваниями в инкурабельной стадии, сопровождающимися хроническим болевым синдромом», утвержден протоколом заседания Экспертной комиссии по вопросам развития здравоохранения МЗ РК №23 от «12» декабря 2013 года.
· При наличии кровотечения лечение осуществляется в соответствии с рекомендациями протокола «Паллиативная помощь больным с хроническими прогрессирующими заболеваниями в инкурабельной стадии, сопровождающимися кровотечением», утвержден протоколом заседания Экспертной комиссии по вопросам развития здравоохранения МЗ РК №23 от «12» декабря 2013 года.
Другие виды лечения, оказываемые на этапе скорой медицинской помощи: нет.
Индикаторы эффективности лечения:
· Удовлетворительное состояние при условии отсутствия осложнений и заживления п/о раны.
· Данные, свидетельствующие об отсутствии признаков прогрессирования процесса, полученные клиническими и/или визуализирующими методами исследования, а также повышение качества жизни больного.
Дальнейшее ведение
Наблюдение:
Режим наблюдения:
· первый год – 1 раз в 3 мес.;
· второй год – 1 раз в 6 мес.;
· в последующем, пожизненно – 1 раз в год.
Объем обследования:
· физикальное;
· лабораторное – ОАК, ОАМ, биохичический анализ крови, коагулограмма;
· ирригоскопия (по показаниям);
· тотальная фиброколоноскопия (по показаниям);
· ультразвуковое исследование брюшной полости, забрюшинного пространства;
· рентгенография обзорная органов грудной клетки (1 проекция);
· МРТ, КТ органов брюшной полости и забрюшинного пространства (по показаниям);
· ПЭТ (по показаниям);
· другие методы исследования (экскреторная урография, ФЭГДС и т.д.) и консультации специалистов (гинеколог, уролог и др.) по показаниям.
Методы лечения аденокарциномы кишечника
Среди злокачественных новообразований кишечника безусловное первое место занимают аденокарциномы. Они образуются из мутировавших клеток железистой ткани.
Слизистая оболочка толстого кишечника содержит разнородные железистые клетки, которые выполняют разные функции — вырабатывают ферменты, секрет, гормоны, слизь. Некоторые клетки могут однажды мутировать. Их деление ускоряется, они перестают выполнять свою функцию и образуют опухоль.
Поэтому после 50 лет рекомендуется регулярно проходить обследование — колоноскопию. При обнаружении полипов их нужно удалять, не дожидаясь озлокачествления.
Как показывает практика — это самый лучший и надежный способ защититься от рака кишечника. Такое обследование вы всегда можете пройти в международной клинике Медика24.
Есть ряд факторов, которые повышают риск возникновения аденокарциномы кишечника — это наличие фекалитов (каловых камней), хронические запоры, сидячий образ жизни, низкий иммунитет или наличие таких аутоиммунных заболеваний как болезнь Крона, неспецифический язвенный колит.
Не последнюю роль играет характер питания. При наличии в семейном анамнезе неполипозного рака или аденоматозных полипов возрастает роль наследственного фактора.
И все же, независимо от причин и факторов возникновения аденокарциномы кишечника, лучше средство профилактики — это регулярное проведение колоноскопии. Чтобы оценить степень срочности и актуальности этой процедуры можно сделать анализ на наличие скрытой крови в кале. Если она будет обнаружена, медлить уже нельзя!
Наши врачи вам помогут
Виды, стадии, симптомы
Чем больше мутировавшие клетки отличаются от нормальных клеток ткани, из которых они переродились, тем опаснее опухоль.
1. Высокодифференцированная форма.
Клетки опухоли мало отличаются от нормальных, скорость их деления относительно невысока, метастазы не образуются. Это наименее опасный вид аденокарциномы. После лечения, проведенного в нашей клинике, в 90% случаев наступает выздоровление.
2. Умеренно дифференцированная форма.
Клетки новообразования быстро делятся, опухоль увеличивается в размерах, возникают метастазы. Выживаемость составляет примерно 50%.
3. Низко дифференцированная форма.
Клетки опухоли делятся с такой быстротой, что не успевают сформироваться. Это самый агрессивный вид аденокарциномы, который поражает метастазами лимфоузлы, печень, легкие, позвоночник, костный мозг.
Прогнозы аденокарциномы кишечника зависят не только от ее формы, но и от стадии ее развития.
Начиная со второй стадии, опухоль проявляется все новыми симптомами. Если аденокарцинома образовалась в верхнем отделе кишечника, в кале появляются черные сгустки крови, а если в нижнем — вкрапления свежей крови. Возникают запоры, которые чередуются с диареей, вздутие живота, тошнота, рвотные позывы, повышенное газообразование.
кровотечения развиваются симптомы анемии — высокая утомляемость, слабость, упадок сил. Дефекация становится болезненной, появляется схваткообразная боль в животе. Постепенно болевой синдром усиливается. На поздней стадии боль становится очень сильной, возникает кишечная непроходимость, нарастают признаки интоксикации, кахексия.
Диагностика
Если опухоль образовалась в нижней части прямой кишки, ее можно обнаружить с посредством пальпации или ректороманоскопии. Обследование выполняется с помощью ректоскопа.
При более глубоком расположении опухоли она обнаруживается с помощью колоноскопии. Максимальную информацию дает комбинация эндоскопии и ультразвукового исследования (эндоУЗИ). Для этого в толстый кишечник вводится колоноскоп, оснащенный видеокамерой и датчиком УЗИ.
Врач визуально обследует кишечник и, подведя датчик к обнаруженным новообразованиям, делает снимки УЗИ. Этот метод позволяет не только выявить опухоль, но и узнать ее размеры, распространенность, степень прорастания и поражения тканей. Одновременно с этим врач делает забор тканей из опухоли — биопсию. Полученный материал исследуется под микроскопом.
Гистологическое исследование показывает характер опухоли (злокачественный или доброкачественный), степень дифференцировки. Одновременно проводится тестирование, изучается восприимчивость клеток к химиопрепаратам.
Чтобы оценить степень поражения лимфоузлов, наличие метастазов в соседних органах, выполняется МРТ брюшной полости, рентген или КТ с контрастом, УЗИ. Эти обследования дают полную информацию о распространении раковых клеток. Выявляется возможный канцероматоз брюшины (множественные метастазы).
Из лабораторных исследований выполняются анализы крови, мочи, кала. Анализы крови на онкомаркеры также используются для предварительной диагностики, но существенно большее значение они имеют для оценки эффективности проводимого лечения.
Позаботьтесь о себе, запишитесь на консультацию сейчас
Новообразования толстого кишечника
Опухоли толстого кишечника бывают доброкачественными и злокачественными. Тубулярная аденома толстой кишки и карциноид аппендикса (червеобразного отростка) относятся к доброкачественным новообразованиям. Аденокарцинома толстой кишки представляет собой злокачественное новообразование, которое развивается из клеток железистого эпителия. Это одна из гистологических разновидностей рака толстой кишки.
В Юсуповской больнице определяют наличие новообразований толстого кишечника с помощью современных методов диагностики. Гистологи верифицируют тип опухоли, исследуя под микроскопом образцы тканей, полученных во время биопсии. При наличии тубулярной аденомы толстой кишки проводят описание микропрепарата.
В зависимости от локализации и гистологического типа опухоли, состояния пациента и наличия сопутствующих заболеваний онкологи вырабатывают индивидуальный план лечения пациента. Тяжёлые случаи карциномы толстой кишки обсуждаются на заседании экспертного совета. В его работе принимают участие кандидаты и доктора медицинских наук, врачи высшей категории. Ведущие онкологи Москвы принимают коллегиальное решение о тактике ведения пациента.
Аденокарцинома может развиться из тубулярно-ворсинчатой аденомы толстой кишки с дисплазией. Последовательность «аденома – рак» подтверждена многочисленными исследованиями учёных. Риск развития злокачественных новообразований прямой и ободочной кишки у лиц с аденоматозными полипами в 3–5 раз выше, чем в общей популяции. В связи с высоким риском злокачественной трансформации тубулярной аденомы толстой кишки с дисплазией онкологи Юсуповской больницы проводят их раннюю диагностику и принимают превентивные меры по снижению заболеваемости аденокарциномой толстой кишки.
Гистологические типы аденом толстого кишечника
Выделяют 3 гистологических типа аденом толстой кишки:
Критерием разделения служит соотношение ворсинчатых и тубулярных структур. Тубулярная аденома толстой кишки – что это такое? Микроскопически тубулярная аденома представлена пролиферирующим аденоматозным эпителием. Опухоль состоит, из ветвящихся и значительно извитых железистых трубочек, более длинных, чем в обычной слизистой кишечника. В тубулярной аденоме присутствует не более 25 % ворсинчатой ткани. Тубулярная аденома толстой кишки имеет покрытое слизистой оболочкой основание. Оно представлено соединительной тканью, гладкомышечными клетками и сосудами. тубулярные аденомы имеют ножку и гладкую дольчатую поверхность. Реже они располагаются на широком основании. Совсем редко встречаются стелящиеся тубулярные аденомы, которые слегка выступают над поверхностью слизистой оболочки.
В тубулярно-ворсинчатых аденомах увеличивается количество ворсинок, которые могут определяться как на поверхности полипа, так и внутри крупных желез. Железы удлиняются, приобретают неправильную форму, плотно прилегают друг к другу. Нарастает степень дисплазии эпителия. В тубулярно-ворсинчатой аденоме процентное содержание ворсинчатой ткани варьирует от 25 до 75 %. Опухоль состоит из выраженных долек, имеет небольшие участки с ворсинками или очень мелкими дольками.
Ворсинчатая аденома состоит из тонких пальцевидных выростов соединительной ткани собственной пластинки слизистой оболочки, которые покрыты эпителием. В ворсинчатых аденомах можно встретить небольшое количество желез и 75% ворсинчатого компонента. Макроскопически ворсинчатые аденомы имеют широкое основание и «мохнатую» поверхность. Существует особый гистологический тип аденомы толстого кишечника – зубчатая аденома. Опухоль близка по строению к гиперпластическому полипу, но обладает возможностью малигнизации.
Аденоматозный эпителий относится к разряду неопластического. По этой причине каждая аденома имеет признаки дисплазии разной степени выраженности. Гистологи различают 3 степени дисплазии тубулярной аденомы толстой кишки:
Тубулярная аденома толстой кишки с дисплазией low grade – это низко дифференцированная опухоль. Она может трансформироваться в аденокарциному.
Классификация
Гистологи выделяют следующие виды злокачественных новообразований толстого кишечника:
Железистый рак принято может быть представлен следующими видами карцином толстой кишки: тубулярными, муцинозными, перстневидноклеточными, плоскоклеточными. Тубулярные аденокарциномы, состоят из трубчатых структур. Опухоли этого вида встречаются более чем у 50% пациентов с железистым раком. Они имеют смазанные контуры и небольшие размеры.
Муцинозная аденокарцинома состоит из слизистых компонентов и эпителиальных структур, не имеет очерченных границ. Метастазирует происходит лимфогенным путем. Высокий риск рецидивирования обусловлен нечувствительностью к радиотерапии.
Перстневидноклеточные аденокарциномы характеризуются высокой агрессивностью клинического течения. Большинство пациентов с опухолями данного вида, которые впервые обращаются за врачебной помощью в Юсуповскую больницу, уже имеет метастазы в лимфоузлах и печени. Онкологическое заболевание чаще всего отмечается у молодых пациентов.
Плоскоклеточные аденокарциномы формируются в области заднепроходного канала. Опухоль состоит из плоских эпителиальных клеток. Для клинического течения плоскоклеточных аденокарцином характерен высокий уровень злокачественности. Они часто рецидивируют, прорастают в ткани влагалища мочеточников, мочевого пузыря, и предстательной железы. Порог пятилетней выживаемости при плоскоклеточных аденокарциномах не превышает 30%.
Причины образования
Развитию тубулярной аденомы толстой кишки способствуют нутритивные факторы: высокое содержание жира и низкое – пищевых волокон. Изменения в рационе питания оказывают влияние на вероятность развития аденомы и аденокарциномы. К нарушению пролиферации эпителиальных клеток могут приводить рафинированные жиры. Нутритивные компоненты, которые содержатся во фруктах, овощах и других продуктах, могут регулировать канцерогенез толстой кишки, влиять на прогрессирование аденомы в карциному.
Увеличение размера полипа, количества ворсинок и выраженная дисплазия повышают риск малигнизации аденомы толстой кишки. Согласно статистическим данным, в аденокарциному преобразуется 4,8 % тубулярных, 22,5 % тубулярно ворсинчатых и 40,7% ворсинчатых аденом. Риск трансформации доброкачественных новообразований в злокачественные опухоли возрастает со степенью дисплазии. 5,7 % аденом со слабой степенью дисплазии, 18 % с умеренной степенью дисплазии и 34,5 % с дисплазией тяжелой степени преобразуются в аденокарциному толстой кишки.
Ворсинчатые, тубулярно-ворсинчатые аденомы и аденомы больше 1 см увеличивают риск последующего развития аденокарциномы толстой кишки. Этот риск выше у пациентов с множественными полипами.
Симптомы и диагностика
Большинство аденом толстого кишечника клинически не проявляют себя. Их обнаруживают случайно при скрининговых исследованиях или осмотрах по поводу жалоб, которые не связаны с ними. Иногда аденомы вызывают значительные кровотечения или приводят к хронической анемии вследствие длительной скрытой потери крови. Крупные аденомы прямой кишки могут сопровождаться тенезмами, выделением слизи. Продукция слизи в большом объеме вызывает нарушения электролитного баланса. Дистальные аденомы прямой кишки могут выпадать через заднепроходное отверстие.
Врачи Юсуповской больницы выявляют аденомы толстой кишки с помощью ректороманоскопии и колоноскопии. Аденома толстого кишечника чаще имеет вид полипа, расположенного на широком основании или связанного со стенкой кишки ножкой. Её длина ножки зависит от темпа роста локализации полипа. Быстро растущие аденомы имеют широкое основание. Медленно растущие расположены на ножке, которая образуется в результате перистальтики и вытяжения полипа перистальтической волной.
Некоторые аденомы толстой кишки имеют углублённый или плоский вид. Они не возвышаются над поверхностью слизистой оболочки. Визуально определить их можно по изменению цвета, структуры слизистой, отсутствию капиллярной сети. В Юсуповской больнице применяют простой и эффективный метод их идентификации – хромоскопию с индигокармином.
Тактика ведения пациентов
Когда при проведении ректороманоскопии проктологи Юсуповской больницы обнаруживают небольшой полип, размер которого не превышает 1см, выполняют биопсию. Если морфологически верифицируется аденома, проводят колоноскопию для выявления возможных синхронных поражений в проксимальных отделах ободочной кишки. При этом дистальную аденому, выявленную ранее, удаляют. Колоноскопию выполняют даже в том случае, когда при ректороманоскопии выявляют тубулярную аденому толстой кишки небольших размеров.
Если при ректороманоскопии врачи обнаруживают полип размером 1см и более, выполнять биопсию нет необходимости. Новообразование удаляют во время колоноскопии, которую проводят на предмет выявления синхронных опухолевых поражений в верхних отделах толстой кишки. При выявлении неопухолевого полипа (гиперпластического, воспалительного), в последующем наблюдении за ним нет необходимости.
После тотальной колоноскопии и удаления всех полипов последующую колоноскопию проводят через 3 года. При неполном удалении полипа, удалении больших аденом на широком основании, множественных полипов последующие колоноскопии проводят в более ранние сроки. Если при проведении контрольной колоноскопии не обнаруживают новых аденом, интервал наблюдения увеличивают до пяти лет.
При наличии больших полипов на широком основании, при эндоскопическом удалении которых высок риск осложнений, выполняют хирургическое вмешательство с лапаротомного доступа. После полного эндоскопического удаления аденоматозных полипов с тяжелой дисплазией) нет необходимости в дополнительном обследовании или лечении пациентов. Последующую колоноскопию выполняют в течение трёх лет. Если не обнаруживают новых аденом, интервал наблюдения увеличивают до 5 лет.
После эндоскопического удаления аденоматозного полипа с признаками злокачественной опухоли дальнейшую тактику определяют на основании прогностических критериев. Если эндоскопист убеждён, что полип был полностью удалён, при морфологическом исследовании выявлена высокодифференцированная или умеренно дифференцированная аденокарцинома, не было инвазии в кровеносные и лимфатические сосуды, не обнаружено злокачественных клеток в краях резекции, эндоскопическая полипэктомия считается радикальной. Когда отсутствует уверенность в полном удалении аденомы, при морфологическом исследовании выявлена низкодифференцированная аденокарцинома, присутствует инвазия в лимфатические или кровеносные сосуды, обнаружены злокачественные клетки в краях резекции, пациенту проводят оперативное хирургическое вмешательство в связи с высоким риском резидуальной аденокарциномы и метастазов в регионарные лимфоузлы.
При наличии признаков кишечного дискомфорта, причиной которого может быть тубулярная или тубулярно ворсинчатая аденома толстой кишки, высокодифференцированная или низкодифференцированная аденокарцинома, карциноид червеобразного отростка, обращайтесь к онкологам клиники. Вас запишут на приём к врачу Юсуповской больницы. Вы получите консультацию ведущих проктологов, онкологов в удобное для вас время. Своевременное излечение от аденомы толстой кишки предотвращает развитие аденокарциномы.
Аденокарцинома кишечника
Стадии заболевания
Если поставлена аденокарцинома кишечника, стадии определяются при помощи разных классификаций. Есть более простая – английская, но в российской практике часто используют ту классификацию, которая была установлена еще во времена СССР. Она предполагает, что аденокарцинома кишечника имеет четыре основных стадии с дополнительными вариантами:
Как и в случае с любым другим раком, аденокарцинома толстого кишечника усложняется по мере повышения стадии, поэтому с каждой ступенью требует все более серьезного лечения.
Факторы риска
К серьезным факторам риска относятся полипы толстой кишки, из которых нередко развивается аденокарцинома кишечника. На такую трансформацию влияет множество факторов, например, площадь основания самих полипов, их количество. Наиболее опасны множественные образования.
К факторам риска в плане заболеваний относятся и хронические воспаления толстой кишки, в том числе неспецифический язвенный колит. Такое заболевание, если оно длится около 20 лет, практически в 50% случаев приводит к раку. Под угрозой находятся и люди с болезнью Крона, диффузным семейными полипозом толстой кишки, а также наследственностью – если у родственников была аденокарцинома толстого кишечника или же другие виды рака.
Также есть и другие факторы риска:
Все, перечисленное списком, в отличие от конкретных заболеваний, не становится причиной рака напрямую. Это лишь те факторы, из-за которых аденокарцинома толстого кишечника рискует развиться с большей вероятностью.
Симптомы аденокарциномы кишечника
Рак кишечника аденокарцинома не имеет специфических проявлений, поэтому у него будут общие симптомы:
Опасность заключается в том, что аденокарцинома кишечника имеет проявления, которые очень похожи, например, на геморрой. То есть без участия врача и тщательной диагностики обнаружить у себя такую проблему нельзя. Вот почему при обнаружении любых из перечисленных неспецифических симптомов необходимо обращаться к проктологу.
Диагностика
Диагностика такого рака проводится по нескольким направлениям:
Большое значение для выявления такого типа рака имеют скрининговые исследования. Регулярные дополнительные исследования рекомендуются людям старше 50 лет, а также лицам, у которых были обнаружены геморрой, разные воспалительные заболевания толстой кишки, новообразования другого характера. Также в процессе самого исследования важно дифференцировать разные заболевания и правильно поставить диагноз.
Лечение аденокарциномы кишечника
Когда поставлена аденокарцинома кишки, стадии определены и выявлены все особенности заболевания, назначается лечение.
Хирургическое вмешательство
Если поставлен диагноз аденокарцинома, операция требуется во многих ситуациях. Чаще всего, если опухоль поразила не только слизистый, но и подслизистый слой кишки. При небольших размерах опухоли ее удаление производится через задний проход. Также операция делается одномоментно или поэтапно – второй вариант характерен для тех случаев, когда вторжения метастазов довольно обширны и захватывают другие органы.
Лучевая терапия
Данный метод используют перед хирургическим вмешательством, если опухоль выросла через все слои кишки либо обнаружены метастазы. Курс лучевой терапии занимает несколько дней, после чего делается операция. Также есть ситуации, когда данный вид терапии применяется более длительное время с перерывами, а вопрос об операции решается отдельно.
Химиотерапия
Если обнаружена аденокарцинома кишечника на третьей или четвертой стадии, химиотерапия назначается в виде самостоятельного вида лечения или в комплексе с лучевой терапией. «Химию» проводят как до, так и после хирургического вмешательства. В ряде случаев требуется профилактическая химиотерапия.
Если удалена аденокарцинома кишечника, после операции нужно находиться в больнице под наблюдением врачей. А после лечения пациент еще два года наблюдается у врача каждые 6 месяцев, сдает анализы и проходит обследования. Это нужно для того, чтобы избежать рецидивов, вовремя принять необходимые меры.
Прогнозы
Вначале статьи мы уже вкратце упомянули о прогнозах в зависимости от типа рака (см. «Классификация аденокарциномы кишечника»), но немного уточним этот момент. Если поставлена аденокарцинома кишечника, прогноз зависит как от стадии, так и от особенностей, течения самого заболевания. На самых первых этапах, если рак обнаружен вовремя, процент излечения может достигать 97-99% случаев. Ко второй стадии этот показатель снижается примерно на 7%, а начиная с третьей стадии риски сильно возрастают – излечение происходит в 60-70% случаев.
Однако важно помнить: какой бы ни была стадия, всегда есть индивидуальный фактор. При наличии диагноза аденокарцинома кишечника, прогноз может быть не самым благоприятным, а исход более удачным. Очень многое в лечении зависит и от настроя самого пациента, от его окружения.
Профилактические мероприятия
Профилактика в данном случае максимально простая: чтобы избежать проблем с кишечником, приводящих к раку, нужно правильно питаться, соблюдать питьевой режим, обязательно двигаться и следить за весом. Если среди родственников кто-то болел раком, проконсультируйтесь у специалистов. При отсутствии такой наследственности не забывайте о скрининговых исследованиях, начиная с 50 лет.
Бережно и внимательно относиться к своему здоровью, а также вести здоровый образ жизни – лучшая профилактика. Это не гарантирует того, что аденокарцинома никогда не разовьется, но риски такой проблемы будут намного меньше.
Как записаться к специалисту в онкоцентр «София»
Записаться на прием к специалистам онкологического центра «София» можно на сайте – пациенту необходимо внести в соответствующие поля свое имя, номер телефона и адрес электронной почты. Администраторы клиники совершат ответный звонок после обработки полученных данных.
Специалисты информационной службы клиники готовы ответить на любые вопросы и забронировать удобную для пациентов дату визита по телефону +7(495)995-00-34.
Онкологический центр «София» расположен на территории центрального административного округа Москвы по адресу 2-й Тверской-Ямской переулок, дом 10. Удобная локация позволит пациентам быстро добраться до клиники от станций метро «Маяковская», «Новослободская», «Тверская», «Чеховская» и «Белорусская».
Аденокарцинома толстой кишки: прогноз и методы терапии
Аденокарцинома или железистый рак – довольно-таки распространенный вид онкологии толстой кишки. В большинстве клинических случаев течение данного заболевания проходит тяжело и диагностируется очень поздно, что провоцирует высокий уровень смертности среди заболевших людей.
Чтобы хоть как-то защититься от аденокарциномы толстой кишки и ее последствий, важно знать характер протекания болезни, ее специфические особенности и общий порядок терапии. Подробней об этом и сущности резюмированной патологии поговорим сегодня.
Сущность и причины развития аденокарциномы
Аденокарцинома толстой кишки — серьезная патология
Как было отмечено выше, аденокарцинома толстой кишки – это онкологическое заболевание. По своей сути оно относится к раковому классу патологий и вызвано мутацией на клеточном уровне эпителия.
Если судить по официальной статистике, то аденокарцинома толстой кишки является одним из самых распространенных и опасных видов рака внутренних органов человека.
Спровоцировать раковую патологию кишечника могут разные факторы. К сожалению, точные причины рака и методы борьбы с ним медицине до сих пор неизвестны. На данный момент принято считать, что появление подобных недугов провоцируют:
Практика медучреждений показывает, что в большинстве клинических случаев имеет место сразу несколько патологических факторов. Помимо этого, важно констатировать невозможность страховки от аденокарциномы толстой кишки.
В современной медицине периодически регистрируются случаи, когда мутации клеток эпителия и сопутствующий ей метастаз диагностировались у совершенно здоровых людей, ни капли не попадающих в зону риска.
Естественно, максимально ограничение от неблагоприятных факторов и защита от них будут способствовать снижению рисков развития рака, но полностью защититься от него не позволят.
Симптомы поражения толстой кишки
Аденокарцинома толстой кишки
От ракового поражения могут страдать разные области и отделы толстого кишечника. Зачастую онкогенный очаг локализуется в анальном канале, слепой, прямой и ободочной кишках.
Вне зависимости от локализации рака его наличие с течением времени будет способствовать развитию осложнений и появлению специфической симптоматики. К сожалению, на ранних этапах аденокарцинома толстой кишки протекает бессимптомно и может быть диагностирована исключительно при систематичных обследованиях в поликлинике.
Что касается более поздних стадий рака, то на них проявления патологии более чем выражены. К основным признакам онкологии толстого кишечника относят:
На запущенных стадиях аденокарциномы наблюдается серьезнейший метастаз раковых клеток, что способствует появлению самых явных симптомов рака. Например, у заболевших людей сильно вздувается живот, отказываются работать конечности и появляется кишечная непроходимость.
Игнорировать ни подобную, ни описанную ранее симптоматику недопустимо. Помните, что лечить раковые патологии очень сложно и шансы на успех терапии зависят от оперативности выявления расстройств. Чем раньше диагностировать аденокарциному толстой кишки, тем выше будут шансы на полное избавление от нее и сопутствующих осложнений.
Опасность болезни
Аденокарцинома толстой кишки требует оперативного вмешательства
Аденокарцинома толстой кишки – одно из самых опасных заболеваний не только желудочно-кишечного тракта, но и организма целиком.
Из-за важности и больших размеров данного отдела осложнениям рака развиться намного проще, притом – в очень скоротечном режиме. Опасность аденокарциномы заключается в сопутствующих ей явлениях.
Наиболее опасны два из них:
По сути, именно метастазирование – главная причина сложности, а иногда невозможности терапии раковых патологий. Устранять локализацию онкогенных очагов люди научились, а вот бороться с развитием метастаза — еще нет.
В принципе, высокая опасность аденокарциномы толстой кишки ничем неудивительна. Онкологические патологии давно являются бичом современной медицины и ежегодно уносят жизни миллионов людей.
Лечить рак в высшей степени сложно, поэтому выявлять его и начать борьбу с патологией следует на самых ранних этапах развития, когда это наиболее возможно и шансы на выздоровление человека относительно высоки.
Диагностика
Аденокарцинома толстой кишки: под микроскопом
Для частичной нейтрализации опасности рака толстой кишки необходимо периодически обследоваться в поликлинике и выявлять любые расстройства на ранних этапах их развития или даже зарождения.
При проявлении же первых симптомов онкологии или подозрениях на нее медлить с обследованиями недопустимо, так как от их оперативности во многом зависит успешность и целесообразность дальнейшей терапии, конечно, если самые страшные догадки будут подтверждены.
В случае с поражением желудочно-кишечного тракта диагностика является наиболее обширной. Все начинается со сбора анамнеза, в процессе которого доктор:
После этого назначается общее обследования по выявлению рака. При подозрении на аденокарциному толстого кишечника не обойтись без:
Если факт онкологического поражения подтвержден, проводятся расширенные методы диагностики. В общем случае они позволяют определить степень и тяжесть поражения. При болезнях толстой кишки обычно реализуются:
По итогу комплексной диагностики больному ставится точный диагноз, в соответствии с которым профессиональные врачи организуют дальнейший курс терапии.
Игнорировать или медлить с обследованиями толстого кишечника при подозрении на ту же аденокарциному не просто нерационально, но и опасно для жизни любого человека. Забывать об этом не стоит.
Лечение
Прогноз зависит от стадии, на которой диагностировали болезнь
Лечение аденокарциномы толстой кишки – прерогатива профессиональных врачей, специализирующихся на избавлении от онкологии. Ни о каком самолечении данной патологии речи идти не может.
Важно понимать всю серьезность и опасность рака. При выявленной аденокарциноме без оперативного вмешательства зачастую не обойтись. В большинстве случае терапия организуется в трех направлениях:
Естественно, для получения должного эффекта циклы реализации терапевтических мер могут повторяться не просто несколько раз, а даже несколько десятков раз.
В современной медицине аденокарциному обычно лечат в комбинированном режиме. Наиболее эффективные методы терапии недуга включают в себя:
Существенно увеличить риски на итоговый успех лечения аденокарциномы может принятие следующих мер:
Использование народных методик медицины в качестве подспорья к основному терапевтическому курсу. К сожалению, гарантий полного излечения от аденокарциномы толстого кишечника дать невозможно. Риски неизлечимости патологии есть всегда, даже при ее выявлении на этапе зарождения или при несерьезной степени поражения.
Учитывая подобное положение дел, к терапии раковой болезни важно подойти крайне ответственно и всегда надеяться на лучшее. Многие ученые и медики убеждены, что настрой больного способен творить чудеса.
Прогноз терапии
Аденокарцинома толстой кишки: схематически
Прогноз терапии рака толстой кишки во многом зависит от следующих факторов:
Если судить по официальной статистике, то выживаемость при диагнозе «аденокарцинома толстой кишки» составляет:
Следует понимать, что каждый клинический случай всегда индивидуален, поэтому определять прогноз лечения должен наблюдающий больного врач. Вне зависимости от его заключений заболевшему онкологией важно верить только в лучшее и ни в коем случае не отчаиваться. Признание себя проигравшим не оставляет каких-либо шансов на победу, о чем не стоит забывать.
Пожалуй, на этом наиболее важные положения по теме сегодняшней статьи подошли к концу. Как видите, аденокарцинома толстой кишки – типовая онкология внутренних органов, являющаяся очень опасной и требующая должного, своевременного лечения. Надеемся, представленный материал был полезен всем читателям нашего ресурса.
Диагностика аденокарциномы толстой кишки:
Аденокарцинома толстого кишечника код мкб 10
В настоящее время классификация аденокарцином по сравнению с 2010 г. изменилась частично, исключены крибриформная комедоаденокарцинома (код МКБ-О: 8201/3), веретеноклеточная карцинома (8032/3), плоскоклеточная карцинома (8070/3), добавлены карцинома с саркоматозным компонентом (8033/3), дискогезивная (poorly cohesive) карцинома (8490/3) и аденомоподобная карцинома (8262/3). В качестве важных гистологических характеристик в Заключении необходимо указывать наличие лимфатической инвазии, интра- и экстрамуральной сосудистой инвазии, периневральной инвазии, степени злокачественности, «опухолевого почкования» (tumor budding) и характер иммунного окружения. В 5-м издании классификации добавлен большой раздел, посвященный молекулярной диагностике и молекулярным прогностическим факторам колоректального рака. Найдены соответствия между двумя различными классификациями, основанными на двух различных подходах: геномном (по ДНК) и транскриптомном (по РНК). В соответствии с геномной классификацией выделены две большие группы колоректального рака: гипермутационные и негипермутационные, которые соответствуют молекулярным путям с развитием микросателлитной и хромосомной нестабильности соответственно. Раздел нейроэндокринных опухолей существенных изменений не претерпел. Не рекомендовано использовать термин «карциноид» для обозначения нейроэндокринной опухоли G1, т.е. термин «карциноид» исключен.
ФГБОУВО «Московский государственный университет им. М.В. Ломоносова», Москва, Россия
ГУНУ «Факультет фундаментальной медицины МГУ им. М.В. Ломоносова»;
ГБОУ ДПО «Российская медицинская академия последипломного образования», Москва
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава РФ;
ГБОУ ДПО «Российская медицинская академия последипломного образования», Москва
Новая классификация опухолей толстой и прямой кишки WHO 2019, 5-е издание [1] выглядит довольно стройной, чрезвычайно краткой и включает только эпителиальные новообразования, разделенные на две группы: доброкачественные и злокачественные новообразования. Наша публикация посвящена классификации злокачественных новообразований (табл. 1). Ранее входившие в классификацию мезенхимальные опухоли и лимфомы из классификации исключены и вынесены в отдельный раздел.

Примечание. *NOS — not otherwise specified (без дополнительных уточнений).
Частота возникновения колоректального рака стремительно растет и регистрируется преимущественно в странах с высоким доходом, причем отмечается тенденция к развитию заболевания в молодом возрасте. В 2018 г. заболеваемость колоректальным раком занимала 2 место в мире у женщин и 3 место у мужчин [1].
Аденокарциномы
Морфологическая классификация аденокарцином по сравнению с 2010 г. изменилась частично, исключены крибриформная комедоаденокарцинома (8201/3), веретеноклеточная карцинома (8032/3), плоскоклеточная карцинома (8070/3), добавлены карцинома с саркоматозным компонентом (8033/3), дискогезивная (poorly cohesive) карцинома (8490/3) и аденомоподобная карцинома (8262/3).
Карцинома с саркоматозным компонентом. Характеризуется недифференцированными фокусами с наличием саркомоподобных признаков, таких как веретеноклеточный компонент или рабдоидные фигуры. Прогноз крайне неблагоприятный. Как правило, опухоли имеют большой размер, рабдоидные клетки с яркими внутрицитоплазматическими рабдоидными тельцами. Опухолевые клетки часто разрознены и заключены в миксоидный матрикс. Могут встречаться плеоморфные гигантские или веретеновидные клетки наряду с фокусами железистой дифференцировки. Характерно отсутствие ядерного окрашивания при иммуногистохимическом определении SMARCB1 (INI1).
Аденомоподобная карцинома. Ранее называлась «ворсинчатая», или «инвазивная папиллярная аденокарцинома», представляет собой инвазивную аденокарциному, в которой более 50% «инвазивных зон» (дословный перевод) похожи на ворсинчатые структуры аденомы с дисплазией low-grade. Характеризуется высокой частотой мутаций в гене KRAS и благоприятным прогнозом. Диагноз с помощью биопсии труден.
Зубчатая аденокарцинома. Критерии постановки диагноза не изменились. Частота встречаемости 10—15% от всех колоректальных раков. Морфология опухоли должна быть похожа на зубчатые образования с наличием зубчатого просвета, возможен муцинозный компонент. Опухолевые клетки имеют низкое ядерно-цитоплазматическое соотношение. Критерии этого подтипа весьма условны, поскольку при различных степенях дифференцировки и выраженности клеточной атипии оценить наличие зубчатого просвета и его «истинность» крайне затруднительно. Однако по сравнению с предыдущим изданием принципиально новых диагностических критериев или маркеров не добавлено.
Дискогезивная (poorly cohesive) аденокарцинома. Описание и критерии постановки не приведены, несмотря на ее наличие в классификации. Учитывая общий с перстневидно-клеточной аденокарциномой код МКБ-О (8490/3), отсутствие критериев нельзя считать критичным, однако с практической точки зрения неясно, в каких случаях пользоваться данной рубрикой. Такие опухоли ранее описаны при раке желудка, для колоректального рака этот подтип введен впервые. Смеем предположить, что критерии для толстой кишки те же, что и для желудка: изолированные или сгруппированные в мелкие кластеры опухолевые клетки, которые могут быть не только перстневидными, но и напоминать гистиоциты, лимфоциты, плеоморфные с резко атипичным ядром или ярко выраженной эозинофильной цитоплазмой и выраженной стромальной реакцией.
Аденоплоскоклеточная карцинома по-прежнему осталась в классификации и описана как редкий (частота менее 0,1%) тип, сочетающий в себе признаки аденокарциномы и плоскоклеточной карциномы (рис. 1).

Окраска гематоксилином и эозином, об. ×20.
Авторы по-прежнему настоятельно рекомендуют оценивать степень злокачественности по двухступенчатой шкале — low- и high grade по самому злокачественному компоненту, а не по степени дифференцировки опухоли (G1, G2, G3). Основные востребованные критерии колоректального рака [1]:
‒ степень дифференцировки: Low/High;
‒ глубина инвазии (по TNM);
‒ наличие (лимфо)васкулярной инвазии: интрамуральная сосудистая, экстрамуральная сосудистая инвазия, лимфатическая инвазия;
‒ периневральный рост: есть / нет;
‒ край резекции (проксимальный, дистальный, хирургический): позитивный, негативный, расстояние в сантиметрах;
‒ качество образцов краев резекции;
‒ количество выявленных лимфатических узлов;
‒ количество лимфатических узлов с метастазами;
‒ наличие ответа на терапию: есть (частичный или полный) / нет;
‒ микросателлитный статус/наличие белков системы репарации ДНК (MLH1, MSH2, MSH6,м PMS2): микросателлитно-стабильная, микросателлитно-нестабильная; окрашивание с белками системы репарации ДНК отсутствует или присутствует;
‒ статус опухолевого почкования;
‒ наличие/отсутствие соответствующих мутаций.
В качестве важных гистологических характеристик в Заключении необходимо указывать наличие лимфатической инвазии, интра- и экстрамуральной сосудистой инвазии, периневральной инвазии, степени злокачественности, опухолевого почкования (tumor budding) и характер иммунного окружения [2]. Все эти параметры, за исключением последнего, ассоциированы с плохим прогнозом, а иммунное окружение — с благоприятным (табл. 2). Также важно отмечать наличие позитивных/негативных краев резекции (проксимального, дистального и края резекции клетчатки) — считается положительным, если расстояние между опухолью и краем резекции менее 1 мм. В стадировании колоректального рака принципиальных изменений не выявлено, кроме введения новой подрубрики M1c — наличие метастазов на брюшине независимо от поражения соседних органов (ранее эти случаи кодировались M1b).

Примечание. *HR — hazard ratio — соотношение рисков,**CI — confidence interval — доверительный интервал.
В новую классификацию введены дополнительные характеристики опухоли: опухолевое почкование (tumor budding) и иммунное микроокружение. В тексте 5-го издания подробных инструкций к определению данных параметров не приводится, однако указаны ссылки на релевантные источники, которые рекомендуется использовать.
Консенсус «International Tumor Budding Consensus Conference» в марте 2015 г. в Бостоне [3] определил опухолевое почкование (tumor budding) как единичные клетки или как кластеры не более чем из 4 клеток (5 клеток и более именуются плохо дифференцированными кластерами), которые находятся в инвазивном крае опухоли и расцениваются как независимый прогностический фактор колоректального рака. Отмечено, что опухолевое почкование должно быть оценено на препаратах, окрашенных гематоксилином и эозином, при всех возможных вариантах, за исключением случаев с выраженным перитуморальным воспалением и фрагментацией желез; в некоторых случаях следует проводить иммуногистохимическое типирование. В дооперационных биопсиях следует использовать метод горячей точки (hotspot 1 ). В операционном материале может быть использован как метод hotspot, так и подсчет на 10 полях зрения. Инвазивный край с формированием опухолевых почек (budding) и плохо дифференцированных кластеров в общую оценку степени злокачественности опухоли не включаются, так как являются отдельным прогностическим фактором.

Метод определения количества опухолевых почек «hotspot» включает в себя следующие этапы (рис. 2):
1) выбор микропрепарата с наибольшей глубиной инвазии;
2) обзорный просмотр препарата при об. ×10 для определения горячей точки, hotspot — на 10 полях зрения вдоль инвазивного края в операционном материале (см. рис. 2, а) и на всех полях зрения вдоль инвазивного края при pT1-эндоскопическом материале (см. рис. 2, б);

Описание рисунков приводится в тексте.
3) подсчет опухолевых почек в выбранной области (hotspot) при об. ×20 (рис. 3);
4) нормализация опухолевых почек по формуле с учетом коэффициента пересчета из табл. 3.

Окраска гематоксилином и эозином, об. ×20.
Формула подсчета опухолевых почек:
где Bd — budding, опухолевые почки на площадь 0,785 мм 2 ; N — количество почек, подсчитанное при об. ×20; F — коэффициент пересчета (см. табл. 3).
Полученное значение Bd стандартизовано:
Bd1 2 2 (Low grade) — 0—4 почки;
Bd2 (Intermediate) — 5—9 почек;
Bd3 (High grade) — 10 почек и более.
В некоторых гистологических подтипах колоректального рака (муцинозном, перстневидно-клеточном, медуллярном и микропапиллярном) оценку опухолевых почек следует проводить с осторожностью:
— в муцинозных и перстневидно-клеточных карциномах опухолевые почки, расположенные в озерах слизи, считать не следует;
— в медуллярной карциноме в зоне выраженного воспалительного инфильтрата разрозненные опухолевые клетки не отличаются от истинных опухолевых почек, поэтому считать их следует с большой осторожностью;
— в микропапиллярной карциноме не следует в подсчет опухолевых почек включать плохо дифференцированные кластеры (5 клеток и более);
— во всех типах аденокарцином фрагментация желез в зоне выраженного (часто нейтрофильного) воспалительного инфильтрата также может быть с трудом отличима от опухолевых почек.
В случаях, когда точное количество опухолевых почек не может быть посчитано, в Заключении следует писать: «опухолевые почки не могут быть оценены», с последующим пояснением. В материале резекций прямой кишки по поводу рака после неоадъювантной терапии опухолевые почки не следует считать, поскольку в этих случаях их прогностическое значение не доказано.
Опухолевое почкование имеет доказанное прогностическое значение в трех ситуациях:
1) в случаях эндоскопических резекций pT1-раков, когда опухолевое почкование ассоциировано с метастазами в лимфатические узлы, показана хирургическая резекция;
2) у пациентов со II стадией, когда опухолевое почкование ассоциировано с короткой безрецидивной выживаемостью, целесообразна адъювантная терапия;
3) при оценке статуса опухолевого почкования в пред- операционной биопсии, что может помочь пациенту в выборе неоадъювантной терапии и потенциально предсказать регрессию опухоли.
Наличие иммунного микроокружения ассоциировано с лучшим прогнозом и микросателлитной нестабильностью (как независимым от прогноза фактором). Иммунное окружение следует оценивать по опухольинфильтрирующим лимфоцитам и тканевой реакции, подобной болезни Крона (Crohn) [2]:
— тканевая реакция, подобная болезни Крона, — более 3 лимфоидных фолликулов в фокусе выраженной воспалительной реакции;
— опухольинфильтрирующие лимфоциты (TILs) — наличие лимфоцитов (но не гранулоцитов) строго между опухолевыми клетками, считается на 5 полях зрения при об. ×40, среднее значение TILs вычисляется как общее количество лимфоцитов, деленное на 5.
Показано, что среднее число более 2 TILs в поле зрения и выраженная тканевая реакция, подобная болезни Крона, являются независимыми благоприятными прогностическими факторами. Другая известная схема подсчета TILs, основанная на рекомендациях International TILs Working Group, была предложена Y. Iseki и соавт. [6], однако в официальной классификации она не упоминается.
Для оценки опухолевого ответа на терапию предлагается использовать любую из нижеприведенных шкал оценки (табл. 4).

Примечание. AJCC — American Joint Committee on Cancer; MSKCC — Memorial Sloan Kettering Cancer Center; * — в оригинальной работе — пищеводная стенка.
Диагностическая молекулярная патология
В 5-м издании классификации добавлен большой раздел, посвященный молекулярной диагностике и молекулярным прогностическим факторам колоректального рака. Найдены соответствия между двумя различными классификациями, основанными на двух различных подходах: геномном (по ДНК) и транскриптомном (по РНК).
В соответствии с геномной классификацией выделены две большие группы колоректального рака: гипермутационные и негипермутационные, которые соответствуют молекулярным путям с развитием микросателлитной и хромосомной нестабильности соответственно.
Гипермутационные раки (около 15%) имеют высокую частоту мутаций и часто ассоциированы с MSI из-за гиперметилирования промотера гена MLH1 или инактивации ДНК через механизм MMR (13%). Почти все опухоли имеют CpG-фенотип и множество неактивных (silenced) генов из-за гиперметилирования промотера. Малое число опухолей является наследственными и относится к синдрому Линча (Lynch) или соматическим мутациям в MMR. Около 2—3% раков относят к ультрамутационным с чрезвычайно высоким уровнем мутаций, характерной заменой нуклеотидов (C→А), приводящей к наличию мутации, инактивирующей корректирующую функцию экзонуклеазного домена ДНК-реплицирущего фермента POLE (или реже POLD1), что, в свою очередь, приводит к ошибкам при спаривании оснований во время репликации ДНК. Ультрамутационные и гипермутационные часто объединяют в единую группу, поскольку показана достоверно более высокая частота мутаций по сравнению с негипермутационными раками.
Негипермутационные раки (85%) микросателлитно-стабильны и имеют низкую частоту мутаций, однако в них наблюдается высокая частота изменений (увеличение/уменьшение) числа копий соматических генов (SCNA, somatic copy-number alteration) на уровне плеча хромосомы. Гены, которые часто мутированы в негипермутированных раках, — APC (80%), TP53 (60%), KRAS (45%), а также другие (табл. 5).

Чаще всего данные изменения (табл. 6) находят отражения в WNT-, MAPK- и PI3K-сигнальных путях и в инактивации TGF-β- и p53-ингибиторных путей, что может служить основой для таргетной терапии. WNT-сигнальный путь активируется в 97% гипермутационных раков и в 93% негипермутационных.
Впервые достигнут консенсус по молекулярным подтипам колоректального рака (рис. 4). На основании транскриптомного профиля выделены четыре подтипа (consensus molecular subtype, CMS). Почти все гипермутационные (по генетической классификации) раки относятся к первой категории (CMS1, MSI-immune, 14%). Эти раки характеризуются частыми мутациями гена BRAF, метиляторным фенотипом, низкими SCNA, выраженным иммунным ответом — инфильтрацией CD8+ лимфоцитами, что обусловливает потенциальный ответ на ингибиторы контрольных точек иммунного ответа. Остальные микросателлитно-стабильные раки делятся на три подтипа: CMS2 (канонические, 37%), CMS3 (метаболические, 13%) и CMS4 (мезенхимальные, 23%). Тем не менее около 13% всех колоректальных раков не укладываются в достигнутый консенсунс, представляют собой раки с переходным фенотипом или внутриопухолевой гетерогенностью и отнесены к неклассифицируемому подтипу (см. рис. 4).

Выделены биомаркеры с установленным предикторным значением и биомаркеры с частично установленным предикторным значением или находящиеся в стадии разработки (см. табл. 6).

Биомаркеры с установленным предикторным значением
RAS-гены, к которым относятся KRAS и NRAS, имеющие терапевтическое значение. По международным рекомендациям подлежат анализу 12, 13, 59, 61, 117 и 146-й кодоны генов KRAS и NRAS, поскольку они коррелируют с устойчивостью к моноклональным антителам к внеклеточному домену EGFR (HER1). Эти антитела (цетуксимаб и панитумумаб) предотвращают димеризацию EGFR и последующее развитие онкогенных сигнальных путей. Почти 50% колоректальных раков имеют мутации гена KRAS и устойчивы к анти-EGFR-терапии, однако оставшиеся 40—60% опухолей с геном KRAS дикого типа хорошо отвечают на данную терапию.
BRAF. Мутации гена BRAF (чаще в районе 600-й аминокислоты, V600E) сопряжены с неблагоприятным прогнозом, используются для исключения синдрома Линча. Есть данные об отсутствии эффекта от анти-EGFR-терапии у пациентов с мутацией V600E.
Микросателлитная нестабильность. Наличие микросателлитной нестабильности — ключевой момент при синдроме Линча. Микросателлитная нестабильность, ассоциированная с геном BRAF дикого типа, является предиктором хорошего прогноза. С терапевтических позиций микросателлитная нестабильность снижает эффект от химиотерапии фторурацилом и является основанием для назначения иммунотерапии опухоли, в том числе блокаторов PD-L1, особенно в тех случаях, когда традиционная терапия не оказала эффекта.
Биомаркеры с частично установленным предикторным значением или находящиеся в стадии разработки
Успех PD-1/PD-L1-ингибиторов в лечении микросателлитно-нестабильных раков является обнадеживающим, однако имеет много ограничений в биологии и стадии опухоли.
Ген PIK3CA кодирует каталитическую субъединицу PI3K и подвержен мутациям в 10—20% случаев колоректального рака, которые затрагивают преимущественно экзоны 9 и 20. В колоректальных раках с геном RAS дикого типа мутации гена PIK3CA ассоциированы с неблагоприятным прогнозом и плохим ответом на терапию моноклональными антителами к EGFR. С другой стороны, мутация PIK3CA сопряжена с успешной адъювантной терапией ацетилсалициловой кислотой.
c-Met, рецепторная тирозинкиназа часто гиперэкспрессируется в гастроинтестинальных опухолях; аберрантная экспрессия, активация, амплификация и мутация гена MET наблюдаются в некоторых группах колоректального рака и могут являться потенциальными предиктивными маркерами к терапии ингибиторами c-Met.
«Жидкостная биопсия» — анализ периферической крови пациента. Может быть использована в диагностике метастатического колоректального рака и для определения предиктивных маркеров противоопухолевой терапии. Среди всех потенциальных тестов (обнаружение циркулирующих опухолевых клеток, экзосом, внеклеточной ДНК) выявление мутаций в генах (K)RAS и BRAF-мутаций сейчас доступно в некоторых центрах и с большой вероятностью станет широко распространено в ближайшем будущем.
Любопытно отсутствие упоминания о маркерах стволовых клеток и опухолевого микроокружения, которые являются активно развивающимися областями в онкологии и которым посвящено большое количество публикаций.
Нейроэндокринные опухоли. Раздел нейроэндокринных опухолей существенных изменений не претерпел и включает:
‒ нейроэндокринную опухоль (NET);
‒ нейроэндокринную карциному (NEC);
‒ смешанную нейроэндокринную/ненейроэндокринную карциному (8154/3), которая ранее именовалась как смешанная аденонейроэндокринная карцинома (8244/3).
Нейроэндокринные опухоли чаще развиваются в прямой кишке, отмечается незначительное увеличение заболеваемости в 1,5 раза за последние 20 лет. Не рекомендовано использовать термин карциноид для обозначения нейроэндокринной опухоли G1, т.е. термин карциноид исключен. Добавлена новая подрубрика — нейроэндокринная опухоль G3 с кодом, идентичным нейроэндокринной опухоли G2 (8249/3), однако критерии еще не определены.
Заключение
Классификация аденокарцином толстой кишки по сравнению с 2010 г. изменилась частично, исключены крибриформная комедоаденокарцинома, веретеноклеточная карцинома, плоскоклеточная карцинома, добавлены карцинома с саркоматозным компонентом, дискогезивная (poorly cohesive) карцинома и аденомоподобная карцинома. Введены дополнительные характеристики опухоли — опухолевое почкование (tumor budding) и иммунное микроокружение, имеющие прогностическое значение. На основании секвенирования генома выделены гипермутационные и негипермутационные раки и на основании транскриптомного профиля CMS1 (раки с MSI, 14%), CMS2 (канонические, 37%), CMS3 (метаболические, 13%), CMS4 (мезенхимальные, 23%), а также неклассифицируемый подтип (около 13%).
Работа выполнена в рамках госзадания ФГБОУ ВО МГУ им. М.В. Ломоносова с использованием оборудования, приобретенного по Программе развития ФГБОУ ВО МГУ им. М.В. Ломоносова до 2020 г.
1 Зона с максимально выраженным процессом, опухолевым почкованием.
Рак ободочной кишки и ректосигмоидного отдела у взрослых. Клинические рекомендации.
Рак ободочной кишки и ректосигмоидного отдела у взрослых
Оглавление
Ключевые слова
Рак ободочной кишки
Рак ректосигмоидного отдела
Список сокращений
МКА – моноклональные антитела
КТ – компьютерная томография
МРТ – магниторезонансная томография
ПЭТ – позитронно-эмиссионная томография
РЧА – радиочастотная аблация
УЗДГ – ультразвуковая допплерография
УЗИ – ультразвуковое исследование
1. Краткая информация
1.1 Определение
Рак ободочной кишки и ректосигмоидного отдела – злокачественная опухоль, исходящая из слизистой оболочки толстой кишки.
1.2 Этиология и патогенез
У 10 % больных раком ободочной кишки развитие заболевания связано с наличием известных наследственных синдромов. Наиболее распространённые – синдром Линча и семейный аденоматоз толстой кишки. У остальных пациентов рак ободочной кишки и ректосигмоидного отдела имеет спорадический характер.
В качестве факторов риска развития данной патологии рассматриваются: хронические воспалительные заболевания толстой кишки (например, неспецифический язвенный колит, болезнь Крона), курение, алкоголь, превалирование в рационе красного мяса, наличие сахарного диабета, ожирение или повышенный индекс массы тела, низкая физическая активность 6.
1.3 Эпидемиология
Рак ободочной кишки и ректосигмоидного отдела занимает лидирующие позиции по заболеваемости и смертности от злокачественных опухолей. В 2008 году в России зарегистрировано 55 719 новых случаев рака толстой кишки и одновременно умерло по этой причине 37 911 больных [14].
1.4 Кодирование по МКБ 10
Злокачественное новообразование ободочной кишки (С18):
С18.0 – Злокачественное новообразование слепой кишки
С18.1 – Злокачественное новообразование червеобразного отростка
С18.2 – Злокачественное новообразование восходящей ободочной кишки
С18.3 – Злокачественное новообразование печеночного изгиба ободочной кишки
С18.4 – Злокачественное новообразование поперечной ободочной кишки
С18.5. – Злокачественное новообразование селезеночного изгиба ободочной кишки
С18.6 – Злокачественное новообразование нисходящей ободочной кишки
С18.7 – Злокачественное новообразование сигмовидной кишки
С18.8 – Поражение ободочной кишки, выходящее за пределы одной и более вышеуказанных локализаций
С18.9 – Злокачественное новообразование ободочной кишки неуточненной локализации
Злокачественное новообразование ректосигмоидного соединения (С19)
1.5 Классификация
1.5.1 Международная гистологическая классификация (2010)
Эпителиальные опухоли
Доброкачественные опухоли
Интраэпителиальная неоплазия (дисплазия), связанная с хроническими воспалительными заболеваниями кишечника
Железистая интраэпителиальная неоплазия высокой степени
Железистая интраэпителиальная неоплазия низкой степени
Рак*
*опухоли делятся на высоко- (более чем в 95% клеток определяются железистые структуры), умеренно- (железистые структуры определяются в 50-95% клеток), низкодифференцированные (железистые структуры определяются в 5-50% клеток) и недифференцированные (железистые структуры определяются в 50% объёма опухоли представлено внеклеточной слизью. Всегда расцениваются как низкодифференцированные.
***устанавливается, если >50% внутриклеточного объёма представлено слизью. Всегда расцениваются как низкодифференцированные.
1.6 Стадирование
1.6.1 Стадирование рака ободочной кишки по системе TNM7 (2009)
Для рака ободочной и ободочной кишки используется единая классификация.
Символ Т содержит следующие градации:
ТХ – недостаточно данных для оценки первичной опухоли.
Тis – преинвазивная карцинома (интраэителиальная инвазия или инвазия собственной пластинки слизистой оболочки).
Т1 – опухоль распространяется в подслизистый слой стенки кишки
Т2 – опухоль распространяется на мышечный слой, без прорастания стенки кишки.
Т3 – опухоль прорастает все слои стенки кишки с распространением в жировую клетчатку, без поражения соседних органов.
Для опухолей, расположенных в верхнеампулярном отделе прямой кишки и ректосигмоидном отделах ободочной кишки (покрытых брюшиной), символ Т3 характеризует распространение опухоли до субсерозы (не прорастают серозную оболочку).
Т4 – опухоль прорастает в окружающие органы и ткани или серозную оболочку при локализации в верхнеампулярном отделе прямой кишки и ректосигмоидном отделах ободочной кишки (покрытых брюшиной).
Т4а – прорастание висцеральной брюшины
Т4b– прорастание в другие органы и структуры
Символ N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах
NХ – недостаточно данных для оценки регионарных лимфатических узлов.
N0 – поражения регионарных лимфатических узлов нет.
N1– метастазы в 1-3 (включительно) регионарных лимфатических узлах.
N1a – метастазы в 1 регионарном лимфатическом узле.
N1b – 2-3 лимфатических узла.
N1c – диссеминаты в брыжейке без поражения регионарных лимфатических узлов
N2 – метастазы в более чем 3-х регионарных лимфатических узлах.
N2a – поражено 4-6 лимфатических узлов.
N2b – поражено 7 и более лимфатических узлов.
Символ М характеризует наличие или отсутствие
отдаленных метастазов
М0 – отдаленных метастазов нет.
М1 – наличие отдаленных метастазов.
М1a– наличие отдаленных метастазов в одном органе.
М1b– наличие отдаленных метастазов более чем в одном органе или по брюшине.
Группировка по стадиям представлена в таблице 1:
Таблица 1 – Стадии рака толстой кишки
Стадия
Т
N
M
Определение регионарных лимфатических узлов в зависимости от локализации опухоли представлено в таблице 2:
Таблица 2 – регионарные лимфоузлы, в зависимости от локализации первичной опухоли
Локализация опухоли
Регионарные лимфатические узлы
Вдоль a.ileocolica, a.colica dextra
Восходящая ободочная кишка
Вдоль a.ileocolica, a.colica dextra, a.colica media
Печёночный изгиб ободочной кишки
Вдоль a.colica dextra, a.colica media
Поперечная ободочная кишка
Вдоль a.colica dextra, a.colica media, a.colica sinistra, a.mesenterica inferior
Селезёночный изгиб ободочной кишки
Вдоль a.colica media, a.colica sinistra, a.mesenterica inferior
Нисходящая ободочная кишка
Вдоль a.colica sinistra, a.mesenterica inferior
Вдоль aa.sigmoideae, a.colica sinistra, a.rectalis superior, a.mesenterica inferior
1.6.2 Стадирование по Kikuchi раннего рака ободочной кишки
При планировании местного иссечения Т1 рака ободочной кишки предлагается детальное стадирование заболевания на основании данных МРТ и УЗ-колоноскопии по следующим критериям:
Т1sm1 – глубина инвазии подслизистого слоя до 1/3.
Т1sm2 – умеренная глубина инвазии подслизистого слоя – до 2/3
T1sm3 – полная инвазия опухолью всего подслизистого слоя
Окончательное стадирование проводится по результатам гистологического исследования после удаления опухоли.
1.6.3 Стадирование по Haggitt малигнизированных полипов ободочной кишки
Для определения тактики лечения малигнизированных полипов ободочной кишки предлагается стадирование по результатам морфологического исследования:
Уровень 0 – отсутствие инвазивной карциномы
Уровень I – инвазия в «головку» полипа
Уровень II – инвазия в «шейку» полипа
Уровень III – инвазия в «ножку» полипа
Уровень IV – инвазия в «основание» полипа
Уровень I-III соответствует T1sm1, а уровень IV может соответствовать T1sm1-3
2. Диагностика
2.1 Жалобы и анамнез
Рекомендуется тщательный сбор жалоб и анамнеза у пациента с целью выявления факторов, которые могут повлиять на выбор тактики лечения [38].
Комментарии: У 10 % больных раком ободочной кишки развитие заболевания связано с наличием известных наследственных синдромов. Наиболее распространённые – синдром Линча и семейный аденоматоз толстой кишки.
У всех больных колоректальным раком после подтверждения диагноза рекомендуется собрать семейный анамнез и проанализировать его на соответствие критериям Amsterdam II и Bethesda [2].
2.2 Физикальное обследование
Рекомендуется тщательный физикальный осмотр, включающий пальцевое ректальное исследование, оценка нутритивного статуса.
2.3 Лабораторная диагностика
Рекомендуется выполнять: развернутые клинический и биохимический анализы крови, онкомаркеры РЭА, СА 19.9, исследование свёртывающей системы крови, анализ мочи.
2.4 Инструментальная диагностика
Комментарий: План лечения не следует составлять до получения данных биопсии. При подслизистом инфильтративном росте опухоли возможен ложноотрицательный результат, что требует повторной глубокой биопсии. Чувствительность и специфичность метода возрастает при использовании современных технологий эндоскопической визуализации (увеличительной эндоскопии, узкоспектральной эндоскопии, хромоэндоскопии, флуоресцентной диагностики). Если тотальная колоноскопия не была выполнена на дооперационном этапе, ее необходимо провести в течение 3-6 месяцев после резекции ободочной кишки.
Рекомендуется выполнить ирригоскопию или КТ-колонографию при невозможности выполнения тотальной колоноскопии [38].
Комментарий: В 4-5% случаев встречаются синхронные образования, которые могут быть пропущены при пальпаторной ревизии на операции [15, 16]. Поэтому полное обследование толстой кишки рекомендуется выполнять всем пациентам до хирургического лечения, при технической невозможности – не позднее 3 месяцев после хирургического лечения. КТ-колонография имеет большую по сравнению с ирригоскопией чувствительность в выявлении полипов, особенно в проксимальных отделах толстой кишки [17].
Рекомендуется выполнить КТ органов брюшной полости с внутривенным контрастированием либо УЗИ органов брюшной полости и забрюшинного пространства.
Комментарий: КТ органов брюшной полости является стандартом уточняющей диагностики при раке ободочной кишки в большинстве развитых стран. На практике данные исследования могут быть отчасти заменены УЗИ органов брюшной полости у пациентов с небольшой местной распространенностью опухолевого процесса).
Рекомендуется выполнить рентгенографию грудной клетки в двух проекциях либо КТ органов грудной клетки.
Рекомендуется выполнить ЭКГ.
Рекомендуется выполнить УЗ-колоноскопию при планировании местного иссечения Т1sm1 и ворсинчатых опухолей ободочной кишки. [18]
Рекомендуется выполнить МРТ органов брюшной полости с внутривенным контрастированием выполняется при планировании резекции печени в случаях, когда КТ не позволяет в полной мере высказаться о распространенности процесса в печени. [19]
Рекомендуется выполнить остеосцинтиграфию при подозрении на метастатическое поражение костей скелета.
Рекомендуется выполнить биопсию под контролем УЗИ/КТ при подозрении на метастазы по данным КТ или МРТ в случаях, когда их подтверждение принципиально меняет тактику лечения.
Рекомендуется выполнить ПЭТ-КТ при подозрении на метастазы по данным КТ или МРТ в случаях, когда их подтверждение принципиально меняет тактику лечения.
Рекомендуется выполнить лапароскопию при подозрении на диссеминацию опухоли по брюшине.
Рекомендуется выполнить МРТ или КТ головного мозга с внутривенным контрастированием при подозрении на метастатическое поражение головного мозга.
Рекомендуется при подготовке к хирургическому лечению с целью оценки функционального статуса по показаниям проводить дополнительное обследование: эхокардиографию, холтеровское мониторирование сердечной деятельности, исследование функции внешнего дыхания, УЗДГ сосудов шеи и нижних конечностей, консультации кардиолога, эндокринолога, невропатолога и т.п.
2.5 Иная диагностика
Рекомендуется выполнить анализ биоптата опухоли на мутацию RAS (экзоны 2–4 генов KRAS и NRAS), если диагностированы или заподозрены отдаленные метастазы аденокарциномы, это может повлиять на выбор таргетного агента в лечении метастатического процесса [25].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – Ia)
Генетическое тестирование рекомендуется в следующих случаях:
1) Подозрение на синдром Линча. Выполняется тестирование на мутации в генах MLH1, MSH2, MSH6, PMS2:
при соответствии пациента критериям Amsterdam II и Bethesda
при наличии у пациента родственника первой или второй линии с установленным диагнозом синдрома Линча
при развитии у пациентки рака эндометрия в возрасте до 50 лет
2) Подозрение на семейный аденоматоз – тестирование на мутацию гена АРС:
при наличии у пациента более 20 полипов кишечника
при наличии у пациента родственника первой линии с установленным диагнозом семейного аденоматоза
3) Подозрение на наличие аттенуированной формы семейного аденоматоза, MYH–ассоциированный полипоз – тестирование на мутацию АРС, мутацию MYH – пациенты, у которых выявлено более 20 полипов толстой кишки, но с отрицательным анализом на мутацию АРС:
пациенты, у которых в семье прослеживается рецессивное наследование семейного аденоматоза;
пациенты, у которых полипы выявляются в более позднем возрасте (34-44 лет). [2]
Уровень убедительности рекомендаций B (уровень достоверности доказательств – IIb)
Комментарии: За исключением MYH–ассоциированного полипоза и синдрома Блума, все наследственные синдромы, связанные с развитием колоректального рака, носят аутосомно-доминантный характер. При наличии яркого семейного анамнеза злокачественных заболеваний пациентам с исключённым семейным аденоматозным полипозом и синдромом Линча показана консультация генетика для потенциального выявления более редких заболеваний: синдромов Пейтца–Егерса, Ли–Фраумени, Блума, Коудена, ювенильного полипоза, олигодонтии и колоректального рака [2].
Рекомендуется проводить гистологическое исследование хирургически удаленного опухолевого препарата, при этом в морфологическом заключении рекомендуется отразить следующие параметры:
Расстояние до проксимального и дистального краёв резекции;
Гистологическое строение опухоли;
Степень дифференцировки опухоли;
рN (с указанием общего числа исследованных и поражённых лимфоузлов);
Наличие поражения проксимального края резекции (отрицательный результат также должен быть констатирован);
Наличие поражения дистального края резекции (отрицательный результат также должен быть констатирован);
Наличие лимфоваскулярной, периневральной инвазии (отрицательный результат также должен быть констатирован);
Степень регрессии опухоли по шкалам Mandard/Dworak (при наличии предшествующего комбинированного лечения);
Поражение апикального лимфатического узла (отрицательный результат также должен быть констатирован).
Уровень убедительности рекомендаций C (уровень достоверности доказательств – IV)
3. Лечение
Рекомендуется рассматривать хирургическое вмешательство как основной метод радикального лечения больных раком ободочной кишки или ректосигмоидного отдела кишки [38].
Комментарии: по показаниям дополнительно проводится адъювантная/неоадъювантная химиотерапия.
При раннем раке ободочной кишки 0-I стадии (Tis–T1sm1N0M0) рекомендуется рассматривать возможность применения органосохранных и функционально-щадящих способов лечения (эндоскопическая резекция слизистой) с высокой эффективностью.
Комментарии: при определении тактики лечения надо учитывать факторы прогноза. Предпочтение следует отдавать методике эндоскопической подслизистой диссекции [20]. Негативный прогноз:
поражение краёв резекции,
лимфатическая, сосудистая или периневральная инвазия,
Эндоскопическая резекция слизистой допускается при инвазивных карциномах (уровень I-II-III по Haggitt) при отсутствии факторов негативного прогноза. Инвазивные карциномы на широком основании (?T1sm1) приравниваются к уровню IV (по Haggitt) и требуют резекции соответствующего участка ободочной кишки. Адъювантная терапия не проводится [21].
При резектабельном локализованном и местнораспространенном раке ободочной кишки II–III стадий (Т2N1-2M0, T3-4N0-2M0) рекомендуется при отсутствии абсолютных противопоказаний на первом этапе проведение хирургического лечения, объём операции определяется локализацией и местным распространением опухоли [26].
При резектабельном локализованном и местнораспространенном раке ободочной кишки II–III стадий (Т2N1-2M0, T3-4N0-2M0) адъювантную химиотерапию рекомендуется проводить при выявлении поражения регионарных лимфатических узлов, прорастании опухолью серозной оболочки и факторах риска (смотри пункт адъювантная химиотерапия) [21].
При нерезектабельном раке ободочной кишки (Т4N0-2M0) рекомендуется направлять пациентов в крупные хирургические центры для повторной оценки возможности удаления опухоли [26].
Комментарии: при невозможности проведения хирургического лечения в объёме R0-1, операции возможны только при высоком риске развития кишечной непроходимости и ограничиваются формированием обходных анастомозов/колостомы/илеостомы. В дальнейшем пациентам показана паллиативная химиотерапия.
При генерализованном раке ободочной кишки с резектабельными/потенциально резектабельными синхронными метастазами в печень или лёгкие (М1а) рекомендуется при исходной возможности выполнения R0–резекции метастазов рака ободочной кишки в печень или лёгкие, а также при переходе метастатического поражения этих органов в резектабельное состояние в процессе химиотерапевтического лечения, проводить хирургические вмешательства в объёме резекции органов с метастазами в объеме R0. [38]
Рекомендуется всех больных с изолированным метастатическим поражением печени/лёгких на долечебном этапе обсуждать совместно с торакальными хирургами/хирургами-гепатологами. [38]
Комментарии: Тактика лечения зависит от исходной резектабельности метастатических очагов. Наилучших результатов возможно добиться при достижении края резекции не менее 1 см [22]. Операцию в объеме R0 необходимо выполнять, как только метастазы станут резектабельными. Пролонгация химиотерапии может приводить к повышению частоты токсических поражений печени, а также к “исчезновению” части метастазов, что затрудняет их идентификацию хирургом во время резекции. При наличии симптомной первичной опухоли (угрозе кишечной непроходимости/кровотечения) на первом этапе проводится хирургическое удаление первичной опухоли с лимфодиссекцией. Радиочастотная аблация метастазов в печень или стереотаксическое лучевое воздействие может стать как дополнением к резекции печени для достижения радикальности вмешательства, так и самостоятельным методом при невозможности хирургического лечения [23]. Внутриартериальная химиотерапия остается экспериментальным методом и не рекомендована к рутинному применению в первой линии терапии.
При исходно резектабельных метастатических очагах рекомендуется хирургическое удаление метастазов, при этом, в случае функциональной переносимости предпочтение отдаётся одномоментным хирургическим вмешательствам. [38]
При исходно резектабельных метастатических очагах после успешного проведения R0 или R1 резекции рекомендуется проведение адъювантной химиотерапии. [38]
Комментарии: альтернативой немедленному хирургическому лечению является проведение периоперационной системной химиотерапии (FOLFOX, XELOX). После 4-6 циклов выполняется одновременное или последовательное удаление метастазов и первичной опухоли, а после операции продолжается проводимая ранее химиотерапия до суммарной продолжительности 6 месяцев Добавление моноклональных антител к химиотерапии при резектабельных метастазах в печень не показано, так как может ухудшать отдаленные результаты.
При потенциально резектабельных метастатических очагах рекомендуется проведение максимально активной химиотерапии, задачи которой – достижение объективного эффекта и перевод нерезектабельных метастазов в резектабельные (FOLFOX, XELOX или FOLFIRI). [38]
При потенциально резектабельных метастатических очагах в случае отсутствия мутации RAS рекомендуется добавление к режимам химиотерапии FOLFIRI или FOLFOX анти-EGFR МКА (цетуксимаб или панитумумаб) либо бевацизумаба, при наличии в клинике лекарственных препаратов. [38]
При генерализованном раке ободочной кишки с незеректабельными синхронными метастазами рекомендуется применение комбинаций химиопрепаратов (FOLFOX, XELOX, FOLFIRI, FOLFOXIRI).
Комментарии: Возможно добавление таргетных препаратов (цетуксимаба или панитумумаба при отсутствии мутации RAS, бевацизумаба вне зависимости от статуса RAS [25]). Цель лечения – максимально длительный контроль заболевания при сохранении удовлетворительного качества жизни; у ряда пациентов возможно добиться перевода нерезектабельных метастазов в резектабельные. В процессе химиотерапии каждые 1,5-2 месяца – повторная оценка резектабельности.
Различные методы эмболизации печеночной артерии, внутриартериальная химиотерапия могут применяться у отдельных пациентов с изолированным или преобладающим метастатическим поражением печени при исчерпанности возможностей системной терапии. Вопрос об удалении первичной опухоли решается индивидуально с учётом риска развития связанных с ней осложнений. Пациенты, у которых ответ на лечение недостаточен для перевода в резектабельное состояние, подлежат паллиативному лекарственному лечению (см. раздел 3.9.4).
В случае метахронных резектабельных или потенциально резектабельных метастазов рака ободочной кишки в печень или лёгкие рекомендуется выполнить операцию с адъювантной химиотерапией в течение 6 месяцев (FOLFOX или XELOX) или периоперационную химиотерапию FOLFOX или XELOX (3 месяца до операции и 3 месяца после). В остальном лечение проводится по принципам, описанным выше [38].
При функционально неоперабельном раке ободочной кишки (на фоне тяжелой сопутствующей патологии) рекомендуется проведение паллиативного лекарственного лечения либо симптоматической терапии. Возможно стентирование опухоли или формировании разгрузочной кишечной стомы. [38]
Комментарии: Риск проведения операции превышает риск, связанный с прогрессированием онкологического заболевания. Решение о наличии противопоказаний к хирургическому лечению может приниматься только на консилиуме с участием хирурга, терапевта, анестезиолога, реаниматолога.
При рецидиве рака ободочной кишки рекомендовано рассмотреть возможность повторного хирургического лечения [26], при невозможности проведения повторного хирургического лечения рекомендована системная химиотерапия (см. раздел 4.4).
Комментарии: в сложных клинических случаях выбор лечебной тактики определяют на мультидисциплинарном консилиуме с участием хирурга-колопроктолога, гепатохирурга, лучевого терапевта и химиотерапевта на основании результатов дооперационного обследования с определением клинической стадии заболевания.
3.1 Хирургическое лечение
Эндоскопическое лечение раннего рака ободочной кишки рекомендуется выполнять при:
Тубулярно-ворсинчатых аденомах с тяжёлой степенью дисплазии эпителия
Аденокарциномах с инвазией в пределах слизистого слоя по данным УЗИ/МРТ
Умеренная или высокая степень дифференцировки аденокарцином [16, 18, 20]
Комментарии: Противопоказания:
низкодифференцированная или слизистая аденокарцинома
поражение краёв резекции
Возможные варианты:
* эндоскопическая подслизистая резекция
Наиболее частые осложнения – болевой синдром, кровотечение, перфорация.
Следует учитывать, что при последующем гистологическом исследовании препаратов эндоскопически резекцированного раннего рака ободочной кишки будет выявляться часть пациентов, которым потребуется проведение резекции соответствующего участка толстой кишки.
Рекомендуется перед операцией у всех больных раком ободочной кишки получить информированное согласие на проведение хирургического вмешательства и формирование колостомы (даже если это не предполагается в плане операции)
Не рекомендуется рутинное проведение механической подготовки кишечника [27].
Комментарии: в проведённых исследованиях использование механической подготовки кишечника не влияло на число осложнений, однако оно может выполняться, но на усмотрение оперирующего хирурга [27].
Рекомендуется при технической доступности проводить хирургическое лечение рака ободочной кишки лапароскопическим доступом 30.
Комментарии: лапароскопические резекции ободочной кишки имеют ряд преимуществ, включая раннюю реабилитацию пациентов, снижение частоты развития и выраженности спаечного процесса, меньшее использование опиоидных анальгетиков, снижение сроков госпитализации, меньший риск развития послеоперационных грыж 31.
Рекомендуется при локализации опухоли в слепой, восходящей ободочной кишке, печёночном изгибе ободочной кишки, проксимальной трети поперечной ободочной кишки выполнять правостороннюю гемиколэктомию или расширенную правостороннюю гемиколэктомию с обязательным лигированием у основания a.ileocolica, a.colica dextra, правой ветви a.colica media.
Рекомендуется при локализации опухоли в средней трети поперечной ободочной кишки решение об объёме хирургического вмешательства принимать индивидуально с учётом возраста, сопутствующих заболеваний, размеров и распространённости опухоли. Допустима резекция поперечной ободочной кишки, однако предпочтительный объём – субтотальная колэктомия.
Рекомендуется при локализации опухоли в дистальной трети поперечной ободочной кишки, селезёночном изгибе ободочной кишки, нисходящей ободочной кишке, проксимальной трети сигмовидной кишки выполнять левостороннюю гемиколэктомию или расширенную левостороннюю гемиколэктомю с лигированием a.colica sinistra, левой ветви a.colica media у места отхождения.
Рекомендуется при локализации опухоли в средней трети сигмовидной кишки выполнять резекцию сигмовидной кишки или операцию типа Гартмана (при наличии противопоказаний к формированию первичного анастомоза) с лигированием нижней брыжеечной артерии.
Рекомендуется при локализации опухоли в дистальной трети сигмовидной кишки выполнять резекцию сигмовидной кишки с чрезбрюшной резекцией прямой кишки или операцию типа Гартмана с лигированием нижней брыжеечной артерии непосредственно дистальнее уровня отхождения левой ободочной артерии.
Рекомендуется первичное удаление опухоли ободочной кишки у пациентов, поступающих для экстренного хирургического лечения по поводу осложнений рака ободочной кишки [32].
Рекомендуется учитывать тот факт, что объём выполнения оперативного вмешательства не должен различаться при экстренном и плановом хирургическом лечении рака ободочной кишки. При локализации опухоли слепой, восходящей ободочной кишки, печёночном изгибе ободочной кишки, проксимальной трети поперечной ободочной кишки рекомендовано формирование первичного анастомоза [32].
При проведении экстренного хирургического лечения по поводу рака левых отделов толстой кишки рекомендуется выполнение операций Микулича, типа Гартмана. Допустимо формирование первичного анастомоза после декомпрессии кишки [33, 34].
3.2 Адъювантная химиотерапия
Рекомендовано назначать адъювантная химиотерапию пациентам с pT4N0 или рТ1-4N+, а также может рекомендоваться пациентам с pТ3N0M0 раком ободочной кишки с факторами негативного прогноза (низкая степень дифференцировки, наличие лимфоваскулярной/периневральной инвазии, R+, операция в условиях кишечной непроходимости/перитонита, операция с неадекватным объёмом лимфодиссекции – изучено менее 12 лимфоузлов) [21].
Комментарии: общая продолжительность адъювантной химиотерапии составляет 6 месяцев. Сроки начала адъювантной терапии должны быть в рамках 28 дней с момента оперативного лечения, в случае отсутствия послеоперационных осложнений и при наличии в клинике лекарственных препаратов. Обнаруженная микросателлитная нестабильность опухоли при II стадии свидетельствует о хорошем прогнозе и проведение химиотерапии, как правило, не требуется при условии отсутствия pT4N0. Минимальный объем химиотерапии при III стадии включает в себя фторпиримидины, которые можно применять в различных вариантах: струйно (режим клиники Мейо, Roswell Park), инфузионный (режимы De Gramount, AIO) или перорально (капецитабин) (табл. 2). Оптимальный объем адъювантной химиотерапии при III стадии включает комбинацию оксалиплатина с фторпиримидинами в течение 6 месяцев. Наиболее оптимальными являются режимы FOLFOX или XELOX. Комбинация оксалиплатина со струйным фторурацилом (режим FLOX) обладает схожей эффективностью, но сопряжена с высокой токсичностью (табл. 3). При развитии симптомов полинейропатии 2-3 монотерапия фторпиримидинами. В адъювантной терапии колоректального рака не должны применяться иринотекан и моноклональные антитела, в частности, бевацизумаб и цетуксимаб, включение которых в режимы химиотерапии по результатам рандомизированных исследований не приводит к улучшению показателей выживаемости [21].
Таблица 2 – Режимы фторпиримидинов, применяемые в лечении колоректального рака
Режим
Схема
ЛВ 20 мг/м2 в/в струйно с последующим болюсом 5-ФУ 425 мг/м2, 1-5 дни.
Начало очередного курса на 29-й день.
ЛВ 500 мг/м2 в/в 2-часовая инфузия с последующим болюсом 5-ФУ 500 мг/м2.
Еженедельно в течение 6 недель с последующим 2-недельным перерывом.
ЛВ 500 мг/м2 в/в в течение 2 часов с последующей 24-часовой инфузией 5-ФУ 2600 мг/м2.
(модифицированный режим De Gramont)
ЛВ 400 мг/м2 в/в в течение 2 часов с последующим болюсом 5-ФУ 400 мг/м2 и с последующей 46-часовой инфузией 5-ФУ 2400 мг/м2 (по 1200 мг/м2 в сутки).
Начало очередного курса на 15 день.
2500 мг/м2 в сутки внутрь 1-14 дни. Начало очередного курса на 22 день.
Таблица 3 – Режимы оксалиплатина и фторпиримидинов, применяемые в лечении колоректального рака
Модифицированный FOLFOX 6
Оксалиплатин 85 мг/м2 2-часовая инфузия в 1-й день, ЛВ 400 мг/м2 в/в в течение 2 часов с последующим болюсом 5-ФУ 400 мг/м2 в/в струйно и 46-часовой инфузией 5-ФУ 2400 мг/м2 (по 1200 мг/м2 в сутки). Начало очередного курса на 15-й день
Оксалиплатин 130 мг/м2 в 1-й день, капецитабин 2000 мг/м2 в сутки 1-14 дни. Начало очередного курса на 22-й день
Оксалиплатин 85 мг/м2 в течение 2 часов (дни 1; 15 и 29 каждого цикла) + ЛВ 20 мг/м2 в/в струйно и с последующим болюсом 5-ФУ 500 мг/м2 еженедельно в течение 6 недель с последующим 2-недельным перерывом.
3.3 Паллиативная химиотерапия
Рекомендуется в качестве первой линии терапии у пациентов с малосимптомным процессом (статус ECOG 0-1) в отдельных случаях, возможно, назначать монотерапию (табл. 2) фторпиримидинами. При прогрессировании заболевания к режиму рекомендуется добавление оксалиплатина, а в качестве третьей линии – иринотекан и фторпиримидины 36.
Большему числу пациентов рекомендуются к применению и другие возможные варианты первой линии химиотерапии в виде двойных комбинации препаратов (FOLFOX, XELOX или FOLFIRI) на протяжении не менее 3-4 месяцев с последующей возможной поддерживающей терапией фторпиримидинами [38].
Комментарии: оксалиплатин в монотерапии малоэффективен и должен применяться в комбинации с фторпиримидинами. При прогрессировании после ранее достигнутого эффекта необходимо рассмотреть вопрос о повторном применении ранее эффективного режима.
У пациентов с клинически значимыми симптомами заболевания (ECOG 1-2) с обширной диссеминацией рекомендуется использование в первой линии двойных комбинаций препаратов (FOLFOX, XELOX или FOLFIRI) на протяжении не менее 3-4 месяцев с последующей возможной поддерживающей терапией фторпиримидинами [38].
Комментарии
Ослабленным пациентам с ECOG> 2 рекомендуется малотоксичная монохимиотерапия фторпиримидинами или симптоматическая терапия [38].
Рекомендуется к вышеперечисленным режимам добавление МКА (бевацизумаб, цетуксимаб или панитумумаб, что увеличивает продолжительность жизни, при условии наличия в клинике лекарственных препаратов [40].
Комментарии: в монотерапии бевацизумаб малоэффективен и может так применяться только в поддерживающей терапии при плохой переносимости фторпиримидинов. Рекомендуется продолжение терапии бевацизумабом в монотерапии или с фторпиримидинами (предпочтительнее) до прогрессирования заболевания. В случае дальнейшего прогрессирования возможно продолжение бевацизумаба со сменой режима. На сегодняшний день неизвестны клинические или молекулярные факторы, предсказывающие эффективность бевацизумаба. Наибольшую активность бевацизумаб демонстрирует в первой и во второй линиях терапии; добавление бевацизумаба к режимам на основе оксалиплатина или иринотекана во второй линии лечения достоверно увеличивает продолжительность жизни. Во второй линии терапии возможно применение другого антиангиогенного моноклонального антитела – афлиберцепта. В отличие от бевацизумаба моноклональные анти-EGFR антитела (цетуксимаб и панитумумаб) активны как в монотерапии, так и в комбинации с химиотерапией, но лишь у пациентов с отсутствием мутации RAS. Анти-EGFR антитела не должны применяться с капецитабином, режимами FLOX, XELOX. Самостоятельная активность цетуксимаба и панитумумаба позволяет рекомендовать их в монотерапии у пациентов в третьей – четвертой линии. Совместное применение бевацизумаба и анти-EGFR антител ухудшает результаты лечения и не рекомендуется. Сроки начала химиотерапии первой линии должны быть в рамках 28 дней с момента установки диагноза метастатического рака или удаления первичной опухоли при метастатическом раке.
Задачи паллиативной химиотерапии – увеличение продолжительности жизни, уменьшение симптомов болезни и улучшение качества жизни. Пациенты, получившие все три активных химиопрепарата (иринотекан, оксалиплатин и фторпиримидины), имеют достоверно большую продолжительность жизни. При этом не важно, за сколько линий терапии это удается реализовать. До сих пор четко не ясна оптимальная продолжительность первой линии терапии. Возможные варианты:
1) непрерывная терапия до прогрессирования заболевания или развития неприемлемой токсичности;
2) проведение лечения на протяжении не менее полугода с последующим наблюдением;
Иринотекан 180 мг/м2 90-минутная инфузия в 1-й день, ЛВ 400 мг/м2 в/в в течение 2 часов с последующим болюсом 5-ФУ 400 мг/м2 в/в струйно и 46-часовой инфузией 5-ФУ 2400 мг/м2 (по 1200 мг/м2 в сутки). Начало очередного курса на 15-й день.
Иринотекан 200 мг/м2 в 1-й день, капецитабин 1600-1800 мг/м2/сутки 1-14 дни. Начало очередного курса на 22-й день.
7,5 мг/кг в/в 90-60-30-минутная инфузия каждые 3 недели, или 5 мг/кг каждые 2 недели (в зависимости от применяемого режима химиотерапии).
4 мг/кг в/в 1-часовая инфузия каждые 2 недели (вместе с режимом FOLFIRI во второй линии терапии)
400 мг/м2 в/в 1-часовая инфузия в первый день, далее по 250 мг/м2 еженедельно
6 мг/кг в/в 1-часовая инфузия каждые 2 недели.
*режим характеризуется более высокой, чем FOLFIRI, частотой развития диареи
Проведение химиотерапии +/- таргетной терапии в соответствии с рекомендациями может быть только при условии наличия в клинике лекарственных препаратов
3.4 Симптоматическая терапия
Пациентам с острым кровотечением рекомендуется выполнить срочное эндоскопическое исследование, системную гемостатическую терапию. В зависимости от результатов исследования производят эндоскопическую остановку кровотечения. При невозможности/неэффективности эндоскопического гемостаза проводится экстренное хирургическое вмешательство [38].
При опухолевом стенозе рекомендуется установка саморасправляющегося стента в зону опухолевого стеноза или оперативное лечение (колостомия/илеостомия) [41]
В лечении болевого синдрома рекомендуется проведение дистанционной лучевой терапии, медикаментозной терапии, локорегионарной анестезии в зависимости от причины болевого синдрома [38].
При лечении асцита рекомендуется рассмотреть возможность применения диуретиков и лапароцентеза [38].
Комментарии: целью так называемой «наилучшей поддерживающей терапии» (best supportive care) является профилактика и облегчение симптомов заболевания и поддержание качества жизни пациентов и их близких, независимо от стадии заболевания и потребности в других видах терапии. В случае рака ободочной кишки меры, направленные на облегчение основных симптомов, способствуют увеличению продолжительности жизни.
4. Реабилитация
Рекомендуется проводить реабилитацию, ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств и/или химиотерапии.
5. Профилактика и диспансерное наблюдение
Рекомендуется соблюдать следующую периодичность и методы наблюдения после завершения лечения по поводу рака толстой кишки: в первые 1-2 года физикальный осмотр и сбор жалоб рекомендуется проводить каждые 3-6 месяца, на сроке 3-5 лет – 1 раз в 6-12 месяцев. После 5 лет с момента операции визиты проводятся ежегодно или при появлении жалоб. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен. Объем обследования:
Комментарии: задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала химиотерапии или хирургического лечения резектабельных метастатических очагов, рецидивных опухолей, а также выявление метахронных опухолей ободочной кишки.
Критерии оценки качества медицинской помощи
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
Выполнена морфологическая верификация диагноза до начала лечения, за исключением случаев экстренной хирургии
Выполнена оценка факторов риска прогрессирования у больных со II стадией заболевания
Определен статус генов RAS в случае метастатической болезни (IV стадия)
Выполнена консультация хирурга-гепатолога перед началом 1 курса химиотерапии (при поражении метастазами только печени)
Инфузии 5-фторурацила выполнены через центральный венозный доступ (если пациенту проводится 46 часовая в/в инфузия 5-фторурацила)
Выполнено гистологическое исследование удаленного препарата с указанием параметров (при хирургическом вмешательстве)
Выполнена периоперационная антибиотикопрофилактика (при хирургическом вмешательстве)
Отсутствие тромбо-эмболических осложнений в период госпитализации
Отсутствие кровотечения в раннем послеоперационном периоде (при хирургическом вмешательстве)
Выполнен 1 курс химиотерапии не позже 28 дня от выявления метастатической болезни или хирургического удаления первичной опухоли при наличии метастазов (в отсутствии послеоперационных осложнений)
Выполнен 1 курс адъювантной химиотерапии не позже 28 дней от хирургического лечения (у пациентов, кому показано проведение адъювантной химиотерапии, при условии отсутствия послеоперационных осложнений)
Выполнено хирургическое вмешательство в течение 14 дней с момента госпитализации (перевода) в хирургическое отделение (при наличии медицинских показаний и отсутствии противопоказаний)
Список литературы
Terzi?c, J.; Grivennikov, S.; Karin, E.; Karin, M. Inflammation and colon cancer. Gastroenterology 2010, 138, 2101–2114
Johns, L.E.; Houlston, R.S. A systematic review and meta-analysis of familial colorectal cancer risk. Am. J. Gastroenterol. 2001, 96, 2992–3003.
Tenesa, A.; Dunlop, M.G. New insights into the aetiology of colorectal cancer from genome-wide association studies. Nat. Rev. Genet. 2009, 10, 353–358.
Huxley, R.R.; Ansary-Moghaddam, A.; Clifton, P.; Czernichow, S.; Parr, C.L.;Woodward, M. The impact of dietary and lifestyle risk factors on risk of colorectal cancer: A quantitative overview of the epidemiological evidence. Int. J. Cancer 2009, 125, 171–180.
Watson, A.J.M.; Collins, P.D. Colon cancer: A civilization disorder. Dig. Dis. 2011, 29, 222–228.
Meyerhardt, J.A.; Catalano, P.J.; Haller, D.G.; Mayer, R.J.; Macdonald, J.S.; Benson, A.B.; Fuchs, C.S. Impact of diabetes mellitus on outcomes in patients with colon cancer. J. Clin. Oncol. 2003, 21, 433–440.
Hjartaker A. et al. Subsite-specific dietary risk factors for colorectal cancer: a review of cohort studies. J Oncol 2013, Article ID 703854, 14 pages (2013).
Theodoratou E. et al. Associations between dietary and lifestyle risk factors and colorectal cancer in the Scottish population. Eur J Cancer Prev 23, 8–17 (2014).
Rasool S., Kadla S. A., Rasool V. & Ganai B. A. A comparative overview of general risk factors associated with the incidence of colorectal cancer. Tumor Biol 34, 2469–2476 (2013).
Esposito K. et al. Colorectal cancer association with metabolic syndrome and its components: A systematic review with meta-analysis. Endocrine 44, 634–647 (2013).
Larsson S. C., Orsini N. & Wolk A. Diabetes mellitus and risk of colorectal cancer: a meta-analysis. J Natl Cancer Inst 97, 1679–1687 (2005)
Raskov H., Pommergaard H. C., Burcharth J. & Rosenberg J. Colorectal carcinogenesis—update and perspectives. World J Gastroentero 20, 18151–18164 (2014)
Donohoe C, O’farrell N, Doyle S, Reynolds J (2014). The role of obesity in gastrointestinal cancer: evidence and opinion. Therap Adv Gastroenterol, 7, 38-50.
Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2008 г.//Вестник Российского онкологического центра им. Н.Н.Блохина РАМН. Том 21, №2 (прил.2). 2010.
Finan PJ, Ritchie JK, Hawley PR. Synchronous and «early» metachronous carcinomas of the colon and rectum. Br J Surg 1987; 74:945-47.
Barillari P, Ramacciato G, De Angelis R et al. Effect of preoperative colonoscopy on the incidence of synchronous and metachronous neoplasms, Acta Chir Scand 1990; 156: 163-166
Computed tomographic colonography compared with colonoscopy or barium enema for diagnosis of colorectal cancer in older symptomatic patients: two multicentre randomised trials with economic evaluation (the SIGGAR trials). Health Technol Assess. 2015 Jul;19(54):1-134.
Starck M, Bohe M, Simanaitis M, Valentin L. Rectal endosonography can distinguish benign rectal lesions from invasive early rectal cancers. Colorectal Dis. 2003 May; (3):246-50.
Niekel MC, Bipat S, Stoker J, et al. Diagnostic imaging of colorectal liver metastases with CT, MR imaging, FDG PET, and/or FDG PET/CT: a meta-analysis of prospective studies including patients who have not previously undergone treatment. Radiology. 2010 Dec; 257(3):674-84.
Федянин М.Ю., Трякин А.А., Тюляндин С.А. Адъювантная химиотерапия рака толстой кишки. // Фарматека №7(220) 2011, с.21-27.
Oshowo A, Gillams A, Harrison E, et al. Comparison of resection and radiofrequency ablation for treatment of solitary colorectal liver metastases. Br J Surg. 2003 Oct; 90(10):1240-3
Falcone A., Cremolini C., Masi G., et al. FOLFOXIRI/bevacizumab (bev) versus FOLFIRI/bev as first-line treatment in unresectable metastatic colorectal cancer (mCRC) patients (pts): Results of the phase III TRIBE trial by GONO group. J Clin Oncol. 31, 2013 (suppl; abstr 3505).
Федянин М.Ю., Трякин А.А., Тюляндин С.А. Потенциальные предикторы эффективности анти-EGFR-терапии при метастатическом раке толстой кишки. // Онкологическая колопроктология 2013, №2, стр.21-30.
Landmann RG, Weiser MR. Clin Colon Rectal Surg. 2005 Aug;18(3):182-9. Surgical management of locally advanced and locally recurrent colon cancer.
G?enaga KF, Matos D, Wille-J?rgensen P. Cochrane Database Syst Rev. 2011 Sep 7; (9):CD001544. Epub 2011 Sep 7)
Lacy, A.M., et al. Laparoscopy-assisted colectomy versus open colectomy for treatment of non-metastatic colon cancer: a randomised trial. Lancet, 2002. 359(9325): p. 2224-9
Veldkamp, R., et al., Laparoscopic surgery versus open surgery for colon cancer: short-term outcomes of a randomised trial. Lancet Oncol, 2005. 6(7): p. 477-84
Guillou, P.J., et al., Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer (MRC CLASICC trial): multicentre, randomised controlled trial. Lancet, 2005. 365(9472): p. 1718-26
Fleshman, J., et al., Laparoscopic colectomy for cancer is not inferior to open surgery based on 5-year data from the COST Study Group trial. Ann Surg, 2007. 246(4): p. 655-62; discussion 662-4
De Salvo GL, Gava C, Lise M et al. Curative surgery for obstruction from primary left colorectal carcinoma: Primary or staged resection. The Cochrane Database of Systematic Reviews 2006 Issue 2
Khot UP, Lang AW, Murali K, Parker MC. Systematic review of the efficacy and safety of colorectal stents. Br J Surg 2002; 89 (9): 1096-1020.
Meyer F, Marusch F, Coch A, Meyer L, Fuhrer S, Kockerling F, et al. the German Study Group ‘Colorectal Carcinoma (Primary Tumor)’ Emergency operation in carcinomas of the left colon: value of Hartmann»s procedure. Tech Coloproctol. 2004;8:S226–9
Seymour MT, Maughan TS, Ledermann JA et al. Different strategies of sequential and combination chemotherapy for patients with poor prognosis advanced colorectal cancer (MRC FOCUS): a randomised controlled trial. Lancet 2007; 370: 143-152.
Cunningham D, Sirohi B, Pluzanska A et al. Two different first-line 5-fluorouracil regimens with or without oxaliplatin in patients with metastatic colorectal cancer. Ann Oncol 2009; 20: 244–250.
Ackland SP, Jones M, Tu D et al. A meta-analysis of two randomised trials of early chemotherapy in asymptomatic metastatic colorectal cancer. Br J Cancer 2005; 93: 1236–1243
Schmoll HJ, Van Cutsem E, Stein A et al. ESMO consensus guidelines for management of patients with colon and rectal cancer. A personalized approach to clinical decision making. Ann Oncol 2012; 23: 2479–2516.
Tournigand C, Andre T, Achille E et al. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol 2004; 22: 229–237.
Rosa B, de Jesus JP, de Mello EL, et al. Effectiveness and safety of monoclonal antibodies for metastatic colorectal cancer treatment: systematic review and meta-analysis. Ecancermedicalscience. 2015 Oct 15; 9:582.
Bayraktar B, Ozemir IA, Kefeli U, et al. Colorectal stenting for palliation and as a bridge to surgery: A 5-year follow-up study. World J Gastroenterol. 2015 Aug 21; 21(31):9373-9.
Приложение А1. Состав рабочей группы
Ананьев В.С., профессор, д.м.н., ведущий научный сотрудник отделения хирургического N3 проктологическое ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России;
Артамонова Е.В., д.м.н., ведущий научный сотрудник отделения амбулаторной химиотерапии (дневной стационар) ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России;
Ачкасов С.И., профессор, д.м.н., руководитель отдела онкологии и хирургии ободочной кишки ФГБУ «Государственный научный центр колопроктологии им. А.Н. Рыжих» Минздрава России;
Барсуков Ю.А., профессор, д.м.н., главный научный сотрудник отделения хирургического N3 проктологическое ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России;
Гордеев С.С., к.м.н., врач-онколог отделения хирургического N3 проктологическое ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России;
Карачун А.М., профессор, д.м.н. заведующий хирургическим отделением абдоминальной онкологии ФГБУ «НИИ онкологии им. Н.Н. Петрова» Минздрава России. сотрудник кафедры онкологии Северо-Западного
государственного медицинского университета им. И.И. Мечникова;
Личиницер М.Р., академик РАН, профессор, д.м.н., заведующий отделением химиотерапии и комбинированного лечения злокачественных опухолей ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России;
Расулов А.О., д.м.н., заведующий отделения хирургического N3 проктологическое ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России;
Сагайдак И.В., профессор, д.м.н., главный научный сотрудник отделения хирургического N7 опухолей печени и поджелудочной железы ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России;
Трякин А.А., д.м.н., старший научный сотрудник отделения клинической фармакологии и химиотерапии ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России;
Федянин М.Ю., к.м.н., старший научный сотрудник отделения клинической фармакологии и химиотерапии ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России;
Шелыгин Ю.А. академик РАН, профессор, д.м.н., президент Общероссийской общественной некоммерческой организации «Ассоциация колопроктологов России», директор ФГБУ «ГНЦК им. А.Н. Рыжих» Минздрава России, главный внештатный специалист колопроктолог Министерства здравоохранения РФ.
Конфликта интересов нет.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
Студенты медицинских ВУЗов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме РБ в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица П1 – Уровни достоверности доказательств в соответствии с классификацией Агентства по политике медицинского обслуживания и исследований (AHCPR, 1992)
Уровни достоверности доказательств
Описание
Доказательность, основанная на мета-анализе рандомизированных контролируемых исследований
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном
Доказательность, основанная как минимум на одном крупном нерандомизированном контролируемом исследовании
Доказательность, основанная как минимум на одном квазиэксперементальном исследовании с хорошим дизайном
Доказательность, основанная на неэкспериментальных описательных исследованиях с хорошим дизайном, типа сравнительных исследований, корреляционных исследований и исследований случай-контроль
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов
Таблица П2 – Уровни убедительности рекомендаций в соответствии с классификацией Агентства исследований и оценки качества медицинского обслуживания (AHRQ, 1994)
Уровень убедительности рекомендации
Уровни достоверности доказательств
Описание
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном
Доказательность, основанная на хорошо выполненных нерандомизированных клинических исследованиях
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов. Указывает на отсутствие исследований высокого качества
Методы, использованные для формулирования рекомендаций – консенсус экспертов.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
Внешняя экспертная оценка
Внутренняя экспертная оценка
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей-детских онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка: Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем один раз в три года с учетом появившейся новой информации о диагностике и тактике ведения пациентов с РБ. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Приложение Б. Алгоритмы ведения пациента
Приложение В. Информация для пациентов
1) При повышении температуры тела 38?C и выше:
Начать прием антибиотиков: по рекомендации химиотерапевта
2) При стоматите:
Диета – механическое, термическое щажение;
Частое полоскание рта (каждый час) – ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом;
Обрабатывать полость рта по рекомендации химиотерапевта
3) При диарее:
Диета – исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье.
Принимать препараты по рекомендации химиотерапевта
4) При тошноте:
Принимать препараты по рекомендации химиотерапевта
Приложение Г.
Методы исследования
Сроки контрольных обследований пациента после завершения лечения
1 год
2 год
3 год
4-5 годы
Далее
3 мес.
6 мес.
9 мес.
12 мес.
3 мес.
6 мес.
9 мес.
12 мес.
3 мес.
6 мес.
9 мес.
12 мес.
3 мес.
6 мес.
9 мес.
12 мес.
3 мес.
6 мес.
9 мес.
12 мес.
Консультация врача-онколога (сбор жалоб +физикальный осмотр)