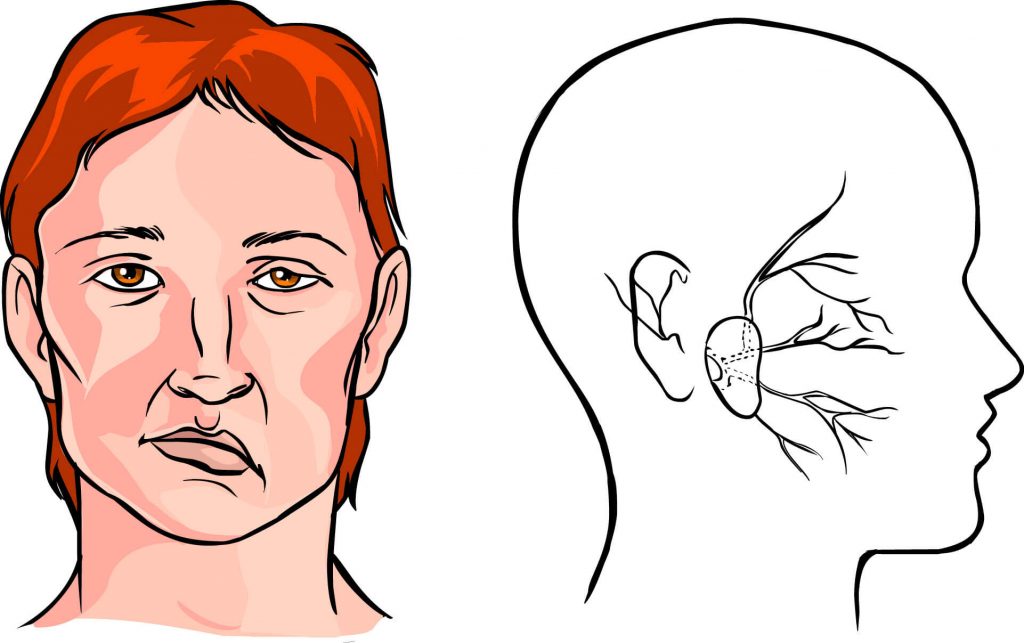
После инсульта болит парализованная нога что делать
Что делать если при инсульте парализовало правую сторону?
Нередко после ОНМК ставят диагноз «инсульт парализация правой стороны тела» – это серьезное осложнение нарушения мозгового кровообращения, которое говорит о поражении левого полушария большого мозга. По частоте встречаемости такие синдромы лидируют, это объясняется особенностями анатомии и физиологии сосудистой системы.
Этиопатогенез
Главным механизмом развития паралича является инсульт – повреждение артерии с выходом крови за пределы сосудистого русла. В результате образуется гематома, которая постепенно растет и сдавливает мозговую ткань. Жизненно важные нейроны погибают, отмечается выпадение функций, снижается контроль скелетной и гладкой мускулатуры, пропадает чувствительность.
К такому состоянию предрасполагают:
Перечисленные факторы могут спровоцировать как левый, так и правый паралич. По статистике последний вариант отмечается чаще, что повышает шансы больного на выживание в силу своевременной диагностики.
Виды паралича
После инсульта перед врачом стоит главная задача – определить наличие паралича и его разновидность. Все кровоизлияния правой и левой стороны подразделяются на две категории:
Признаки правостороннего паралича
Если был инсульт в левое полушарие – у больного поражена правая сторона тела, мускулатура конечностей парализована и речь отсутствует. Это главные отличия такого состояния. Также у больных появляются следующие признаки:
Перечисленные симптомы наблюдаются через несколько минут после кровоизлияния. На фоне ухудшения самочувствия у пациента развивается стресс, сопровождаемый депрессией и сложностями в общении.
Последствия правостороннего паралича
В тяжелых случаях правостороннее поражение приводит к необратимым осложнениям, которые развиваются вследствие объемного кровоизлияния или нарушения правил лечения. Перечислим наиболее часто встречаемые состояния:
Главная задача врача – создание условий, обеспечивающих полноценное восстановление после инсульта правой стороны, которые сведут к минимуму развитие осложнений.
Лечение
Терапевтическая программа направлена на восстановление кровообращения и питания в зоне поражения, предотвращение сосудистых расстройств и повторных инсультов. Лечение включает применение медикаментов, мероприятия по реабилитации и профилактики.
Медикаментозная терапия
Если при инсульте парализована правая сторона, начать следует с лекарственной терапии. Препаратами выбора являются:
Доктор назначает препараты, руководствуясь состоянием больного. В тяжелых случаях выписывается полный список, проводится суточный мониторинг давления.
Реабилитация
Главной задачей восстановления после инсульта является возвращение движений в правой стороне, речи и памяти. Начать следует с диеты, дополнив процедуры массажем, лечебной физкультурой и посещением логопеда (комплексной реабилитации).
Диета
Режим питания необходим для улучшения кровообращения и поддержания сопротивляемости иммунитета. Хорошо подобранный стол должен содержать все необходимое для регенерации поврежденных тканей, но не перегружать ослабленный организм.
Основные правила по диете следующие:
Для тяжелобольных пациентов меню составляет диетолог с учетом состояния организма и необходимых энергетических затрат.
Массаж
Этот метод направлен на профилактику пролежней и применяется с первых дней возникновения паралича. Проводится разминка правой стороны тела, после которой улучшается кровообращение, трофика тканей, восстанавливается подвижность в суставах.
Для устранения последствий паралича стандартная разминка включает:
Чтобы не возникало новых пролежней, рекомендуется делать массаж ежедневно, регулярно менять положение больного и растирать кожу спиртом (при отсутствии ран).
Лечебная физкультура применяется спустя 2-3 недели после атаки при учете положительной динамики. Ее главными задачами являются:
Для составления комплекса лучше обратиться к врачу, доктор подбирает индивидуальную программу с учетом утраченных функций и работы конечностей.
Посещение логопеда
Для восстановления речи необходимы ежедневные тренировки, которые будет контролировать специалист. Пациенту даются домашние задания, включающие систематические упражнения.
Задачами такой терапии являются:
Очень важно, чтобы человек не только научился разговаривать, но и понимал речь окружающих. Специалисты рекомендуют пациентам не замыкаться, а постоянно контактировать с людьми.
Оцените на сколько качественно и подробно описана информация
Реабилитация после инсульта в домашних условиях
Реабилитация после инсульта в домашних условиях
Нарушение мозгового кровообращения приводит к таким последствиям, как частичный или полный паралич, потерю речи, памяти, слуха. Но грамотная реабилитация после инсульта позволяет вернуть человеку утраченные способности. В домашних условиях провести полноценное лечение и обеспечить последующее восстановление возможно, если заранее понять, что ожидает людей, близких больному, какие мероприятия потребуется проводить.
Длительность восстановительного периода
Сколько времени нужно для реабилитации после перенесенного инсульта, зависит от обширности повреждений, степени проявления возникших нарушений, возраста пациента и других факторов. Постепенно на месте погибших нейронов могут образоваться новые. Часть функций, выполняемых поврежденными отделами мозга, может быть перенесена на здоровые структуры.
При легкой форме ишемического инсульта, в результате которой у человека возникает нетяжелый паралич конечностей, лицевых мышц, нарушение зрения и координации, для частичного восстановления понадобится один-два месяца. Для полного – около трех месяцев.
Если последствия нарушения мозгового кровообращения проявляются в виде стойких нарушений координации, грубого паралича, срок реабилитации будет длиться не менее полугода. При этом шанс на возвращение всех утраченных навыков минимален.
После тяжелого инсульта, повлекшего паралич одной стороны тела и другие проблемы, от начала лечения до возвращения больному способности сидеть и обслуживать себя проходит от одного до двух лет. О полном исцелении в данном случае говорить невозможно.
Уровни восстановления нормальных функций организма у людей, перенесших инсульт, делятся на три группы:
Основным условием для успешной реабилитации после инсульта является готовность самого больного и близких ему людей пройти долгий путь, не сдаваясь и не прерывая занятий.
Паралич мышц ног причины, способы диагностики и лечения
Паралич мышц ног — это симптом неврологического заболевания, который выражается в нарушении двигательных функций и полной обездвиженности. Может быть временным или постоянным, в зависимости от причины появления и интенсивности развития. Если двигательная активность ограничена частично — это парез ноги, его вылечить проще и быстрее. Патология — не самостоятельная болезнь, а признак серьёзных проблем в организме, которые нуждаются в незамедлительном лечении. Обращаться следует к неврологу, иногда может понадобиться помощь нейрохирурга.
Причины паралича мышц ног
Паралич в медицине называется плегия и представляет собой дегенеративные изменения мышц нижних конечностей — атрофию, потерю чувствительности, снижение тонуса. Неврологические дефекты возникают из-за поражений и нарушений целостности спинного или головного мозга, но также могут развиваться по другим причинам:
Статью проверил
Дата публикации: 24 Марта 2021 года
Дата проверки: 24 Марта 2021 года
Дата обновления: 17 Декабря 2021 года
Содержание статьи
Типы паралича мышц ног
Паралитические нарушения мышц ног подразделяются на несколько типов:
Такие виды патологий характеризуются невозможностью делать осознанные движения, ходить, иногда и сидеть. Возможно поражение отдельных частей мышечной группы или всей сразу. Паралич обеих ног обычно бывает врождённым или возникает после осложнённых форм инфекционных заболеваний.
В зависимости от очага поражения, бывают плегии:
Методы диагностики
Диагностирование парезов и парализации конечностей проходит в два этапа — осмотр, сдача анализов и прохождение аппаратных обследований. Первый этап включает:
Второй этап — инструментальные исследования — включает:
В сети клиник ЦМРТ можно диагностировать симптом с помощью достоверных методик:
Постинсультная спастичность
В России более миллиона больных, перенесших инсульт. Более чем у половины из них остаются после него двигательные нарушения, которые существенно снижают качество жизни и способствуют стойкой инвалидности (инвалидизации) пациентов [1]: чаще всего это гемип
В России более миллиона больных, перенесших инсульт. Более чем у половины из них остаются после него двигательные нарушения, которые существенно снижают качество жизни и способствуют стойкой инвалидности (инвалидизации) пациентов [1]: чаще всего это гемипарез или монопарез конечности с повышением мышечного тонуса по типу спастичности [1, 2, 9, 20].
Патогенез постинсультной спастичности
Спастичность выявляется при исследовании пассивных движений в паретичной конечности как повышенное сопротивление (сокращение) мышцы при ее быстром растяжении. Развитие спастичности при центральном парезе конечности связывается со снижением тормозных влияний на спинальные мотонейроны и интернейроны, что приводит к увеличению числа импульсов, достигающих альфа-мотонейронов в ответ на растяжение мышцы. Снижение тормозных влияний на спинальные мотонейроны и интернейроны объясняется комбинированным поражением пирамидных и экстрапирамидных путей внутри головного мозга вследствие инсульта, при этом важную роль в развитии спастичности отводят повреждению кортико-ретикуло-спинального тракта [2, 16, 20].
В экспериментальных исследованиях показано, что изолированное поражение пирамидного пути не вызывает спастичности, а приводит лишь к парезу в дистальных отделах конечностей, особенно утрате тонких движений руки. В случаях поражения головного мозга при инсульте обычно возникает поражение не только пирамидного пути, но и других двигательных путей, таких как кортико-ретикуло-спинальный тракт, что и сопровождается спастичностью. Поэтому постинсультная спастичность рассматривается как комбинированное поражение пирамидных и экстрапирамидных структур внутри головного мозга [2, 16, 20]. Экстрапирамидная система внутри головного мозга может быть повреждена вследствие поражения самих базальных ганглиев или приходящих либо исходящих от них путей.
В развитии церебральной спастичности при поражении головного мозга большую роль играет ослабление тормозных влияний преимущественно на альфа-мотонейроны, обеспечивающих движение антигравитационных мышц; это объясняет появление характерных проявлений постинсультного спастического гемипареза: приведение плеча, сгибание руки в локтевом и лучезапястном суставах, приведение бедра, разгибание колена и подошвенное сгибание в голеностопном суставе [2, 16, 20].
У больных инсультом спастичность обычно нарастает в паретичных конечностях в течение нескольких недель и месяцев, сравнительно редко (чаще всего при восстановлении двигательных функций) наблюдается спонтанное уменьшение спастичности. Во многих случаях у больных инсультом спастичность ухудшает двигательные функции, способствует развитию контрактуры и деформации конечности, затрудняет уход за обездвиженным больным и иногда сопровождается болезненными мышечными спазмами [2, 5, 9, 11, 20].
Если постинсультный парез сохраняется в течение длительного времени (несколько месяцев и более), то могут возникнуть структурные изменения сегментарного аппарата спинного мозга (укорочение дендритов альфа-мотонейронов и коллатеральный спрутинг афферентных волокон, входящих в состав задних корешков), которые способствуют прогрессированию спастичности [16]. Также развиваются вторичные изменения в паретичных мышцах, сухожилиях и суставах, которые усиливают двигательные расстройства и сопротивление, возникающее в мышце при ее растяжении, что необходимо учитывать при оценке мышечного тонуса в паретичных или парализованных конечностях [16, 20].
Восстановление утраченных двигательных функций максимально в течение двух-трех месяцев с момента инсульта, в дальнейшем темпы восстановления снижаются значительно. Через год после развития инсульта маловероятно уменьшение степени пареза, однако возможно улучшение двигательных функций и уменьшение инвалидности путем тренировки равновесия и ходьбы, использования специальных приспособлений для передвижения и снижения спастичности в паретичных конечностях [1, 2, 9, 11, 20].
Лечение постинсультной спастичности
Лечение постинсультной спастичности направлено на улучшение функциональных возможностей паретичных конечностей, ходьбы, самообслуживания больных. К сожалению, в части случаев возможности лечения спастичности ограничиваются только уменьшением боли и дискомфорта, связанного с высоким мышечным тонусом, облегчением ухода за парализованным пациентом или устранением имеющегося косметического дефекта, вызванного высоким мышечным тонусом [2, 11, 20].
Один из наиболее важных вопросов, который приходится решать при ведении больного с постинсультной спастичностью, сводится к следующему: ухудшает или нет спастичность функциональные возможности больного? В целом, функциональные возможности конечности у больного с постинсультным парезом конечности хуже при наличии выраженной спастичности, чем при ее легкой степени. Вместе с тем у части больных при выраженной степени пареза спастичность в мышцах ноги может облегчать стояние и ходьбу, а ее снижение может привести к ухудшению двигательной функции и даже к падениям [2, 11, 16, 20]. Перед лечением постинсультной спастичности необходимо определить возможности лечения у конкретного больного (улучшение двигательных функций, уменьшение болезненных спазмов, облегчение ухода за пациентом и др.) и обсудить их с пациентом и/или его родственниками. Возможности лечения во многом определяются сроками с момента заболевания и степенью пареза, наличием когнитивных расстройств [2, 11, 16, 20]. Чем меньше сроки с момента развития инсульта, вызвавшего спастический парез, тем более вероятно улучшение от лечения спастичности, потому что оно может привести к существенному улучшению двигательных функций, предотвратив формирование контрактур и повысив эффективность реабилитации в период максимальной пластичности центральной нервной системы. При длительном сроке заболевания менее вероятно существенное улучшение двигательных функций, однако можно значительно облегчить уход за больным и снять дискомфорт, вызванный спастичностью. Чем меньше степень пареза в конечности, тем более вероятно, что лечение спастичности улучшит двигательные функции [16, 20].
Лечебная гимнастика представляет наиболее эффективное направление ведения больного с постинсультным спастическим гемипарезом, она направлена на тренировку движений в паретичных конечностях и предотвращение контрактур [1, 2, 16, 20]. Однако больным, имеющим выраженную спастичность в сгибателях верхних конечностей, не следует рекомендовать интенсивные упражнения, которые могут значительно усилить мышечный тонус (например, сжимание резинового кольца или мяча, использование эспандера для развития сгибательных движений в локтевом суставе).
В качестве методов физиотерапии используются лечение положением, обучение пациентов стоянию, сидению, ходьбе (с помощью дополнительных средств и самостоятельно), бинтование конечности, применение ортопедических аппаратов, тепловые воздействия на спастичные мышцы, а также электрическая стимуляция определенных мышечных групп (например, разгибателей пальцев кисти или передней большеберцовой мышцы [4]).
Массаж мышц паретичных конечностей, имеющих высокий мышечный тонус, возможен только в виде легкого поглаживания. Напротив, в мышцах-антагонистах можно использовать растирание и неглубокое разминание в более быстром темпе.
Иглорефлексотерапия относительно часто используется в нашей стране в комплексной терапии больных, имеющих постинсультный спастический гемипарез, однако контролируемые исследования, проведенные за рубежом, не показывают существенной эффективности этого метода лечения [8].
У больных, перенесших инсульт и имеющих локальную спастичность в паретичных мышцах, можно использовать ботулинический токсин типа А или ботулотоксин (Ботокс, Диспорт). Использование ботулинического токсина показано, если у больного, перенесшего инсульт, имеется мышца с повышенным тонусом без контрактуры, а также отмечаются боль, мышечные спазмы, снижение объема движений и нарушение двигательной функции, связанные со спастичностью этой мышцы [2–4, 17, 20]. Действие ботулинического токсина при внутримышечном введении вызвано блокированием нервно-мышечной передачи, обусловленным подавлением высвобождения нейромедиатора ацетилхолина в синаптическую щель.
Клинический эффект после инъекции ботулинического токсина отмечается спустя несколько дней и сохраняется в течение 2–6 месяцев, после чего может потребоваться повторная инъекция. Лучшие результаты отмечаются при использовании ботулинического токсина в ранние сроки (до года) с момента заболевания и легкой степени пареза конечности. Применение ботулинического токсина может быть особенно эффективно в тех случаях, когда имеется эквино-варусная деформация стопы, вызванная спастичностью задней группы мышц голени, или высокий тонус мышц-сгибателей запястья и пальцев, ухудшающий двигательную функцию паретичной руки [20]. В контролированных исследованиях доказана эффективность Диспорта при лечении постинсультной спастичности в руке [3].
В качестве побочных эффектов от использования ботулотоксина могут быть кожные изменения и боли в месте инъекции. Они обычно самостоятельно регрессируют в течение нескольких дней после инъекции. Возможна значительная слабость мышцы, в которую введен ботулотоксин, а также слабость в мышцах, расположенных близко к месту инъекции, локальная вегетативная дисфункция. Однако мышечная слабость обычно компенсируется деятельностью агонистов и не приводит к ослаблению двигательной функции. Ограничение широкого применения ботулинического токсина в клинической практике во многом вызвано его высокой стоимостью.
Хирургические операции для уменьшения постинсультной спастичности используются редко, они возможны на четырех уровнях — на головном мозге (электрокоагуляция бледного шара, вентролатерального ядра таламуса или мозжечка), спинном мозге (селективная задняя ризотомия), периферических нервах (рассечение периферических нервов) и мышцах или их сухожилиях [2, 16, 20].
С помощью специальной помпы интратекально при постинсультной спастичности может использоваться баклофен [10, 13, 19]. Использование баклофеновой помпы в сочетании с лечебной гимнастикой, физиотерапией улучшает скорость и качество ходьбы больных с постинсультной спастичностью, способных к самостоятельному передвижению [10]. Имеющийся 15-летний клинический опыт применения баклофена интратекально у больных, перенесших инсульт, свидетельствует о высокой эффективности этого метода в уменьшении не только степени спастичности, но и болевых синдромов и дистонических расстройств [19]. Отмечено положительное влияние баклофеновой помпы на качество жизни больных, перенесших инсульт [13]. Широкое применение этого метода терапии в клинической практике ограничивает его высокая стоимость.
Лечение пероральными антиспастическими средствами
В клинической практике для лечения постинсультной спастичности наиболее часто используются пероральные антиспастические лекарственные средства [5, 11, 12, 16]. Применяемые внутрь антиспастические средства, уменьшая мышечный тонус, могут улучшить двигательные функции, облегчить уход за обездвиженным пациентом, снять болезненные мышечные спазмы, усилить действие лечебной физкультуры и вследствие этого предупредить развитие контрактур. При легкой степени спастичности применение миорелаксантов может привести к значительному положительному эффекту, однако при выраженной спастичности могут потребоваться большие дозы миорелаксантов, применение которых нередко вызывает нежелательные побочные эффекты [2, 5, 11, 20]. Лечение миорелаксантами начинают с минимальной дозы, затем ее медленно повышают для достижения эффекта. Антиспастические средства обычно не комбинируют. В нашей стране для лечения постинсультной спастичности наиболее часто используют баклофен (Баклосан), тизанидин (Сирдалуд) и толперизон (Мидокалм).
Баклофен (Баклосан) оказывает антиспастическое действие преимущественно на спинальном уровне. Препарат представляет аналог гамма-аминомасляной кислоты (ГАМК); он связывается с пресинаптическими ГАМК-рецепторами, приводя к уменьшению выделения возбуждающих аминокислот (глутамата, аспартата) и подавлению моно- и полисинаптической активности на спинальном уровне, что и вызывает снижение спастичности. Препарат оказывает также умеренное центральное анальгезирующее действие. Баклофен используется при спинальной (спинальная травма, рассеянный склероз) и церебральной спастичности различного генеза [5, 11, 16]. Начальная доза составляет 5–15 мг/сут (в один или три приема), затем дозу увеличивают на 5 мг каждый день до получения желаемого эффекта; препарат принимают во время еды. Максимальная доза баклофена для взрослых составляет 60–75 мг/сут. Побочные эффекты чаще проявляются сонливостью, головокружением в начале лечения, хотя в дальнейшем могут ослабевать. Иногда возникают тошнота, запор, диарея, артериальная гипотония; требуется осторожность при лечении больных пожилого возраста, перенесших инсульт.
Тизанидин (Сирдалуд) — миорелаксант центрального действия, агонист альфа-2-адренергических рецепторов. Препарат снижает спастичность вследствие подавления полисинаптических рефлексов на уровне спинного мозга, что может быть вызвано угнетением высвобождения возбуждающих аминокислот и активацией глицина, снижающего возбудимость интернейронов спинного мозга. Тизанидин (Сирдалуд) обладает также умеренным центральным анальгезирующим действием. Препарат эффективен при церебральной и спинальной спастичности, а также при болезненных мышечных спазмах [5, 11, 12, 15, 16, 20]. Начальная доза препарата составляет 2–6 мг/сут в один или три приема, средняя терапевтическая доза — 12–24 мг/сут, максимальная доза — 36 мг/сут. В качестве побочных эффектов могут возникать сонливость, сухость во рту, головокружение и незначительное снижение артериального давления, что ограничивает использование препарата при постинсультной спастичности [15].
Толперизон (Мидокалм) — мышечный релаксант центрального действия, который близок к лидокаину по химической структуре и стабилизирует мембраны нервных клеток. Толперизон снижает активность спинальных нейронов, участвующих в формировании спастичности, путем ограничения потока натрия через мембрану нервных клеток. Наиболее часто используется по 300–450 мг/сут в два или три приема. Около 40 лет толперизон успешно применялся при лечении спастичности различного генеза, были проведены небольшие исследования, показавшие его эффективность при церебральной спастичности [7, 14].
Недавно было проведено плацебо-контролируемое исследование [18], в котором показана эффективность, безопасность и хорошая переносимость толперизона у больных, перенесших инсульт и имеющих спастичность в паретичных конечностях. В многоцентровое исследование (два центра в Германии и один центр в Болгарии) было включено 120 больных (43 мужчины и 77 женщин) в возрасте от 20 до 78 лет (средний возраст — 63 года) с постинсультной спастичностью. Больные перенесли инсульт в сроки от 3 месяцев до 30 лет (в среднем 3,3 года с момента инсульта) и имели спастичность, выраженность которой достигала 2 баллов и более по шкале Эшуорта в одной или нескольких мышечных группах. У большинства (111 из 120) больных наблюдался гемипарез со спастичностью в верхней и нижней конечности, средняя степень спастичности составила 3 балла по шкале Эшуорта. По основным клиническим характеристикам группа больных, которые принимали толперизон, не отличалась от группы плацебо. В течение четырех недель больные получали толперизон или плацебо, доза которых подбиралась врачом для получения максимального эффекта и могла достигать от 300 до 900 мг толперизона. Далее больные продолжали принимать толперизон или плацебо в течение еще двух месяцев (восьми недель).
Главной целью исследования было изучение влияния толперизона на выраженность спастичности по шкале Эшуорта через 4 недели лечения (в сравнении с плацебо). Дополнительные цели исследования включали изучение влияния толперизона на ежедневную двигательную активность (по пятибалльной шкале), ходьбу в течение двух минут, максимальное расстояние при ходьбе (при спастичности в нижних конечностях), индекс Бартел, общее впечатление врача и больного о лечении.
Результаты проведенного исследования показали, что толперизон достоверно (р
В. А. Парфенов, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва